张 敏,刘晓君,罗 成,陈开杰,孔令希,何海霞,周远大
(1.重庆医科大学附属第一医院药学部 400016;2.重庆市第九人民医院药剂科 400700;3.重庆市肿瘤医院药剂科 400030)
论着·基础研究
痰热清注射液对左氧氟沙星在小鼠肺组织分布的影响
张 敏1,刘晓君2#,罗 成1,陈开杰3△,孔令希1,何海霞1,周远大1
(1.重庆医科大学附属第一医院药学部 400016;2.重庆市第九人民医院药剂科 400700;3.重庆市肿瘤医院药剂科 400030)
目的 探讨痰热清注射液对左氧氟沙星在小鼠肺组织中分布的影响。方法将144只小鼠分为痰热清注射液联合左氧氟沙星实验组和左氧氟沙星对照组,两组动物分别于0.05、0.083、0.17、0.5、1.0、2.0、4.0、8.0 h和12.0 h采集肺组织,制为匀浆,高效液相色谱法检测肺组织中左氧氟沙星药物浓度,3P97程序计算药动学参数。结果实验组和对照组肺组织中药-时曲线呈二室模型,实验组和对照组肺组织中V/Ft1/2β、CL,AUCo-t分别为(1.37±0.30vs. 1.90±0.24)L、(5.21±1.96vs. 4.82±1.55)h、(0.81±0.12vs. 1.13±0.14)L/h和(117.69±22.89vs. 84.91±11.33)mg·h-1·kg-1,组间差异有统计学意义(P<0.05)。表明痰热清注射液能提高左氧氟沙星在小鼠肺组织中的分布量和滞留时间。结论痰热清注射液联合左氧氟沙星可提高左氧氟沙星在小鼠肺组织中的药物浓度并延长滞留时间长。
痰热清注射液;左氧氟沙星;高效液相色谱;分布
呼吸道感染是常见病、多发病,严重危害人们的健康。近年来由于社会人口的老龄化,病原体变迁,抗菌药物的耐药率上升,临床治愈有所下降,除应用抗菌药物外,还常常采用联合使用相关中药治疗。有文献报道,痰热清注射液联合左氧氟沙星注射液治疗上、下呼吸道感染临床效果显着,能明显改善临床症状,治愈率显着提高[1-4]。研究表明,痰热清注射液对肺炎链球菌、嗜血流感杆菌、乙型溶血链球菌、金黄色葡萄球菌有抑制作用,并能降低内毒素升高体温的作用[1-5]。此外,有研究认为痰热清注射液可抑制炎症渗出和肺间质水肿,抑制或减轻炎性细胞浸润,阻止急性肺泡细胞炎症损伤,改善低氧状态,同时可以降低内毒素炎性细胞因子的表达水平,以达到抗菌消炎的目的[6-7]。以上研究均表明,痰热清注射液及左氧氟沙星在肺部病变的临床疗效和产生作用的机制,为此,作者探讨了痰热清注射液对左氧氟沙星在小鼠肺组织内分布的影响,现报道如下。
1 材料与方法
1.1 实验动物 健康合格昆明种小鼠144只,SPF级,体质量18~21 g,雌雄各半,由重庆医科大学实验动物中心提供,动物使用合格证号:SCXK(渝)2012-0002。
1.2 仪器与试剂 日本岛津LC-20梯度高效液相色谱仪系统(泵系统,可调波长紫外检测器、自动进样系统和Labsolution工作站)。痰热清注射液,规格:20 mL/瓶,由上海凯宝药业股份有限公司提供,批号1205209。乳酸左氧氟沙星注射液由浙江医药股份有限公司新昌制药厂生产,批号140346。左氧氟沙星标准对照品(L-fox),纯度97.3%,批号130455-200604,中国药品生物制品检定出品。环丙沙星(CF,内标即IS)纯度98.16%,批号060402,重庆药友制药有限公司提供。甲醇、二氯甲烷为色谱纯;其他试剂为分析纯;水为双蒸水。
1.3 方法
1.3.1 色谱条件 色谱柱为Amethyst C18-Ⅱ 5 μm粒径,100×4.6 mm ID,预柱;固定进样环100 μL;流动相:甲醇-0.008 mol/L 磷酸盐缓冲液-0.5 mol/L 四丁基溴化铵为25∶75∶4,流速0.4 mL/min;紫外检测波长290 nm;柱温40 ℃。
1.3.2 血液和肺组织的收集 144只小鼠分为实验组和对照组,每组72只,按实验时间分为0.05、0.083、0.17、0.5、1、2、4、8 h和12 h共9个小组,每组8只小鼠。实验前,实验组小鼠静脉注射痰热清注射液0.8 mL/kg(痰热清注射液用5%葡萄糖注射液按1∶3稀释后缓慢注射),而对照组小鼠静脉注射等容量生理盐水,给药后1 h,各组动物均静脉注射左氧氟沙星注射液73.3 mg/kg。给药后分别于0.05、0.083、0.17、0.5、1、2、4、8 h和12 h处死相应组小鼠,收集肺组织,并将肺组织称重后制为匀浆,均置于-20 ℃低温冰箱待测。
1.3.3 样品处理 取肺组织匀浆0.5 mL+IS 10 μL(CF:33.616 μg/mL )+3 mL CH2Cl2,旋摇 1 min,3 000 r/min 离心 2 min,取 CH2Cl2存于5 mL 离心管中,置于40 ℃水浴中,氮气吹干。用0.1 mL流动相复溶,自动进样40 μL。
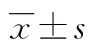
2 结 果
2.1 色谱行为 在本实验所采用的色谱条件下,血浆中左氧氟沙星的tR为5 min左右,CF的tR 为7 min左右,二者峰形良好,且不受血浆内源性物质的干扰。
2.2 方法学研究
2.2.1 标准曲线、线性关系与最低定量浓度 在空白肺组织匀浆中分别添加左氧氟沙星使血药浓度相当于0.076 5、0.153、0.306、0.612、1.224、2.448、4.896和9.792 μg/mL,按“1.3.3”方法操作,将所得左氧氟沙星峰面积/CF峰面积比(Y)与L-fox浓度(X)数据进行回归,得标准曲线方程Y=3.968 0X-0.097 58;在9.792~0.076 5 μg/mL范围内线性关系良好,r=0.999 6(n=5);最低定量浓度为 0.076 5 μg/mL(RSD=17.44%,n=5)。
2.2.2 精密度和重复性 取高、中、低 3 种质控样本(9.792、1.224、0.153 μg/mL),每个浓度5份,考察批内和批间变异。批内误差(每个浓度同日内测定5次)、日内变异性结果及批间误差(每个浓度2周内测定5次)日间变异性结果,见表1。
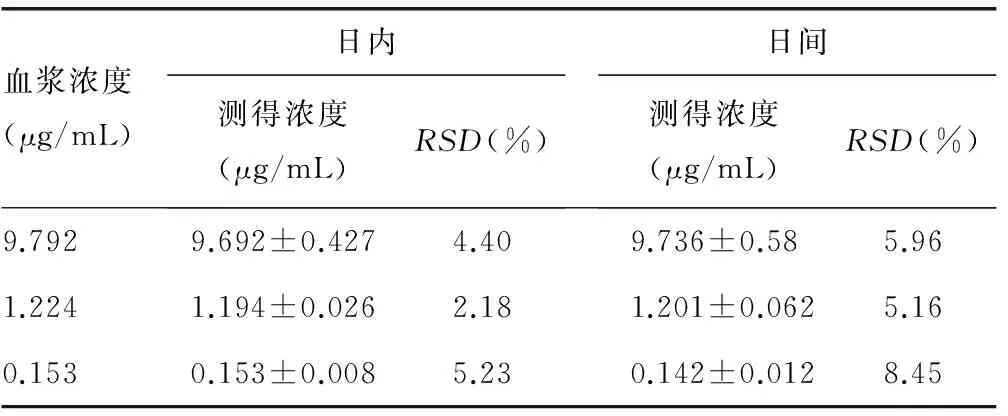
表1 精密度及重复性试验结果
2.2.3 回收率 取高、中、低 3 种浓度的肺组织匀浆质控样本(9.792、1.224、0.153 μg/mL ),每个浓度5份,按规定方法评价本法的回收率。结果,高、中、低浓度的回收率分别为(99.16±3.24)%、(100.57±5.12)%和(104.02±5.88)%。
2.2.4 稳定性考察 取高、中、低 3 种肺组织匀浆质控样本(9.792、1.224、0.153 μg/mL),每个浓度3份,按“1.3.2”项方法操作并测定。室温25 ℃左右,放置24 h测定5次;冷藏(4 ℃冰箱),10 d内测定5次;低温(-20 ℃冰箱),反复冷冻、融化,3周内测定 5次。结果表明,在室温、冷藏、反复冻融条件下,血浆中左氧氟沙星的稳定性均良好,见表2。

表2 血浆中左氧氟沙星的稳定性试验测定结果(n=5)
2.3 药-时曲线 实验组与对照组左氧氟沙星的平均血药浓度-时间曲线见图1。药时数据经3p97软件自动拟合,二组均数均符合二室模型。
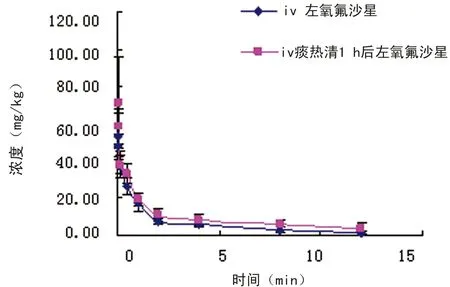
图1 2组平均肺组织药物浓度-时间曲线(n=8)
2.4 药动学参数 2组受试小鼠肺组织药物浓度-时间数据采用计算机 3p97 程序自动拟合,结果表明左氧氟沙星的药-时数据均符合二室药动学模型。有关药动学参数,见表3。
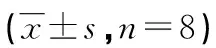
表3 2组主要药动学参数比较
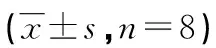
续表3 2组主要药动学参数比较
*:P<0.05,**P<0.01,与对照组比较。
3 讨 论
有关左氧氟沙星的检测方法已有很多报道[8-10],如HPLC-UV法、HPLC-荧光法及LC-MS/MS法等;因经济实惠实际采用最多的是HPLC-UV法。本文所建立的HPLC-UV法是作者长期多次用于人血浆、尿液,动物血浆、尿液、胆汁及组织中左氧氟沙星浓度测定的方法;本方法成熟、准确、可靠,方法学研究指标均能达到和满足试验要求。
药物吸收进入血液循环后,向各器官组织转运分布,且在各器官组织中的浓度与其在该组织作用强度、速率、持续时间有密切的关系。左氧氟沙星是浓度依赖性抗菌药物,其作用与其所在组织中的浓度与持续时间有密切关系,换言之,其临床效果与组织浓度有关。临床文献表明,痰热清注射液与左氧氟沙星联合用于治疗上、下呼吸道感染、老年肺炎等均取得明显疗效[1-4],提示二者联合用药有协同作用。除文献报道抗菌作用有相加外,作者认为与痰热清注射液提高左氧氟沙星在肺组织中浓度有密切关系。本研究选用小鼠行痰热清注射液与左氧氟沙星联用,结果实验组小鼠肺组织中左氧氟沙星浓度远高于单用左氧氟沙星在对照组小鼠肺组织中的浓度,AUC 0→t分别为(117.69±22.89)μg·h-1·mL-1与(84.91±11.33)μg·h-1·mL-1,组间比较差异有统计学意义(P<0.01)。目前根据抗菌药物对细菌杀菌活性可分为时间依赖型,属于此类抗菌药物为β内酰胺类、大环内酯类;而浓度依赖型即药物的杀菌活力在很大范围内随药物浓度的增高增加,属于此类者有氨基糖甙类、氟喹诺酮类和甲硝唑等。本研究中,左氧氟沙星注射液与痰热清注射液联合使用致小鼠肺组织中左氧氟沙星无论AUC 0→t还是AUC 0→∞,均显着高于对照组,提示其抗菌作用增强是极为相关的。此外,实验组小鼠肺组织中左氧氟沙星消除速度t 1/2β和Cl/F(s)均显着低于对照组小鼠肺组织中左氧氟沙星的药动学参数,进一步表明,痰热清注射液除提高左氧氟沙星在小鼠肺组织中浓度外,还可致代谢和清除减慢,延缓左氧氟沙星的抗菌时间,为提高疗效提高一定的条件。
至于痰热清注射液为何可使左氧氟沙星在肺组织中浓度提高,可能与组方有关。其组方为黄芩、熊胆粉、上羊角、金银花和连翘五味中药组成[11],文献报道,黄芩可通过阻断平滑肌细胞膜上电压依赖型钙通道和受体操纵型钙通道而抑制钙离子内流,松弛血管平滑肌,有益于左氧氟沙星分别到血管密集、血流丰富的肺组织中[12]。此外,黄芩尚可减少左氧氟沙星的排泄[13]。
有文献报道,肺部常感染菌株为耐甲氧西林金葡菌、肺炎球菌、铜绿假单胞菌等,经临床分离对左氧氟沙星的敏感性MIC50分别为0.31、0.62、1.25 mg/L,而MIC90分别为0.62、1.25和2.50 mg/L[13],本研究实验组和对照组中左氧氟沙星浓度如图1所示,分别为15~10 mg/kg,持续5 h以上,完全符合浓度依赖型抗菌药物特点。高浓度且持续时间长,且实验组明显高于对照组,故二者联用疗效明显增强。
综上所述,本研究从药动学方面进一步阐明痰热清注射液对左氧氟沙星在小鼠组织中分布的影响,增强了临床疗效,为临床二者联用找到依据,有利于临床医生的推广使用。
[1]何力敏,陈于,李斌凯.痰热清联合左氧氟沙星注射液治疗下呼吸道感染67例疗效分析[J].现代医院,2012,12(5):72-73.
[2]路宏扬,占忠.痰热清联合左氧氟沙星注射液治疗重症肺炎的临床疗效观察[J].当代医学,2012,18(8):158-159.
[3]刘智艳.痰热清联合左氧氟沙星治疗老年肺炎80例临床疗效观察[J].中国医院指南,2012,18(28):249-250.
[4]雷鸣,覃华宏,黎兵,等.痰热清联合左氧氟沙星治疗社区获得性肺炎的疗效分析[J].临床合理用药,2012,5(14):1-2.
[5]熊旭东,周孝燕,雷康裕,等.痰热清联合左氧氟沙星治疗急性肺炎60例临床观察[J].中国中医急症,2003,12(2):17.
[6]王琴,潘静.痰热清注射液的药理作用和临床应用[J].华北国防医药,2010,22(1):41-43.
[7]李富善,黄晓玲.痰热清注射液的作用机理和临床应用[J].青海医药杂志,2011,41(5):78-79.
[8]刘芳群,鲁虹.高效液相色谱法测定人血浆中左氧氟沙星的浓度[J].中南药学,2012,10(10):734-736.
[9]高淑丽,刘丽华,王川平,等.2 种盐酸左氧氟沙星胶囊的人体生物等效性研究[J].中国药房,2007,18(26):2030-2032.
[10]施爱明,潘杰,华雯妍,等.LC-MS/MS法测定人血浆中左氧氟沙星浓度[J].药学进展,2008,32(5):228-231.
[11]高益民,王忠山.对痰热清注射液临床药学初步评价[J].首都医药,2004,11(12):44-46.
[12]黑爱莲,孙颂三.黄芩黄芩苷对大鼠主动脉条收缩的影响[J].首都医科大学学报,1997,18(2):114-117.
[13]徐庆,姚彤炜,梁天天.左氧氟沙星与黄芪和黄芩配伍的体内药物代谢动力学[J].浙江大学学报,2001,30(6):279-281.
[14]唐映红,伍参荣,魏云,等.盐酸左氧氟沙星体内外抗菌作用研究[J].医药导报,2007,26(9):983-986.
Effect of Tanreqing Injection on distribution of levofloxacin in lung of mice
ZhangMin1,LiuXiaojun2#,LuoCheng1,ChenKaijie3△,KongLingxi1,HeHaixia1,ZhouYuanda1
(1.DeparementofClinicalPharmacy,FirstAffiliatedHospital,ChongqingMedicalUniversity,Chongqing400016,China;2.DepartmentofPharmaceuticalPreparation,NinthPeople′sHospitalofChongqingCity,Chongqing400700,China;3.DepartmentofPharmacy,ChongqingMunicipalTumorHospital,Chongqing400030,China)
Objective To investigate the effects of Tanreging Injection on the distribution of levofloxacin in the lung tissue of mice.Methods 144 mice were randomily divided into the levofloxacin experimental group and the levofloxacin control group,72 cases in each group.The experimental group was injected by Tanreqing Injection 0.8 mg/kg and the control group was injected by the same volume of normal saline.The mice in the two groups were sacrificed for collecting the lung tissues at the time points of 0.05,0.08,0.17,0.5,1.0,2.0,4.0,8.0,12 h and preparing the homogenate.The levofloxacin concentration in the lung tissue was determined by HPLC and the pharmacokinetic parameters were calculated by the 3P97 program.Results The concentration curves based on drug-time in the experimental group and the control group both fitted the two-compartments model.The main pharmacokinetic parameters in the lung tissue V/Ft1/2β,CL,AUCo-t were (1.37±0.30vs.1.90±0.24)L,(5.21±1.96vs.4.82±1.55) h,(0.81±0.12vs.1.13±0.14)L/h and (117.69±22.89vs.84.91±11.33) mg·h-1·kg-1respectively,the differences between the two groups were statistically significant (P<0.05).The results indicated that Tanreqing Injection increased the distribution amount of levofloxaction and residence time in the lung tissue of mice.Conclusion The combained of Tanreqing Injection and levofloxacin can increase the g concentration and residence time of levofloxacin in the lung tissue of mice.
Tanreqing Injection;levofloxacin;HPLC;distribution
张敏(1981-),本科,药师,主要从事药学方面的研究。
:10.3969/j.issn.1671-8348.2015.15.004
R969.1
A
1671-8348(2015)15-2028-03
2014-11-26
2015-01-16)
#共同第一作者,刘晓君(1973-),本科,主管药师,主要从事临床药学方面的研究。
△通讯作者,E-mail:chenkaijie1010@126.com。



