王美方,王 忠,赵若飞,郑丽华,王 丽,陈少泽,段军仓
(1.石河子大学医学院,新疆石河子832002;2.石河子大学医学院第一附属医院心内二科,新疆石河子832002)
近年来,高血压的发病率逐年升高,其严重危害性在于并发症,如心、脑、肾等靶器官的病变,以其血栓性并发症尤重。目前多因素共同影响导致原发性高血压的发病机制已被普遍认知。Lip[1]研究表明高血压患者血液处于血栓前状态(PTS),PTS成为引发靶器官损伤的重要始动环节。最近研究发现,新型血小板相关血管内皮分泌蛋白——血浆内皮生长因子样单链蛋白1相关补体Clr/Cls单肽(SCUBE1)浓度同血小板的激活呈正相关,可能参与PTS,进而参与EH发生、发展。哈萨克族(以下简称哈族)是原发性高血压(EH)的高发民族,关于哈族EH与血浆SCUBS1的相关性研究,国内外尚未见报道。本项研究通过病例对照试验比较哈族EH患者与同族健康对照人群一般情况、生化指标及血浆中SCUBE1水平变化的表达差异,以探讨SCUBE1参与EH发生的机制。
1 资料与方法
1.1 一般资料 本研究选择2013年11月在新疆玛纳斯县旱卡子滩乡进行流行病学调查所获得的哈族EH患者73例为EH 组,男32例、女41例,平均年龄(57.29±11.89)岁;选择同期哈族血压正常者73例为对照组,男33例,女40例,平均年龄(55.44±11.83)岁。比较两组间的年龄、性别、体质量等一般资料,差异无统计学意义(P>0.05),具有可比性。高血压的诊断采用2010年中国高血压防治指南标准[2]:均初诊为高血压,收缩压(SBP)大于140mm Hg和(或)舒张压(DBP)大于或等于90mm Hg。根据病史,符合条件的入选者实验前2周未服用任何降压药及抗血小板药物,并维持饮食和体质量的相对稳定。排除严重肝、肾功能不全、肿瘤、继发性高血压、糖尿病、出血性疾病、脑卒中、不稳定型心绞痛、心肌梗死、心功能2级或以上、妊娠、哺乳期或长期服用避孕药物者。根据知情同意原则,参与本研究的所有研究对象均签署知情同意书。
1.2 方法 所有受检者血压测量使用汞柱式血压计,测量坐位右上臂血压,取Korikoff第1和第5音的SBP和DBP,连续测量3次,每次间隔不少于2min,取3次读数的平均值作为受试者血压。均脱鞋、免冠、着单衣裤准确收集参与者身高、体质量等基础资料。所有受检者均于隔夜禁食12h后晨起空腹时采取肘静脉血10mL,置于乙二胺四乙酸(EDTA)抗凝离心管,现场离心(4 000r/min,离心5min),吸管吸取上层血浆分装到EP管中,所有标本统一进行编号,置于-80℃冰箱保存备用,用于检测血浆SCUBE1活性及糖脂代谢等生化指标。采用石河子大学医学院第一附属医院检验科的日立7100全自动生化分析仪分别检测标本的空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿酸、肌酐等。血浆SCUBE1浓度的测定采用酶联免疫吸附法(ELISA),试剂盒(购自上海西塘有限责任公司)的板内、板间变异系数均小于10%,操作经过多次练习,严格按照试剂盒说明书进行。
1.3 统计学处理 采用SPSS17.0软件进行统计分析,所收集的计量资料符合正态分布,计量资料用±s表示,组间比较采用t检验,相关分析采用Pearson直线相关及多元线形回归分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 生化指标检测 经过对所收集数据进行分析,EH组和对照组之间FBG差异有统计学意义(P<0.05),其他生化指标无差异。对EH组和对照组间血压及血浆SCUBE1水平比较,显示出EH组SBP、DBP及血浆SCUBE1等水平均高于对照组,比较差异具有统计学意义(P<0.01),见表1、2。
2.2 相关性分析 在EH组中将SCUBE1同参与者血压、基础资料及生化指标进行相关性分析,SCUBE1在EH组中表达明显较高,浓度同SBP(r=0.552)、DBP(r=0.305)均呈正相关(P<0.05);SCUBE1与年龄、BMI、腰围、腰臀比、FBG、TG等生化指标均无相关性(P>0.05)。在对照组中,SCUBE1与SBP、DBP有相关性(SBP:r=0.425、DBP:r=0.265,P<0.05),其他各指标与SCUBE1无相关性(P>0.05)。该研究结果反映出EH患者血浆中新型血小板活化因子SCUBE1是升高的。所有参与者SBP、DBP与SCUBE1均存在相关性,而在EH组SCUBE1和SBP、DBP同对照组相比含量明显升高,其相关性更加显着。SBP、DBP和SCUBE1线性回归分析有相关性(r2=0.701、0.504,P<0.05),见图1。
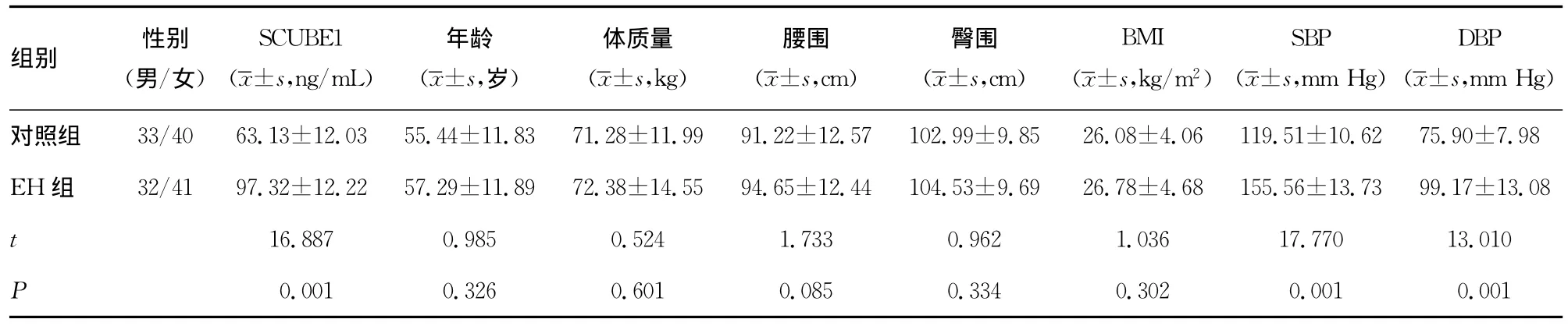
表1 EH组和健康对照组一般资料及SCUBE1的比较
表2 EH组和健康对照组生化资料及SCUBE1的比较(±s)
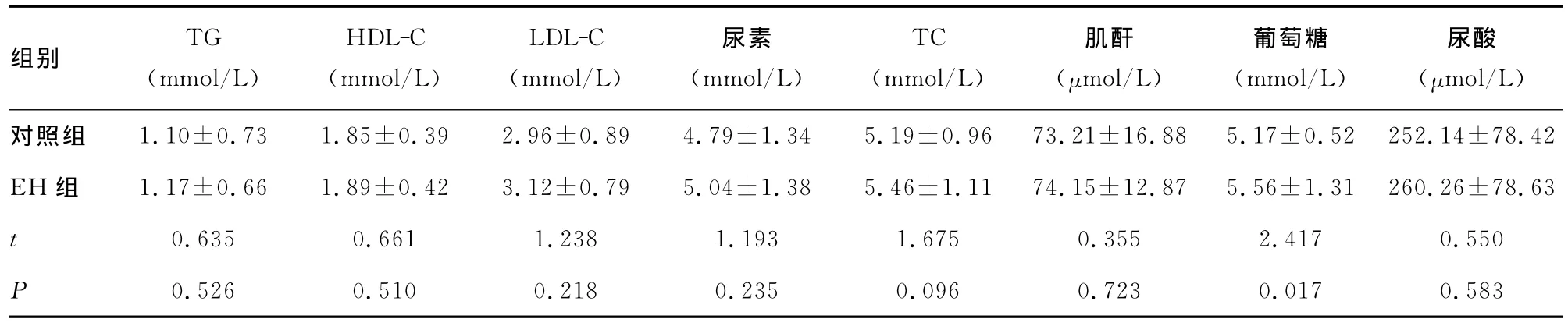
表2 EH组和健康对照组生化资料及SCUBE1的比较(±s)
组别 TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)尿素(mmol/L)TC(mmol/L)肌酐(μmol/L)葡萄糖(mmol/L)尿酸(μmol/L)9±0.96 73.21±16.88 5.17±0.52 252.14±78.42 EH组 1.17±0.66 1.89±0.42 3.12±0.79 5.04±1.38 5.46±1.11 74.15±12.87 5.56±1.31 260.26±78.63 t 0.635 0.661 1.238 1.193 1.675 0.355 2.417 0.550 P 0.526 0.510 0.218 0.235 0.096 0.723 0.017 0.583对照组 1.10±0.73 1.85±0.39 2.96±0.89 4.79±1.34 5.1
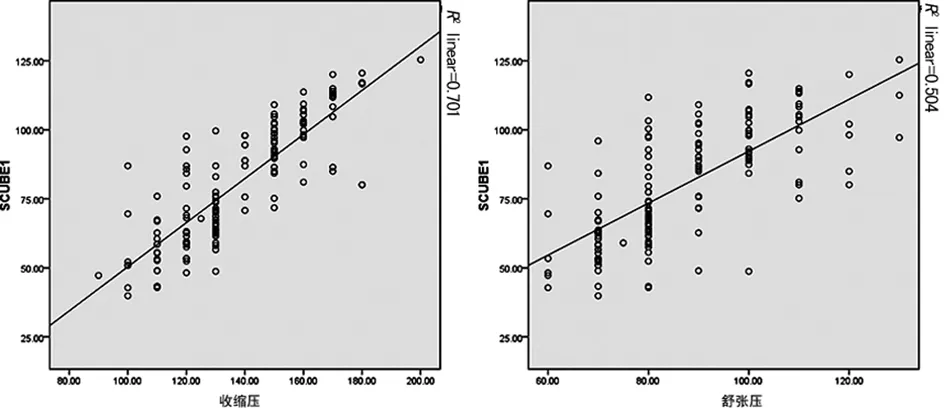
图1 SCUBE1与SBP、DBP线性回归分析
3 讨 论
高血压是一种以血流动力学改变为主要特征的全身血管性疾病,发病率日益增高,其导致的心脑血管疾病患病率逐渐增高[3],尽管强调控制高血压,但高血压所致的靶器官损害和心脑血管事件发生率不断攀升,这提示除了对血压的控制力度及对其危险因素的重视力度不够外,可能还与忽视高血压的PTS密切相关。在促进血栓形成过程中,较高的血流侧压力下使血管内皮发生损伤、内皮功能发生紊乱,使抗原暴露激发血小板活化并促使聚集及黏附[4],SCUBE1被认为是新型血小板活化标志物之一。
SCUBE[signalpeptide-CUB(complement Clr/Cls,Uegf,and Bmpl)内皮生长因子样单链蛋白相关补体Clr/Cls单肽]因子家 族 包 含 3 个 亚 型(SCUBE1-3)[5]。Tu 等[6]研究发现,SCUBE1在血小板内高表达,以α-颗粒形式储存在未活化的血小板,当血小板被激活时则转移到血小板表面,水解成小分子可溶性片段,参与血栓形成。进一步研究证实,SCUBE1沉积在人内皮下基质,促使动脉硬化发生。Tu等[7]经大量细胞实验研究发现SCUBE1分子中EGF样重复序列可介导多个SCUBE1之间的相互作用而实现细胞之间的同嗜性黏附效应。由此看来,SCUBE1可能作为一新的血小板内皮细胞黏附分子而在心血管疾病中起着重要的作用。
本研究亦证实,SCUBE1在健康人血浆也有一定表达,在初诊EH患者血浆水平是显着升高的,这与Ozkan等[8]研究报道相符,但其在血浆中含量存有差异,可能由于该因子的表达受高血压病程的影响及在不同种族人群的表达存在差异。本研究入选的研究对象不存在血糖、血脂等代谢紊乱,SCUBE1与生化指标不存在相关性,同血压水平呈正相关,提示SCUBE1可能参与高血压的发病机制,且可能具有相对独立相关性。本研究不足之处在于受检人数相对比较少,且未能进行长期的追踪调查高血压患者的心脑血管事件的发生率。
SCUBE1与高血压的发病机制尚不明确,可能机制为:(1)血管在较高的血流侧压力下,内皮发生损伤、内皮功能发生紊乱,激发血小板活化、黏附及聚集[9]。SCUBE1分子N-端EGF样重复序列介导多个SCUBE1之间的相互作用,在外界钙离子参与下使细胞间同嗜性黏附,导致血管内皮增生、血管狭窄,外周循环阻力增加,促使血压升高。(2)随着血小板活化,内皮细胞、血小板α-颗粒持续释放SCUBE1,活化的血小板因子可能引起血管内皮细胞对NO的舒张功能减弱,两者相互促进、相互影响,致使血管壁处于持续收缩状态。(3)炎症状态下,血管内皮在促炎因子作用下SCUBE1表达增加[9],可能激活炎症BMP2/TGF-β/Hh信号通路[10-12],进一步促进第二信使的级联放大作用,血管长期的慢性炎性病变促进血管增生、血管纤维化,促使粥样斑块形成、血管硬化,外周阻力增加。其机制有待进一步深入探讨。
综上所述,鉴于活化血小板在高血压病程中的独特作用,实时监测EH患者血小板活化情况对鉴别血栓卒中高风险人群及对抗血小板药物治疗效果的判定显得尤为重要[13]。高血压是由环境因素与遗传因素共同影响而导致的一种多因素疾病,SCUBE1是否由于高血压而促进动脉硬化及血栓性疾病的发生将有待今后大样本量、多中心、多人群做进一步研究证实,以取得更广泛证据指导,为临床合理应用具有抗血小板活性及改善血管内皮功能的降压药物提供一定的参考依据。然而在极其复杂的高血压发病机制中,SCUBE1仅是冰山一角,针对原发性高血压病的一级预防仍任重而道远。
[1]Lip GY.Target organ damage and the prothombotic state in hypertension[J].Hypertension,2000,36(6):975-977.
[2]中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心血管病杂志,2011,39(7):579-615.
[3]冀元元,张晓刚.血清脂联素与不同程度原发性高血压患者的相关性分析[J].重庆医学,2013,42(15):1765-1766.
[4]El HM,Rosado JA.Platelet activation in hypertension[J].Blood Cells Mol Dis,2009,42(1):38-43.
[5]Yang RB,Ng CK,Wasserman SM,et al.Identification of a novel family of cell-surface proteins expressed in human vascular endothelium[J].J Biol Chem,2002,277(48):46364-46373.
[6]Tu CF,Su YH,Huang YN,et al.Localization and characterization of a novel secreted protein SCUBE1in human platelets[J].Cardiovasc Res,2006,71(3):486-495.
[7]Tu CF,Yan YT,Wu SY,et al.Domain and functional analysis of a novel platelet-endothelial cell surface protein,SCUBE1[J].J Biol Chem,2008,283(18):12478-12488.
[8]Ozkan G,Ulusoy S,Mentese A,et al.New marker of platelet activation,SCUBE1,is elevated in hypertensive patients[J].Am J Hypertens,2013,26(6):748-753.
[9]Dai DF,Thjeb P,Tu CF,et al.Plasma concentration of SCUBE1,a novel platelet protein,is elevated in patients with acute coronary syndrome and ischemic stroke[J].J Am Coll Cardiol,2008(51):2173-2180.
[10]Bijlsma MF,Groot AP,Oduro JP,et al.Hypoxia induces a hedgehog response mediated by HIF-1alpha[J].J Cell Mol Med,2009,13(8B):2053-2060.
[11]Tseng WP,Yang SN,Lai CH,et al.Hypoxia induces BMP-2 expression via ILK,Akt,mTOR,and HIF-1pathways in osteoblasts[J].J Cell Physiol,2010,223(3):810-818.
[12]Konisti S,Kiriakidis S,Paleolog EM.Hypoxia-a key regulator of angiogenesis and inflammation in rheumatoid arthritis[J].Nat Rev Rheumatol,2012,8(3):153-162.
[13]徐士欣,肖振霞,焦连亭.血小板活化标志物检测临床应用的评价[J].国际检验医学杂志,2009,30(2):137-138,140.



