杨 霞,黄吉燕,王 明,向学熔,李洁仪,曾兴琪,李丛华△
(1.重庆医科大学附属口腔医院/口腔疾病与生物医学重庆市重点实验室 400015;2.上海中医药大学附属曙光医院口腔科 200021)
论着·临床研究
赤芍总苷诱导扁平苔藓中T细胞免疫和凋亡机制的研究*
杨 霞1,黄吉燕2,王 明1,向学熔1,李洁仪1,曾兴琪1,李丛华1△
(1.重庆医科大学附属口腔医院/口腔疾病与生物医学重庆市重点实验室 400015;2.上海中医药大学附属曙光医院口腔科 200021)
目的观察扁平苔藓(OLP)患者赤芍总苷(TPG)治疗前后T细胞免疫表达水平的变化,探讨影响细胞凋亡的机制。方法应用TPG局部治疗20例OLP患者,观察其治疗后的临床效果;且在治疗前后,较系统地对TPG诱导细胞凋亡情况进行比较;探讨OLP中的细胞凋亡情况及CD4+、CD8+T细胞和CD4+/CD8+比例的变化,分析TPG诱导OLP患者中的T细胞免疫与细胞凋亡的关系。结果TPG治疗扁平苔藓临床疗效明显,治疗后患者OLP病变组织处网纹面积减小,糜烂面大小减少,患者疼痛指数明显降低。治疗后CD4+和CD8+表达较治疗前显着下降。结论TPG的治疗可能是通过固有层中诱导炎性T细胞的凋亡,T细胞免疫受到调节,从而减轻OLP炎症的发生和发展,起到治疗OLP的作用。
赤芍总苷;扁平苔藓;细胞免疫;细胞凋亡
口腔扁平苔藓(oral lichen planus,OLP)是一种病因不明确的炎症性口腔黏膜常见疾病,不具有传染性。主要病理特征是上皮角化过度、基底层细胞液化变性与上皮下淋巴细胞浸润、固有层炎性细胞浸润,同时兼具有上皮细胞凋亡的增加和固有层炎性细胞凋亡的减少[1-2]。赤芍总苷(total paeony glycoside,TPG)是提取于川芍药或毛茛科植物芍药的干燥根的一种糖苷类物质,具有抗凝、抗血栓、抗动脉粥样硬化、抗心肌或脑组织损伤等药理作用[3]。本研究拟采用TPG溶液局部治疗OLP,观察临床疗效,并对OLP患者治疗前后的黏膜中CD4+、CD8+T细胞的表达进行检测,用原位末端转移酶标记法(TUNEL法)标记凋亡细胞,以进一步了解OLP的发病机制与细胞凋亡的机制,探讨TPG治疗OLP的作用机制。
1 资料与方法
1.1 一般资料 本实验标本来源于重庆医科大学附属口腔医院大学城门诊和牙周黏膜科门诊就诊的患者中,确诊为OLP(诊断标准参考文献[1]),随机抽取男女患者各10例,年龄34~76岁。其中非糜烂型10例,糜烂型10例。苔藓范围:颊侧黏膜的病损,其中伴唇黏膜损伤5例,伴舌部黏膜损伤7例,伴牙龈黏膜损伤6例。另取10例健康成人的口腔黏膜作为对照组;在性别和年龄构成上进行的统计分析表明:健康对照组与患者组差异无统计学意义(P>0.05),具有可比性;研究对象均预先经过医患沟通,患者本人或委托家属签署知情同意书。OLP患者组采用TPG溶液局部涂擦,每日饭后,张口3 min以减少唾液冲洗,增加局部作用,观察随访3个月,期间拒绝服用其他药物。排除标准:排除不能遵从医嘱用药、影响疗效判断者;排除实验室检查肝、肾功能异常者;排除免疫功能低下者;排除妊娠、哺乳期妇女;排除兼患有盘状红斑狼疮或白斑者,或有严重系统性疾病无法耐受长期全身用药者;排除近1个月内服用糖皮质激素、免疫抑制剂者。
1.2 仪器与试剂 赤芍片(生产批号:140201),芍药苷中药化学对照品(纯度:HPLC≥98%,20 mg,CAS号:23180-57-6),D101-大孔吸附树脂(批号:2013103101),半自动免疫组化染色仪(BP33090210),计算机病理图像分析系统,免疫组化软件(Cell2000版),HE染色试剂,CD4+,CD8+鼠抗人单克隆抗体,TUNEL法原位凋亡检测试剂盒,旋转蒸发仪(RE-5210)。
1.3 药物的提取
1.3.1 TPG的提纯制备 600 g赤芍片打成粉末,加60%乙醇6 000 mL,混合装入烧瓶,置于电炉上提取2 h后取出醇提物;然后按上述步骤再提取1.5、1 h;所得醇提物,每次取6 000 mL,置于旋转蒸发仪,回收乙醇,回收体积3 600 mL;取出浓缩液,使用稀NaOH溶液调节pH至8。将D101-大孔吸附树脂用100%乙醇浸泡24 h,取出浸泡出来的油脂,装柱,超纯水清洗至无醇味;将浓缩液上样,1 kg药材对应3 L树脂。洗脱,水洗2~3倍柱树脂体积,70%乙醇洗,3~4倍柱体积收集,洗脱速度为每小时2倍柱体积;收集乙醇洗脱液,旋转蒸发仪回收乙醇;所得赤芍苷药溶液浓缩干燥,加入双蒸水500 mL,过滤除菌,得到无菌赤芍药液,置无菌试管中,冰箱保存。
1.3.2 TPG的含量测定 取0.001 5 g芍药苷用甲醇定容至10 mL的容量瓶,得0.15 mg/mL的标准品液;分别精密吸取芍药苷对照品溶液0、0.1、0.2、0.4、0.6、0.8 mL至巨塞试管中,水浴挥干溶剂,以空白试剂为对照,加入新配制的5%香草醛-冰醋酸0.2 mL,高氯酸0.8 mL,密塞摇匀,60 ℃水浴加热20 min取出,冰水浴冷却,加冰醋酸5 mL摇匀,560 nm处测定吸光度值。取供试品0.15 mL按上述方法测定吸光度值。
1.3.3 药物疗效的判定标准[2]痊愈即患者疼痛症状消失,黏膜色泽正常,皮损完全消退;显效即无明显自觉症状,糜烂的黏膜愈合,充血范围或Wickham纹缩小2/3以上,或皮损消退70%以上;有效即自觉症状减轻,黏膜局部有充血,Wickham纹减少,糜烂面积减少小于2/3,或皮损消退30%~70%;无效即病情变化不明显或皮损消退不足30%。以痊愈和显效者相加来计算有效率。
1.4 检测方法 对未接受过治疗的健康对照组、OLP患者治疗前后取标本检测,观察染色结果。(1)石蜡切片 HE 染色。(2)应用免疫组化SP法检测20例OLP组织中赤芍总苷治疗前后的CD4+、CD8+T细胞的表达水平。淋巴细胞计数即对固有层CD4+、CD8+T免疫组化染色后细胞胞质呈黄褐色的细胞进行计数。病变典型区的固有层各随意计数6个(40×10)的高倍视野,取平均值。(3)TUNEL法定位检查:上皮细胞层是计算单位上皮细胞层长度里查见的凋亡细胞数目,而固有层是计算凋亡细胞的百分比。本研究检测20例OLP患者TPG治疗前后的细胞凋亡情况,并检查上皮细胞和固有层炎性细胞的凋亡变化情况。
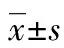
2 结 果
2.1 TPG的含量测定 以TPG吸光度值为横坐标,TPG含量为纵坐标,绘制TPG含量线性图鉴定得出芍药苷含量为5.51%,TPG纯度大于90%,符合实验要求;在临床使用前,总提取物采用适量生理盐水(NS)稀释成各所需浓度。
2.2 疗效判断结果 患者局部治疗期间未出现不适或药物不良反应,血常规、尿常规、肝、肾功能等各项指标未见异常。临床疗效表明,经局部治疗后,痊愈9例(45%),显效4例(20%),有效3例(15%),无效4例(20%,其中2例因疗效不明显,拒绝活检),有效率达65%。治疗组疗效明显优于对照组(P<0.05)。治疗后检查可见扁平苔藓病变组织处网纹面积减小,红肿糜烂面范围变小,患者疼痛指数降低。OLP患者应用TPG溶液局部治疗后与治疗前比较差异有统计学意义(P<0.05),与健康对照组比较差异无统计学意义(P>0.05)。治疗后治疗组各指标改善程度明显优于对照组(P<0.05)。
2.3 CD4+、CD8+细胞染色结果及 CD4/CD8+比例变化 免疫组化分析比较正常组织及OLP组织中CD4+,CD8+T细胞表达情况:结果表明 CD4+和CD8+表达在OLP固有层组织中明显升高,T 细胞数与正常对照组织相比显着增加(P<0.05),验证了T淋巴细胞介导的免疫反应在OLP的发生、发展中起着重要作用(表1)。而OLP患者使用TPG后,固有层 CD4+、CD8+T细胞数明显减少,其中 CD8+T细胞主要表达于接近基底膜破坏处的固有层浅层,CD4+T细胞主要表达于固有层深层。通过免疫组化分析发现:治疗后CD4+、CD8+均有表达降低,向正常值靠近趋势,TPG的治疗调节了T细胞的相关免疫(图1)。
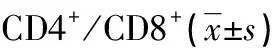
表1 对照组、OLP 患者治疗前后 CD4+、CD8+T细胞数及
2.4 TUNEL 法检测细胞凋亡结果 TUNNEL法定位检测治疗前后OLP组织上皮细胞层及固有层细胞凋亡变化情况:在口腔扁平苔藓上皮及固有层均可见凋亡细胞。正常组织的上皮细胞层凋亡细胞数为0.1~0.4/0.25 mm,平均为0.2;固有层细胞凋亡细胞比例为0.21%~1.4%,平均0.93%。而治疗后OLP患者的上皮细胞层凋亡细胞数为0.0~8.3/0.25 mm,平均为1.4;固有层细胞凋亡细胞比例为0.03%~10.51%,平均1.11%。OLP的上皮细胞的凋亡指数明显高于对照组(P<0.05),凋亡细胞多位于基底层或基底上层,且多发生于基底细胞液化变性处上皮;OLP固有层的细胞凋亡指数明显高于对照组(P<0.05)。随着上皮细胞凋亡数目增加,在固有层细胞的凋亡比例也显着升高(表2,图2)。
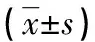
表2 OLP 患者使用药物前后与对照组细胞凋亡情况
综合以上结果,得出结论:TPG的治疗可能是通过固有层中诱导炎性T细胞的凋亡,T细胞免疫受到调节,减轻了OLP炎症的发生和发展,最终起到治疗OLP的作用。
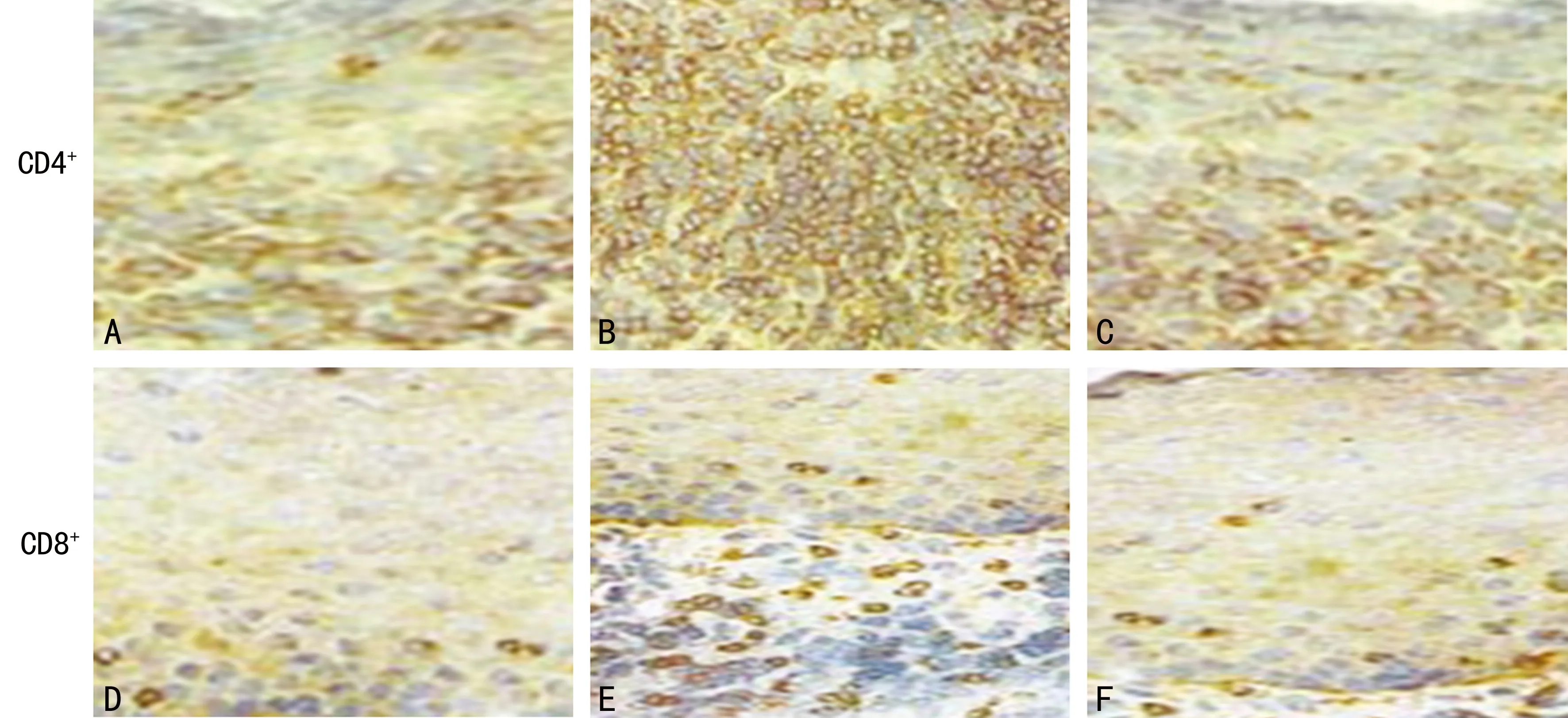
A、D:正常黏膜;B、E:OLP患者黏膜;C、F:TPG治疗后黏膜。
图1 免疫组化染色
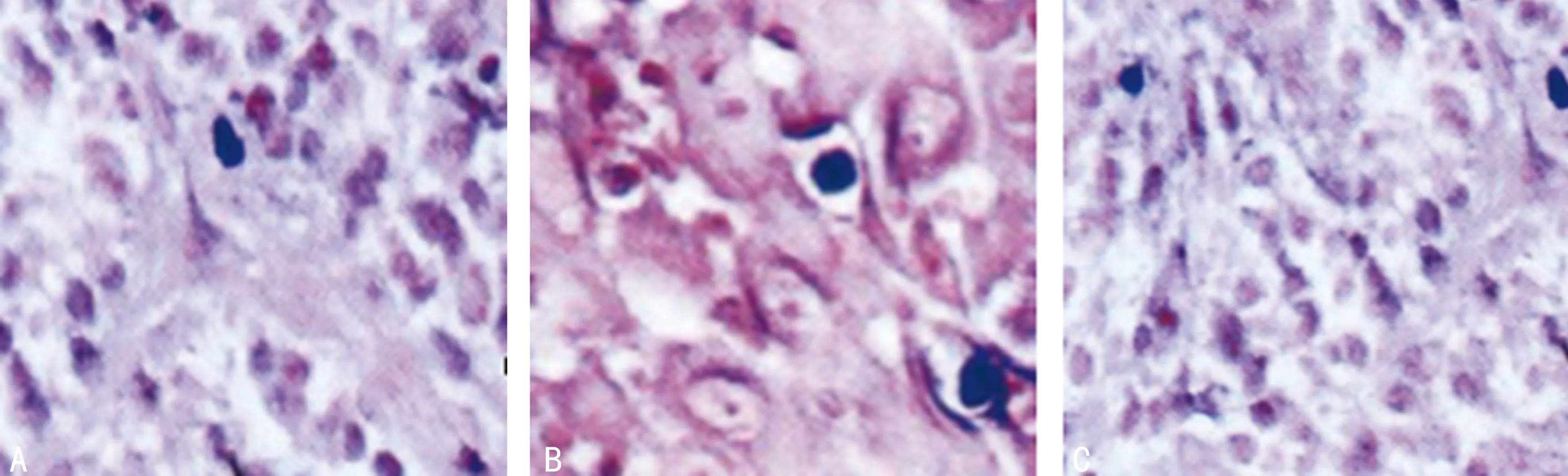
A:正常上皮细胞;B:OLP患者上皮细胞;C:OLP患者TPG治疗后的上皮细胞。
图2 细胞凋亡结果
3 讨 论
OLP是比较顽固的口腔黏膜疾病,病程长,病因和确切的发病机制仍然不明确[1-2]。OLP 的发病可能以细胞介导的免疫反应为主,皮损内主要是亲表皮性的T细胞浸润。发病过程中,先激活CD4+T细胞,分泌干扰素-γ(IFN-γ)、白细胞介素(IL-2)、粒细胞巨噬细胞刺激因子(GM-CSF)、肿瘤坏死因子-β(TNF-β)等多种细胞因子,启动局部细胞的免疫反应体系。后期占主导的CD8+T细胞与基底层角质形成细胞损伤有关,进一步发展成OLP皮损。所以学者们倾向认为OLP是一种CD4+T淋巴细胞与其分泌的细胞因子起关键作用的自身免疫性疾病,也是和细胞凋亡有关的细胞免疫功能紊乱的自身免疫性疾病,以皮下结缔组织内淋巴细胞浸润为特征的慢性非感染性炎症[4-5]。
Khan等[6]发现上皮内、上皮下浅表固有层大多数淋巴细胞为CD8+细胞,且CD8+细胞与凋亡的角质细胞相邻。本实验结果也发现OLP上皮内凋亡的细胞相邻有浸润的T细胞,对固有层内浸润的CD8+T细胞的表达与淋巴细胞凋亡的相关性进行分析,发现CD8+T细胞的表达与OLP中固有层中淋巴细胞的凋亡指数之间呈现出相应的负性关系,对照组CD4/CD8比值比明显降低(P<0.05),提示OLP中存在T细胞亚群平衡失调和T淋巴细胞功能紊乱。实验结果与国内研究结果一致[6-8],所以作者认为:(1) 在TPG药物诱导下,OLP中上皮细胞的抗原性可能发生部分改变,聚集了趋化的T淋巴细胞;(2) 增加的CD8+T细胞可能引起上皮基底细胞发生凋亡;(3) T淋巴细胞凋亡数目的减少与OLP的发生、发展、预后、慢性迁延可能有一定的内在联系;(4)在CD8+T细胞的攻击和诱导作用下,OLP的基底细胞产生液化变性和上皮细胞凋亡的增加。因此T细胞的浸润和细胞凋亡异常可能与基底细胞液化变性有关系,但是在细胞凋亡和液化变性之间,哪个是初发损害和继发损害还有待进一步研究。
目前在OLP的治疗中,西医局部用药多采用药膜敷用、糊剂涂用等,全身用药多采用免疫调节剂,甚至采取口服泼尼松激素治疗或氯喹治疗,不仅药物的不良反应较大,毒副作用明显,且疗效不确定,有较高的复发率。由于治疗方法的局限性,寻求一种安全有效、能控制扁平苔藓的治疗方法和治疗药物是国内学者们一致在追求和探索的课题[9-10]。TPG具有调节免疫和调控基因等作用,从而影响细胞的凋亡、促进细胞分化等。
本实验对TPG治疗前后OLP组织,应用免疫组化法分析CD4+,CD8+的表达情况,表明治疗后CD4+、CD8+均有表达降低,且趋向正常值;TPG的治疗诱导调节了T细胞的相关免疫功能。TUNNEL法对凋亡细胞定位检测标记结果,也说明了TPG能调节OLP发病中的细胞免疫功能和细胞凋亡,对OLP炎症发生、发展起到减轻作用,从而达到OLP的治疗目的;也进一步为TPG的临床应用提供了科学的实验数据和合理的理论依据。
[1]李秉琦.口腔黏膜病学[M].2版.北京:人民卫生出版社,2003:83-87.
[2]唐国瑶,周曾同.口腔扁平苔藓的诊断及治疗进展[J].中华口腔医学杂志,2006,41(11):697-699.
[3]雷玲,胡竟一,余悦,等.赤芍的抗内毒素作用研究[J].中药药理与临床,2006,22(6):32-34.
[4]Sugerman PB,Savage NW,Walsh IA,et al.The pathogenesis of oral lichen planus[J].Crit Rev Oral Biol Med,2002,13(4):350-365.
[5]Dissemond J.Oral lichen plamLs:all overview [J].J Dermatol Treat,2004,15(3):136-140.
[6] Khan A,Farah CS,Savage NW,et al.Th leytokines in oral lichen planus[J].J Oral Pathol Med,2003,32(2):77-83.
[7]沈丽佳,阮萍,殷操,等.口腔扁平苔藓中TNF-α和TNF受体Ⅰ表达及与细胞凋亡的关系[J].中国病理生理杂志,2004,20(9):1664-1667.
[8]Villarroel Dorrego M,Correnti M,Delgado R,et al.Oral lichen planus:Immtmohistology of mucosal lesions[J].J Oral Pathol Med,2002,31(7):410-414.
[9].Hirota M,Ito T,Okudela K,et al.Cell proliferation activity and the expression of cel cycle regulatory proteins in oral lichen planus[J].J Oral Pathol Med,2002,31(4):204-212.
[10]Neppelberg E,Johannessen AC,Jonsson R.Apoptosis in oral lichen planus[J].Eur J Oral Sci,2001,109(5):361-364.
Effect on the level of T cells immunity and mechanism of apoptosis in the Oral lichen planus patients induced by the total paeony glycoside*
YangXia1,HuangJiyan2,WangMing1,XiangXuerong1,LiJieyi1,ZengXingqi1,LiConghua1△
(1.Stomatologyhospital,ChongqingMedicalUniversity,ChongqingkeyLaboratoryforOralDiseasesandBiomedicalSciences;2.Stomatologydepartment,Shuguanghospital,ShanghaiUniversityofTraditionalChineseMedicine)
ObjectiveObserve the effect of Total paeony glycoside(TPG)has on the T-cell immune action and apoptosis process of Oral lichen planus patients and analyze the mechanism.Methods20 OLP patients are recruited into this experiment,each is treated with TPG,and their clinical effect is taken notes of.Observe the apoptosis of OLP lesions from each of the patients before and after the treatment,compare the apoptosis condition and the expression of CD4+,CD8+,and the CD4+/CD8+ratio,to analyze the role TPG plays on the immune expression of T-cell and the effect on apoptosis process.ResultsTPG improve the clinical manifestation of OLP patients significantly,resulting in the decrease of reticulum and erosive areas,and the pain index is decreased obviously.The expression of CD4+and CD8+are decreased in OLP lesions after the treatment of TPG.ConclusionTPG may induce the apoptosis of the T-cell in lamina propria of the OLP lesions to regulate the T-cell immune action of OLP patients,and slow the development of inflammatory process of OLP,and in that way,TPG shows its potential in treating OLP,and this experiment can provide the primary evidence.
total paeony glycoside;oral lichen planus;cells immunity;cells apoptosis
10.3969/j.issn.1671-8348.2015.26.007
重庆市卫生局中医药科研计划项目(2010-2-67);重庆市卫生局医学科研项目(2012-1-056)。
:杨霞(1976-),博士,副主任医师,主要从事口腔疾病的防治工作。△
,E-mail:liconghua1@163.com。
R780.2
A
1671-8348(2015)26-3622-03
2015-04-08
2015-06-28)



