马卫列,龚晓华,李观强,丁 航,兰柳波,陈小谊,张志珍△
(1.广东医学院生物化学与分子生物学教研室,广东东莞 523808;>2.深圳市龙岗区人民医院检验科,广东深圳 518172)
·技术与方法·
HPLC法测定apoA-1介导的泡沫细胞胆固醇流出的实验研究*
马卫列1,龚晓华1,李观强2,丁 航1,兰柳波1,陈小谊1,张志珍1△
(1.广东医学院生物化学与分子生物学教研室,广东东莞 523808;>2.深圳市龙岗区人民医院检验科,广东深圳 518172)
目的建立用高效液相色谱(HPLC)法测定载脂蛋白A-1(apoA-1)介导的泡沫细胞内胆固醇流出率的实验方法。方法人单核细胞THP-1用160 nmol/L佛波酯(PMA)诱导24 h分化为贴壁巨噬细胞(PMA组),再用50 μg/mL乙酰化低密度脂蛋白(ac-LDL)处理48 h,诱导巨噬细胞变成泡沫细胞(ac-LDL组);加入含apoA-1的1640培养基培养24 h(apoA-1组)。油红O染色和HPLC法测定细胞内胆固醇水平,鉴定巨噬细胞源性泡沫细胞模型。采用HPLC分析和液体闪烁计数法测定apoA-1介导的泡沫细胞内胆固醇流出率。结果THP-1巨噬细胞源性泡沫细胞经油红O染色后,细胞内可明显观察到大量红色脂滴存在。胆固醇水平测定显示,ac-LDL组内游离胆固醇、总胆固醇和胆固醇酯的水平明显高于PMA组(P<0.01)。ac-LDL处理细胞48 h后,ac-LDL组内总胆固醇水平为80.25 μg/mg细胞蛋白,胆固醇酯水平为47.65 μg/mg细胞蛋白,占总胆固醇的59.38%,与PMA组相比,差异有统计学意义(P<0.01)。HPLC分析和液体闪烁计数法结果表明,apoA-1介导泡沫细胞内apoA-1组胆固醇流出率分别为5.63%和7.08%(P<0.01)。结论本研究成功建立了酶促反应结合HPLC测定泡沫细胞内胆固醇流出的方法,为后续研究细胞脂质代谢提供了实验基础。
色谱法,高效液相;泡沫细胞;载脂蛋白A-1;胆甾烯酮;胆固醇流出
动脉粥样硬化(atherosclerosis,AS)是大多数心脑血管疾病发生的前期病理基础[1-2],在AS发生、发展过程中,巨噬细胞来源的泡沫细胞(foam cells)形成是动脉粥样损伤形成的特征性改变,促进细胞内胆固醇和胆固醇酯的流出是调节巨噬细胞胆固醇动态平衡的关键环节,对减少细胞内胆固醇蓄积和AS防治意义重大[3]。一般细胞在摄取胆固醇时会启动胞内胆固醇的正常流出,而泡沫细胞则表现为胆固醇代谢失调,主要是由于细胞内胆固醇酯过度堆积和胆固醇流出受阻,使细胞内胆固醇酯水平占总胆固醇的50%以上[4]。高密度脂蛋白介导胆固醇从巨噬泡沫细胞流出是清除细胞内过量胆固醇的最主要途径[5-6],胆固醇以囊泡分泌形式进行转运[7],在此过程中有高密度载脂蛋白A-1(apolipoprotein A-1,apoA-1)的介导[8]。研究apoA-1所介导的泡沫细胞胆固醇流出的重要环节之一就是要准确测定细胞内各种胆固醇的水平以及胆固醇的流出率,为此,本文的目的就是采用高效液相色谱(high performance liquid chromatography,HPLC)法测定apoA-1介导的泡沫细胞内和培养基中的胆固醇水平,计算胆固醇流出率,从而建立一种非同位素的较准确测定泡沫细胞胆固醇流出率的方法。
1 材料与方法
1.1 材料
1.1.1 实验材料 人单核细胞THP-1购自湘雅医学院细胞中心;RPMI 1640培养基和胎牛血清(FBS)购自Gibco公司。
1.1.2 试剂 佛波酯(phorbol-1-myristate-13-acetate,PMA)购自Promega公司;乙酰化低密度脂蛋白(acetylated low-density lipoprotein,ac-LDL)购自Biochemical Techologies公司;[3H]-胆固醇购自PerkinElmer公司;胆固醇酯酶、胆固醇氧化酶、胆甾烯酮标准品、apoA-1和油红O染料购自Sigma公司;TritonX-100购自上海生工公司;HPLC级甲醇购自天津大茂公司;BCA试剂盒购自碧云天生物科技公司;其他试剂均为国产或进口分析纯。
1.1.3 主要仪器 1200型高效液相色谱仪(Agilent公司);液体闪烁计数仪(PerkinElmer公司);CO2细胞培养箱和生物安全柜(NUAIRE公司);TS100倒置相差显微镜(Nikon公司);5417R型高速台式离心机(Eppendorf公司);多功能酶标仪(基因有限公司)。
1.2 方法
1.2.1 巨噬细胞源性泡沫细胞模型的建立 THP-1细胞悬浮培养于含10% FBS的RPMI 1640培养基中,2~3 d传代1次,3~5代后可用于建立巨噬细胞源性泡沫细胞。THP-1细胞传代至6孔板(1×106个/孔),加入PMA至终浓度160 nmol/L,37 ℃、5% CO2培养24 h,使悬浮细胞分化为贴壁巨噬细胞。更换培养基,加入ac-LDL至终浓度50 μg/mL,继续孵育48 h,诱导贴壁巨噬细胞分化为泡沫细胞。同时设PMA对照组,每组设3个重复孔。
1.2.2 油红O染色观察巨噬细胞源性泡沫细胞 吸去6孔板中培养基,PBS漂洗3次。泡沫细胞用预冷的4%多聚甲醛固定10 min;PBS洗1次,加入50%异丙醇作用5 min;吸去异丙醇,加入0.5%油红O室温染色15 min。60%异丙醇漂洗3~5次,苏木素染色4 min,自来水冲洗反蓝;PBS漂洗1次,置倒置相差显微镜下观察。
1.2.3 HPLC法测定泡沫细胞内胆固醇水平 参考文献[9]方法,PMA组和ac-LDL组THP-1细胞用PBS洗2次,加入1 mL 0.1% TritonX-100裂解,收集至1.5 mL离心管,BCA法测定蛋白水平。取100 μL细胞裂解液,加入10 μL酶促反应混合液[含500 mmol/L MgCl2、500 mmol/L Tris(pH 7.4)、10 mmol/L DTT、5%胆酸钠]混匀。实验分两管,一管加入胆固醇氧化酶(终浓度0.4 U/mL),37 ℃水浴作用1 h,用于测定细胞内游离胆固醇(FC);另一管加入胆固醇酯酶(终浓度0.4 U/mL),37 ℃作用1 h后,再加入胆固醇氧化酶于37 ℃作用1 h,用于测定细胞内总胆固醇(TC)。之后,两组分别加入100 μL甲醇∶乙醇(1∶1)终止反应,4 ℃静置30 min,4 ℃、10 000 r/min离心10 min,收集上清液,HPLC检测FC和TC水平。色谱条件:色谱柱(Agilent TC-C18柱,4.6 mm×250.0 mm,质点大小为5 μm,孔大小为100 Å);流动相,100%甲醇;流速,1 mL/min;检测波长,240 nm;柱温,25 ℃;进样量,标准品5 μL,细胞样品50 μL。以胆甾烯酮作为标准品,根据样品峰面积和所测蛋白浓度,计算出FC和TC水平,以单位质量蛋白质所含胆固醇表示(μg/mg)。胆固醇酯(CE)的水平为TC水平减去FC水平;CE百分水平(%)= CE水平/TC水平×100%。
1.2.4 HPLC法测定apoA-1介导的泡沫细胞胆固醇流出 THP-1细胞接种6孔板,在PMA和ac-LDL作用下诱导分化为泡沫细胞;每孔加入1 mL RPMI 1640培养基,5% CO2、37 ℃平衡培养24 h;用无血清培养基漂洗1次,加入1 mL含apoA-1的1640培养基(apoA-1终浓度为10 μg/mL),5% CO2、37 ℃继续培养24 h。同时设泡沫细胞对照组,每组设6个复孔。收集培养基,4 ℃、10 000 r/min离心10 min,取上清液加入3倍体积氯仿∶甲醇(2∶1),混匀,置4 ℃冰箱过夜后,5 000 r/min离心10 min,收集下层有机相;取上层再加入2倍体积氯仿,4 ℃冰箱4~5 h,5 000 r/min离心10 min,重复抽提,收集下层有机相;合并两次收集的下层有机相,氮气吹干。将氮气吹干的脂质加入10 μL甲醇溶解,再加入100 μL 0.1% Triton X-100混匀,HPLC测定培养基中的FC水平,色谱条件同上。细胞内总胆固醇测定方法同上述1.2.4。
apoA-1介导的泡沫细胞胆固醇流出率按下列公式计算:胆固醇流出率(%)= 培养基中FC水平/(细胞内TC水平 + 培养基中FC水平)×100。
1.2.5 液体闪烁计数法测定apoA-1介导的泡沫细胞胆固醇流出 THP-1细胞接种24孔板,PMA作用24 h(PMA组);用无血清培养基洗1次,加入[3H]-胆固醇(终浓度为0.5 μCi/mL)和ac-LDL(终浓度为50 μg/mL),5% CO2、37 ℃培养48 h(ac-LDL组);加入无血清培养基平衡24 h后,加入含apoA-1的1640培养基(apoA-1终浓度为10 μg/mL),继续培养24 h(apoA-1组)。同时设泡沫细胞对照组,每组设6个重复孔。收集细胞培养基,置-20 ℃保存。用无血清1640培养基漂洗1次,每孔加入0.1 mol/L NaOH溶液500 μL,反复吹打裂解细胞,室温静置5 min,收集细胞裂解液至1.5 mL离心管中,-20 ℃保存。液体闪烁计数法测定培养基和细胞裂解液中的放射强度,放射强度以cpm值计(cpm值为[3H]-胆固醇放射强度每分钟计数)。apoA-1介导的泡沫细胞胆固醇流出率按下列公式计算:胆固醇流出率(%) = 培养基内cpm/(细胞内cpm + 培养基中cpm)×100。
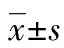
2 结 果
2.1 油红O染色鉴定巨噬细胞源性泡沫细胞模型 正常培养的THP-1细胞呈单个悬浮培养或簇状成团,经PMA作用24 h,细胞诱导为贴壁巨噬细胞,并分化出伪足(图1 A)。进一步用ac-LDL诱导48 h后,贴壁巨噬细胞转变为泡沫细胞。经油红O染色,细胞内可明显观察到大量红色脂滴存在,胞浆呈现泡沫样改变(图1 B),提示THP-1巨噬细胞源性泡沫细胞模型成功建立。
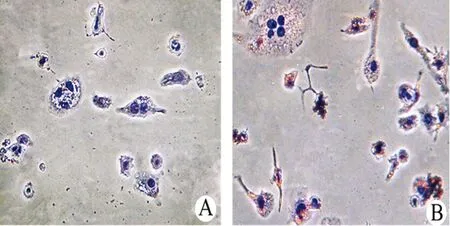
A:PMA组;B:ac-LDL组。
图1 THP-1巨噬细胞源性泡沫细胞油红O染色(×200)
2.2 测定胆固醇酯水平鉴定巨噬细胞源性泡沫细胞模型 PMA组和ac-LDL组细胞分别用0.1% TritonX-100裂解后,经胆固醇氧化酶和胆固醇酯酶的催化作用,细胞中的胆固醇全部转化为胆甾烯酮。以标准胆甾烯酮作为外标,HPLC法检测细胞裂解液内胆甾烯酮水平,标准品和细胞裂解液的色谱图见图2。根据标准品胆甾烯酮峰面积、浓度和所测样品峰面积、蛋白浓度,计算细胞内FC、TC和CE的水平,结果见表1。与PMA组相比,ac-LDL组细胞内FC、TC和CE水平明显高于PMA组(P<0.01)。PMA组CE水平为(8.95±0.67) μg/mg细胞蛋白,占TC的35.31%;ac-LDL组CE水平为(47.65±2.13) μg/mg细胞蛋白,占TC的59.38%。ac-LDL组CE的水平符合泡沫细胞CE应占细胞TC 50%以上的特征,提示泡沫细胞模型成功建立。
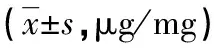
表1 THP-1巨噬细胞和泡沫细胞内胆固醇水平
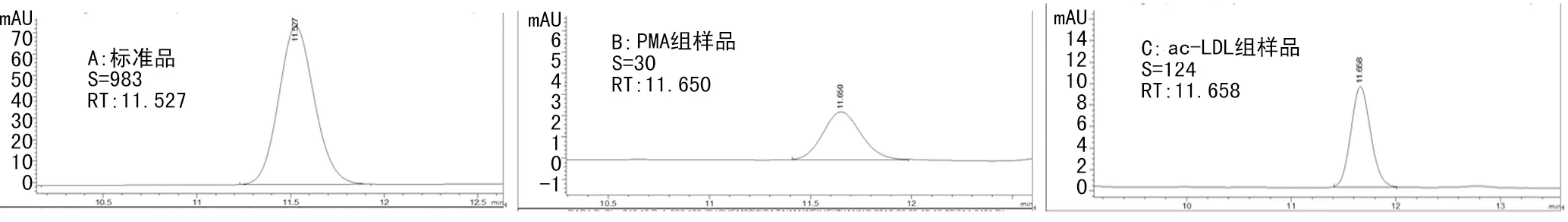
A:胆甾烯酮标准品;B:PMA组;C:ac-LDL组。
图2 标准品和不同处理组细胞内胆甾烯酮色谱图
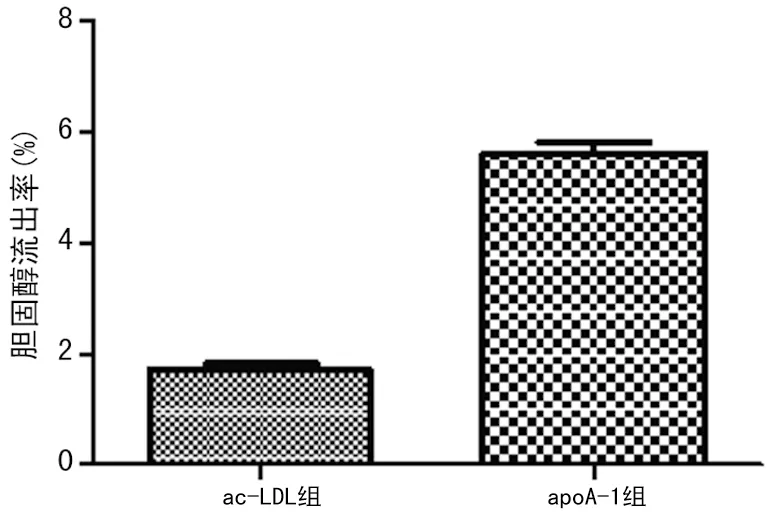
2.3 HPLC法测定apoA-1介导的泡沫细胞胆固醇流出 收集ac-LDL组和apoA-1组的培养基和细胞裂解上清液,酶促反应结合HPLC法测定培养基中的FC水平和细胞内的TC水平,见表2。根据培养基中FC和细胞内TC水平,计算apoA-1介导的泡沫细胞内胆固醇流出率。实验结果表明,泡沫细胞胆固醇流出率为(1.70±0.11)%,加入10 μg/mL apoA-1作用24 h后,泡沫细胞内胆固醇流出率为(5.63±0.34)%,与ac-LDL组相比,差异有统计学意义(P<0.01),见图3,提示apoA-1可明显介导泡沫细胞内胆固醇流出。
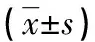
表2 细胞内和培养基中的胆固醇水平
*:P<0.01,与ac-LDL组比较。
图3 HPLC法测定泡沫细胞胆固醇流出率
2.4 液体闪烁计数法测定apoA-1介导的泡沫细胞胆固醇流出 为评价HPLC法测定泡沫细胞内胆固醇流出率的可行性,进一步采用液体闪烁计数法测定apoA-1介导的泡沫细胞内胆固醇流出率。收集apoA-1组和ac-LDL组的培养基和细胞裂解上清液,液体闪烁计数仪测定培养基和细胞的cpm值,见表3。根据培养基和细胞的cpm值,计算apoA-1介导的泡沫细胞内胆固醇流出率。实验结果表明,加入apoA-1后可明显介导泡沫细胞内胆固醇流出,流出率为(7.08±0.30)%,差异有统计学意义(P<0.01),见图4。该结果与上述HPLC法测定的结果接近,说明本实验所建立的酶促反应结合HPLC法测定泡沫细胞内胆固醇流出率的方法是可行的。
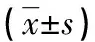
表3 细胞内和培养基中的cpm值
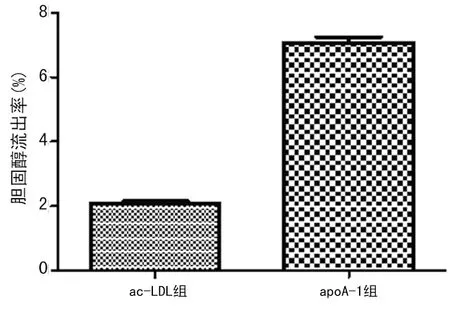
图4 液体闪烁计算法测定泡沫细胞胆固醇流出率
3 讨 论
泡沫细胞形成是AS的早期特征性病理性改变,贯穿于AS的整个过程,目前AS的机制尚未完全清楚,建立稳定可靠的泡沫细胞模型对研究AS意义重大。要研究AS的发生、发展机制,常借助于实验性动物模型或细胞模型,相比于兔、小鼠、大鼠等动物模型[10-12],细胞模型更为常用,如人单核THP-1细胞、U937细胞、RAW264.7细胞以及人HepG2细胞和J744巨噬细胞等[13-15]。本实验中,选用人单核细胞THP-1建立泡沫细胞模型,首先使用PMA诱导悬浮生长的THP-1细胞分化为贴壁生长的巨噬细胞,之后再加入ac-LDL共同孵育使贴壁巨噬细胞进一步分化为泡沫细胞。实验发现建立该模型时PMA诱导分化较为关键,使用160 nmol/L PMA作用24~48 h可使巨噬细胞吞噬脂质的能力增强,有利于巨噬细胞源性泡沫细胞的形成。泡沫细胞的生物学特征包括两个方面:(1)形态学上表现为胞浆内脂质成分明显增多并聚集成滴,经油红O染色可观察到红色脂滴,胞浆呈泡沫样改变;(2)细胞内胆固醇水平明显增加,胆固醇酯占总胆固醇的50%以上。本实验从这两方面对建立的泡沫细胞模型进行鉴定,油红O染色后显微镜下可观察到ac-LDL组胞质内有大量红色脂滴形成,胞浆呈泡沫样改变,证实泡沫细胞模型构建成功。油红O染色过程中,先用预冷的4%多聚甲醛固定10 min,之后再用50%异丙醇固定5 min效果较好,若直接用50%异丙醇固定细胞会出现脱落、漂浮。0.5%油红O染色、异丙醇漂洗、苏木素复染后不需再用1% HCl反蓝,用自来水冲洗一段时间即可,否则红色脂滴可能会消失。
计算细胞内胆固醇酯与总胆固醇的比值即可分析细胞的泡沫化程度,早期国内外学者采用化学显色法测定细胞游离胆固醇和胆固醇酯的水平,但检测的灵敏度低是其主要缺陷。近年来研究者多采用HPLC法分析细胞内游离胆固醇和胆固醇酯[16],HPLC法由于具有高速、高效、高灵敏度等优势而被广泛使用[17],但目前在测定胆固醇水平中的不足是:(1)测定细胞内游离胆固醇水平时,以胆固醇作为标准品,测定210 nm波长的光吸收,而其他的细胞成分和流动相在此波长会有吸收而影响测定结果。(2)由于细胞内某些胆固醇酯种类尚未完全清楚,缺乏标准品,因而尚不能对细胞内胆固醇酯进行精确定量。(3)现有的测定方法包括冰浴破碎细胞、依次经过KOH、6%三氯乙酸、真空冷冻干燥、活性炭去色素、超声除气等实验步骤,操作繁琐,不能满足标准化操作要求。基于此,本实验参考Cullen等[9]方法,改进以上不足,建立了一种新的采用HPLC法测定泡沫细胞内胆固醇水平和胆固醇流出率的方法。以胆固醇氧化产物胆甾烯酮作为标准品,简化实验操作步骤,将酶促反应和HPLC分析相结合,测定胆甾烯酮在240 nm波长处的光吸收,对泡沫细胞内游离胆固醇和总胆固醇水平进行定量。实验中以胆甾烯酮作为标准品的优点是,胆甾烯酮的最大光吸收波长是240 nm,而在此波长下细胞中其他组份和培养基对测定没有干扰,检测的灵敏度提高。酶促反应的基本原理是:胆固醇酯在胆固醇酯酶的催化下水解为游离胆固醇,游离胆固醇在胆固醇氧化酶的催化下转变为胆甾烯酮,这样上样检测时只需检测240 nm处胆甾烯酮的峰面积即可。根据胆甾烯酮的峰面积和上样量,即可计算出游离胆固醇和总胆固醇的水平。进一步收集泡沫细胞培养基,提取脂质后,加入胆固醇氧化酶进行酶促反应,测定胆甾烯酮水平,计算培养基中的游离胆固醇水平,即可准确定量apoA-1介导的泡沫细胞内胆固醇流出率。为了摸索不同胆固醇酯类的水解作用和氧化作用的范围,本研究进行了预实验,选择合适的试剂浓度和反应条件,两个酶促反应都可完成,胆甾烯酮的最终浓度在数量上等于样品中胆固醇的初始浓度。用这种方法测定细胞中总胆固醇和游离胆固醇的水平敏感而且快速,DAD检测波长在240 nm处,得到单一的色谱峰,易于统计和计算。实验结果表明,与对照PMA组相比,50 μg/mL ac-LDL处理48 h后,泡沫细胞内游离胆固醇、总胆固醇和胆固醇酯的水平均明显增加,且细胞内胆固醇酯占总胆固醇的59.38%,进一步证实成功建立了泡沫细胞模型,而且apoA-1介导的泡沫细胞内胆固醇流出率也显着增加(P<0.01)。
为评价本实验所建立的HPLC法测定泡沫细胞内胆固醇流出率的可行性,进一步采用液体闪烁计数法测定apoA-1介导的泡沫细胞内胆固醇流出率,以对该法进行验证。液体闪烁计算法用[3H]标记的胆固醇作为标准,分别测定培养基和泡沫细胞内[3H]标记的胆固醇放射剂量cpm,以培养基中的cpm占培养基和细胞内的总cpm来表示[18]。实验中诱导分化的贴壁巨噬细胞用0.5 μCi/mL[3H]-胆固醇和50 μg/mL ac-LDL共同孵育48 h,转变为泡沫细胞。当用10 μg/mL apoA-1介导24 h后,泡沫细胞内胆固醇流出率从2.08 %上升至7.08%,增加率为240.38%。尽管同位素测定方法的灵敏度高,但由于其对实验要求较高,且同位素易对环境造成污染,为此需建立一种具有较高灵敏度的非同位素测定胆固醇流出率的方法。本实验采用酶促反应结合HPLC方法测定的泡沫细胞内胆固醇流出的增加率为231.18%,与液体闪烁计数法测定的胆固醇流出增加率具有可比性,进一步证实了其可行性。该方法的建立为研究AS的致病机制、开发新的抗AS药物及评价药效提供了技术支持。
[1]De Boer SP,Cheng JM,Rangé H,et al.Antibodies to periodontal pathogens are associated with coronary plaque remodeling but not with vulnerability or burden[J].Atherosclerosis,2014,237(1):84-91.
[2]Libby P,Ridker PM,Hansson GK.Progress and challenges in translating the biology of atherosclerosis[J].Nature,2011,473(7347):317-325.
[3]Yuan Y,Li P,Ye J.Lipid homeostasis and the formation of macrophage-derived foam cells in atherosclerosis[J].Protein Cell,2012,3(3):173-181.
[4]Beaufrère H,Nevarez JG,Wakamatsu N,et al.Experimental diet-induced atherosclerosis in Quaker parrots (Myiopsitta monachus)[J].Vet Pathol,2013,50(6):1116-1126.
[5]Calabresi L,Gomaraschi M,Simonelli S,et al.HDL and atherosclerosis:Insights from inherited HDL disorders[J].Biochim Biophys Acta,2015,1851(1):13-18.
[6]Breevoort SR,Angdisen J,Schulman IG.Macrophage-independent regulation of reverse cholesterol transport by liver X receptors[J].Arterioscler Thromb Vasc Biol,2014,34(8):1650-1660.
[7]Schmitz G,Grandl M.The molecular mechanisms of HDL and associated vesicular trafficking mechanisms to mediate cellular lipid homeostasis[J].Arterioscler Thromb Vasc Biol,2009,29(11):1718-1722.
[8]Lund-Katz S,Phillips MC.High density lipoprotein structure-function and role in reverse cholesterol transport[J].Subcell Biochem,2010(51):183-227.
[9]Cullen P,Fobker M,Tegelkamp K,et al.An improved method for quantification of cholesterol and cholesteryl esters in human monocyte-derived macrophages by high performance liquid chromatography with identification of unassigned cholesteryl ester species by means of secondary ion mass spectrometry[J].J Lipid Res,1997,38(2):401-409.
[10]Shiomi M,Koike T,Ito T.Contribution of the WHHL rabbit,an animal model of familial hypercholesterolemia,to elucidation of the anti-atherosclerotic effects of statins[J].Atherosclerosis,2013,231(1):39-47.
[11]Hasan ST,Zingg JM,Kwan P,et al.Curcumin modulation of high fat diet-induced atherosclerosis and steatohepatosis in LDL receptor deficient mice[J].Atherosclerosis,2014,232(1):40-51.
[12]郝炎,杨乔岚,余翼,等.肾动脉狭窄合并动脉粥样硬化大鼠模型的建立[J].重庆医学,2012,41(6):581-583.
[13]Liu HJ,Wang XL,Zhang L,et al.Inhibitions of vascular endothelial growth factor expression and foam cell formation by EGb 761,a special extract of Ginkgo biloba,in oxidatively modified low-density lipoprotein-induced human THP-1 monocytes cells[J].Phytomedicine,2009,16(2/3):138-145.
[14]Sato K,Fujimoto K,Koyama T,et al.Release of salusin-beta from human monocytes/macrophages[J].Regul Pept,2010,162(1/3):68-72.
[15]Liu Q,Dai Z,Liu Z,et al.Oxidized low-density lipoprotein activates adipophilin through ERK1/2 signal pathway in RAW264.7 cells[J].Acta Biochim Biophys Sin (Shanghai),2010,42(9):635-645.
[16]李国术,何平平,王波,等.硫化氢上调ABCA1表达促进泡沫细胞胆固醇流出的实验研究[J].重庆医学,2013,42(30):3596-3598.
[17]陈保林,马跃东,熊肇军,等.高效液相色谱法检测心肌细胞蛋白降解率[J].重庆医学,2011,40(22):2234-2235.
[18]Lin G,Bornfeldt KE.Cyclic AMP-specific phosphodiesterase 4 inhibitors promote ABCA1 expression and cholesterol efflux[J].Biochem Biophys Res Commun,2002,290(2):663-669.
Research on the determination of cholesterol efflux from foam cells mediated by apoA-1 using HPLC analysis*
MaWeilie1,GongXiaohua1,LiGuanqiang2,DingHang1,LanLiubo1,ChenXiaoyi1,ZhangZhizhen1△
(1.DepartmentofBiochemistryandMolecularBiology,GuangdongMedicalCollege,Dongguan,Guangdong523808,China;2.DepartmentofClinicalLaboratory,People′sHospitalofLonggangDistrict,Shenzhen,Guangdong518172,China)
ObjectiveTo establish a high performance liquid chromatography (HPLC) method for determining the cholesterol efflux from macrophage-derived foam cells mediated by apolipoprotein A-1(apoA-1).MethodsHuman THP-1 monocytic cells,pre-treated with 160 nmol/L phorbol-12-myristate acetate (PMA) for 24 h to differentiate into adherence macrophages,then incubated with 50 μg/mL acetylated low density lipoprotein (ac-LDL) for 48 h to induce foam cells formation,then added apoA-1 for 24 h.THP-1-derived macrophage foam cells were identified by oil red O-staining,and the cellular cholesterol content by measured by HPLC method.Cholesterol efflux from macrophage foam cells was determined by HPLC analysis and liquid scintillation counting,respectively.ResultsOil red O-stainable lipid droplet accumulation were observed in entire cytoplasm of THP-1-derived macrophage foam cells.Measuring cellular cholesterol content showed that free cholesterol,total cholesterol and cholesterol ester content in macrophage foam cells were increased remarkably than PMA group macrophages (P<0.01).After treated with ac-LDL for 48 h,the macrophage foam cells accumulated 80.25 μg/mg cell protein and 47.65 μg/mg cell protein respectively,and the cholesterol ester accounted for 59.38% of the cellular total cholesterol (P<0.01).The ratio of cholesterol efflux reached 5.63% and 7.08% respectively by HPLC analysis and liquid scintillation counting using apoA-1 mediation (P<0.01).ConclusionCombination of an enzymatic catalysis and HPLC method for determining cholesterol efflux from foam cells is successfully established in this study,thus providing a technical foundation for the further study of cellular lipid homeostasis.
chromatography,high pressure liquid;foam cells;apolipoprotein A-1;cholestenone;cholesterol efflux
10.3969/j.issn.1671-8348.2015.29.028
国家自然科学基金资助项目(81170267);广东省自然科学基金资助项目(S2011010002984);东莞市高等院校科研机构科技计划项目(2012108102037)。
:马卫列(1970-),硕士,副教授,主要从事脂质代谢研究。△
,Tel:(0769)22896339;E-mail:zzzhang@gdmc.edu.cn。
Q54
A
1671-8348(2015)29-4116-04
2015-04-15
2015-07-02)



