何 江,曹建佳,陈柯宏,王德林△,盛 夏,李文宾,黄亮亮
(1.重庆医科大学附属大学城医院消化神经中心 401331;2.重庆医科大学附属第一医院泌尿外科 400016)
论着·基础研究
CCM联合HCPT对人膀胱癌BIU-87细胞YAP、TEAD1表达及生物学功能的影响*
何江1,曹建佳2,陈柯宏2,王德林2△,盛夏2,李文宾2,黄亮亮2
(1.重庆医科大学附属大学城医院消化神经中心401331;2.重庆医科大学附属第一医院泌尿外科400016)
目的探讨姜黄素(CCM)联合羟基喜树碱(HCPT)对人膀胱癌BIU-87细胞中YAP、TEAD1表达及凋亡的作用。方法CCM和HCPT分别单独与联合用药处理膀胱癌BIU-87细胞。免疫组织化学检测膀胱癌组织及癌旁组织中YAP和TEAD1表达情况,流式细胞仪检测细胞凋亡情况;RT-PCR和Western blot检测YAP及TEAD1基因的mRNA和蛋白的表达变化。结果YAP和TEAD在膀胱癌组织及癌旁组织中均有阳性表达,差异有统计学意义(P<0.05)。流式细胞仪检测结果显示CCM和HCPT均可有效诱导膀胱癌细胞BIU-87的凋亡。CCM组和HCPT组BIU-87细胞中YAP及TEAD1 mRNA和蛋白表达显着降低(P<0.05),联合用药组YAP及TEAD1 mRNA和蛋白表达更低(P<0.05)。结论CCM和HCPT联合用药抗癌机制可能是通过抑制Hippo信号通路中YAP癌基因表达,下调TEAD1,并诱导膀胱癌细胞凋亡产生。
姜黄素;膀胱肿瘤;羟基喜树碱;YAP;TEAD1
膀胱癌是泌尿系统常见的恶性肿瘤之一,发病率占90%~95%,居全球恶性肿瘤的第9位[1]。治疗主要以早期手术或联合膀胱灌注化疗、晚期姑息化疗为主,但目前化疗机制尚不清楚,化疗缓解率较低,因此,寻找抑制膀胱癌生长的药物及探讨其抑癌机制成为当务之急。
姜黄素(CCM)为姜黄的重要活性物质之一,具有多种药物价值,如抗炎、抗突变、抗肿瘤[2-4]。喜树碱中提取出的羟基喜树碱(HCPT)为抗癌作用最强的化合物,具有抗癌特性独特,高效低毒,抗癌谱面广,与多种抗肿瘤药无交叉耐药等特点,并对某些具有耐药性的肿瘤仍具有抗癌性。新发现的Hippo信号通路异常调控与人类肿瘤密不可分[5],YAP是Hippo信号通路中下游的关键因子之一,YAP不能直接调控转录,需结合共转录因子TEAD1影响细胞增殖和凋亡[6]。目前姜黄素与羟基喜树碱联合用药对膀胱癌BIU-87细胞的研究报道较少,因此,本研究将探讨姜黄素与羟基喜树碱联合对人膀胱癌BIU-87细胞中癌基因YAP、下游转录因子TEAD1增殖和凋亡的影响,旨在为临床化疗提供新的方法,并阐明其抑癌机制。
1 材料与方法
1.1组织学资料标本为重庆医科大学附属第一医院泌尿外科2009年2月至2012年6月36例患者手术切取的膀胱癌组织及癌旁组织(切取距肿瘤组织大于3 cm的正常膀胱黏膜为癌旁组织)。男25例,女11例,平均年龄57.3岁,均为无放化疗治疗史的初发病例。膀胱癌组织病理类型:乳头状膀胱癌27例,浸润性膀胱癌9例。
1.2实验材料BIU-87细胞受赠于重庆医科大学附属第一医院泌尿外科王德林教授;CCM、二甲基亚砜(DMSO)均为美国Sigma公司生产;HCPT由重庆医科大学药学实验室曹维国副教授惠赠;CCK-8试剂盒购自重庆海韵生物公司;胎牛血清购自Gibco公司;RPMI1640培养基购自Hyclone公司。YAP、TEAD1及GADPH引物由博培生物工程技术有限公司合成;总RNA提取试剂RNAiso、逆转录试剂盒及Tap酶购自Takara大连宝生物工程有限公司;兔抗人YAP、TEAD1抗体购自Santa Cruz公司;兔抗人β-actin抗体、HRP标记羊抗兔IgG、RIPA蛋白裂解液等试剂均购自四正柏生物技术有限公司。
1.3方法
1.3.1细胞培养及药物处理BIU-87用含有10%胎牛血清的RPMI1640培养基,在5% CO237 ℃饱和湿度的环境下培养,待细胞生长密度约至90%时,用0.25%的胰酶将培养瓶中的细胞消化、传代。实验分为4组:对照组(未加药)、CCM组(CCM 10 μmol/L)、HCPT组(HCPT 1 μg/mL)和联合用药组(CCM 10 μmol/L +HCPT 1 μg/mL)。
1.3.2免疫组织化学标本首先用4%多聚甲醛固定,再经梯度乙醇和二甲苯脱水,石蜡包埋后连续切片,厚度为3~4 μm,选择链霉素抗生物素-过氧化物酶三步法进行YAP、TEAD1表达水平检测。具体步骤:石蜡切片脱蜡,70%~100%梯度乙醇脱水,枸橼酸缓冲液高温修复3次,冷却至室温,洗片3 min×3次;3%H2O2室温孵育20 min,洗片,5%山羊血清37 ℃封闭30 min,倾去不洗;滴加一抗工作液,4 ℃过夜,洗片,加二抗工作液, 37 ℃孵育30 min,洗片,滴加少许辣根酶标记的链霉卵白素工作液,37 ℃ 孵育30 min,洗片;DAB显色,自来水充分冲洗,复染,脱水,透明,封片。结果以细胞核和(或)细胞质中棕黄色出现为阳性染色:细胞中胞质棕黄色范围大于50%,胞核棕黄色范围大于10%和胞质胞核中均有棕黄色反应3种情况为高表达(++);单纯胞质棕黄色范围小于50%,胞核棕黄色范围小于10%为低表达(+);胞核和胞质棕黄色范围均小于10%的为不表达(-)[7]。
1.3.3细胞凋亡率检测待培养瓶细胞密度为90%左右时,弃掉培养液, 0.25%胰酶适度消化,吹打均匀,接种2×105/mL于培养瓶。在前期预实验中发现在CCM浓度为10 μmol/L、HCPT浓度为1 μg/mL时抑制膀胱癌BIU-87细胞效率较高。各组培养24 h后,用胰酶消化细胞成单细胞悬液,调整细胞密度为1×106/mL。磷酸盐缓冲液(PBS)冲洗2次,均匀吹打成细胞悬液转移到1.5 mL的EP管中,分别加入AnnexinⅤ和PI,室温避光孵育15 min后,FCM测定凋亡率。实验重复3次。
1.3.4RT-PCR检测YAP及TEAD1的mRNA收集上述各组细胞,用RNAiso按说明书提取各组约106个细胞总RNA,用紫外线分光光度计检测纯度和浓度后,将RNA浓度调成一致并取等量模板,将逆转录试剂盒反转录为cDNA,并进行PCR反应。YAP上游引物:5′-TGA ACA AAC GTC CAG CAA GAT AC-3′,下游引物:5′-CAG CCC CCA AAA TGA ACA GTA G-3′,165 bp;GAPDH内参上游引物:5′-ACC ACC ATG GAG AAG GCT GG-3′,下游引物:5′-CTC AGT GTA GCC CAG GAT GC-3′,500 bp ;TEAD1上游引物:5′-TGA ATC AGT GGA CAT TCG TCA-3′,下游引物:5′-GCC ATT CTC AAA CCT TGC ATA-3′,280 bp。扩增基因条件:95 ℃ 5 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共30个循环,72 ℃ 5 min。PCR产物经3%琼脂糖凝胶进行电泳,以YAP或TEAD1与内参GADPH片段的条带光密度(OD)作半定量值比较作为YAP或TEAD1 mRNA相对表达水平,实验重复3次。
1.3.5Western blot检测YAP及TEAD1的蛋白表达提取各处理组细胞总蛋白,BCA法进行蛋白定量。每孔上样60 μg在10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳分离后,将含有目的蛋白的凝胶条带转移到聚偏氟乙烯(PVDF)膜上,转膜,5%脱脂奶粉封闭2 h,加入一抗(1∶200稀释)于4 ℃冰箱中过夜。TBST洗膜10 min,共3次,然后加HRP标记的二抗(1∶5 000)稀释,37 ℃ 2 h,再次用TBST洗膜10 min,共3次,放置于凝胶成像仪中免疫印迹化学发光(ECL)显影,暗室下曝光,以YAP或TEAD1与内参β-actin条带密度比值表示YAP或TEAD1相对蛋白表达量,实验重复3次。
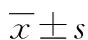
2 结 果
2.1免疫组织化学检测YAP、TEAD1在膀胱癌和癌旁组织中表达36例膀胱癌组织中YAP的阳性率为83.3%(30/36),棕黄色样阳性表达见于胞核和胞质,染色深;癌旁组织的阳性率为13.9%(5/36),染色浅,表达多为胞质内,YAP在膀胱癌和癌旁组织中的表达差异有统计学意义(P<0.05);TEAD1的阳性表达率为63.9%(23/36),主要位于胞核,染色明显且深,癌旁组织的阳性表达率为13.9%(3/36),染色较浅,差异有统计学意义(P<0.05)。见图1、表1。
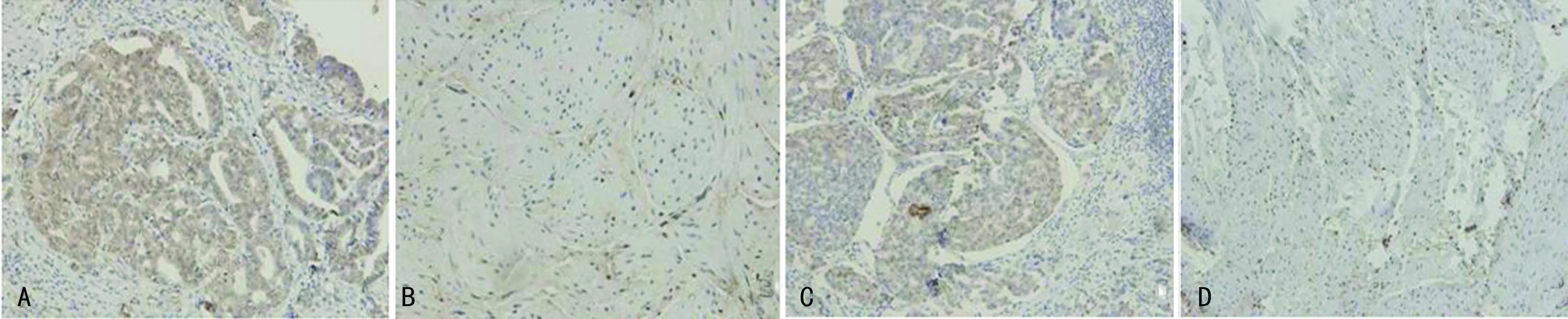
A:YAP在膀胱癌组织的表达;B:YAP在癌旁组织的表达;C:TEAD1在膀胱癌组织的表达;D:TEAD1在癌旁组织的表达。
图1免疫组织化学检测YAP、TEAD1在膀胱癌和癌旁组织中表达(×400)

A:对照组;B:CCM组;C:HCPT组;D:联合用药组。
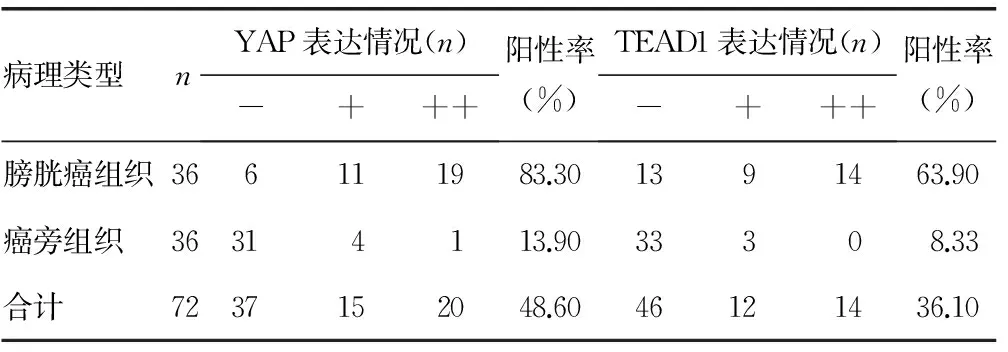
图2 流式细胞仪检测各组细胞的凋亡情况
2.2流式细胞仪检测细胞凋亡率细胞凋亡率:对照组(3.82±0.11)%,CCM组(12.18±0.33)%,HCPT组(10.83±0.14)%,联合用药组(37.25±1.88)%。各组细胞凋亡率均明显高于对照组,差异有统计学意义(P<0.05),联合用药组显着高于其他组(P<0.05)。见图2。
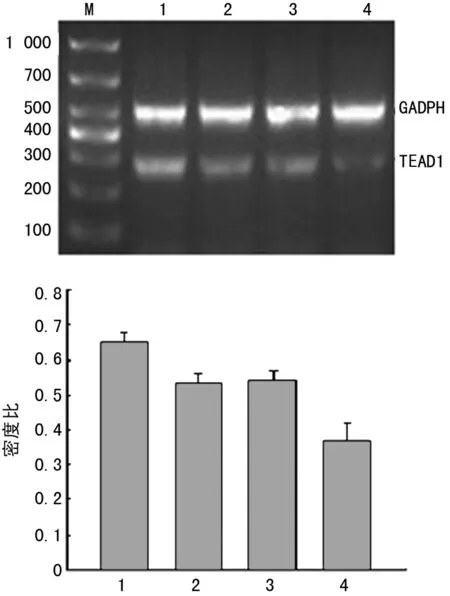
2.3RT-PCR检测YAP、TEAD1 mRNA表达水平CCM组、HCPT组及联合用药组中YAP、TEAD1 mRNA表达均显着低于对照组,差异有统计学意义(P<0.05);联合用药组中YAP、TEAD1 mRNA表达显着低于CCM组、HCPT组,差异有统计学意义(P<0.05)。见图3、4。
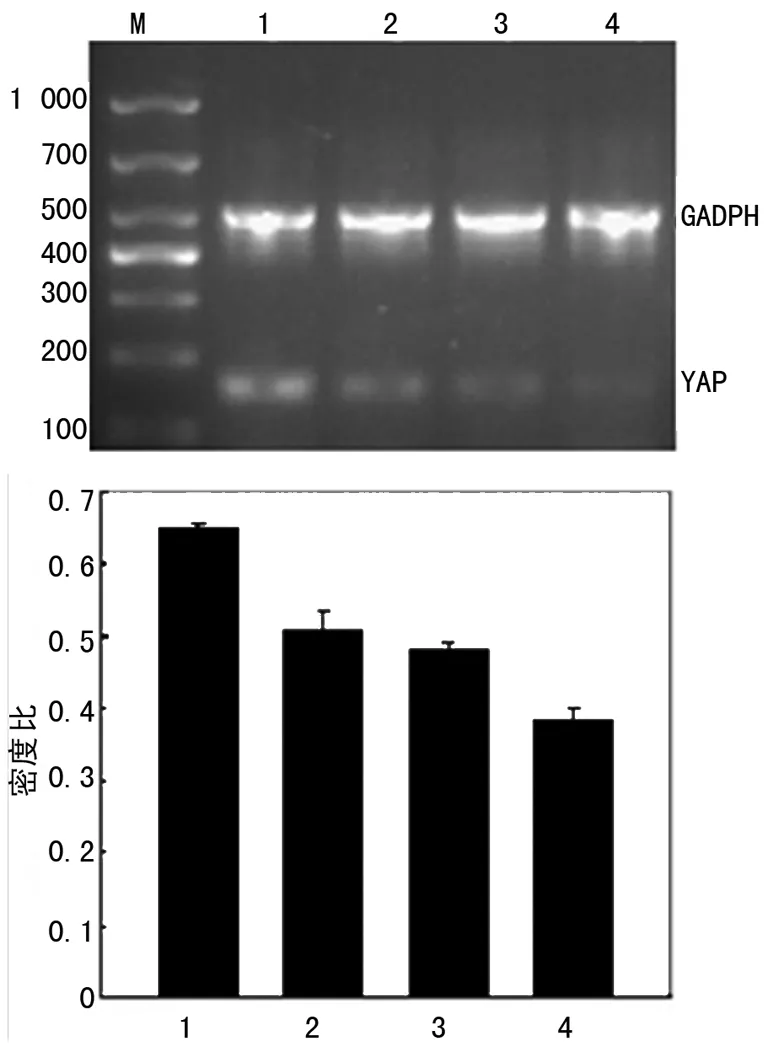
1:对照组;2:CCM组;3;HCPT组;4:联合用药组。
图3各组YAP mRNA表达变化
2.4Western blot检测YAP、TEAD1蛋白表达水平与对照组相比,其余3组YAP和TEAD1蛋白表达均下降,差异有统计学意义(P<0.05),联合用药组比单独用药组下降更明显(P<0.05)。见图5。
1:对照组;2:CCM组;3;HCPT组;4:联合用药组。
图4各组TEAD1 mRNA表达变化
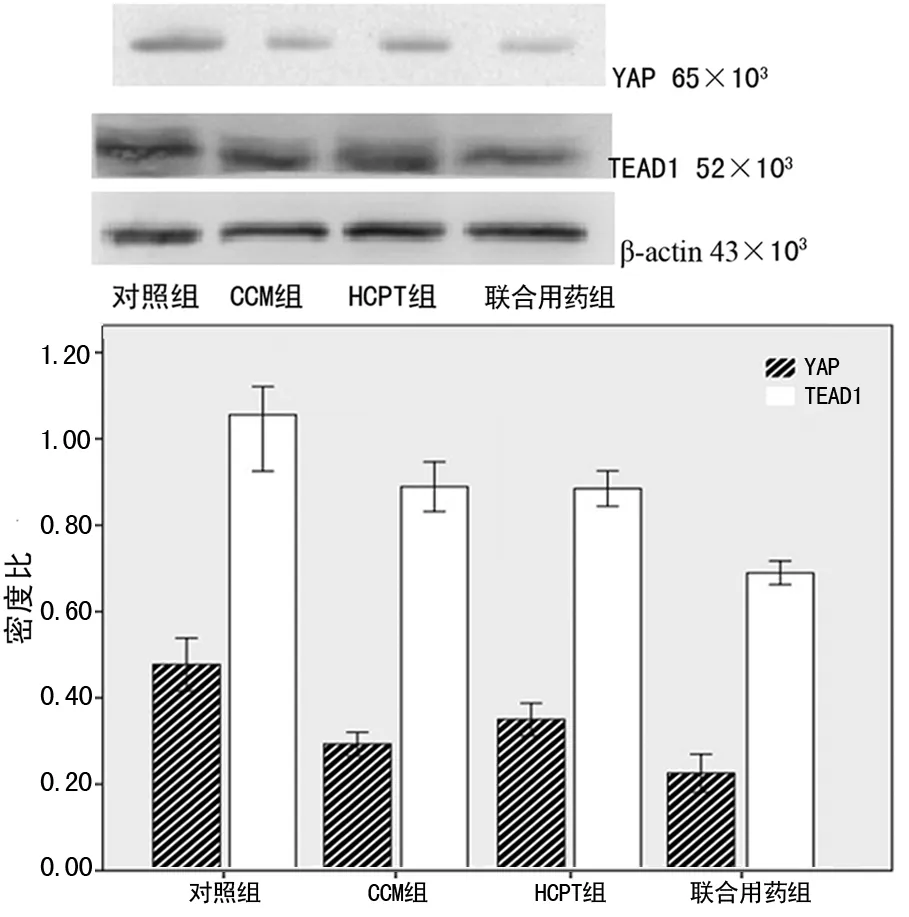
图5 各组YAP、TEAD1蛋白表达变化
3 讨 论
膀胱癌发病率位居泌尿系恶性肿瘤首位,其发生的具体机制不明。Hippo信号通路可能参与膀胱癌的发生和发展。Li等[8]用免疫组织化学法检测发现YAP在膀胱癌组织中主要表达于细胞核和细胞质,不同病例表达强度也不同,阳性表达率高达86.8%,在癌组织及正常组织中的表达差异有统计学意义,提示YAP在移行上皮细胞肿瘤中发挥致癌作用。本研究通过免疫组织化学法发现YAP和TEAD1在膀胱癌及癌旁组织中分别为高表达和低表达,说明YAP和TEAD1在膀胱癌中具有肿瘤特异性,其可能参与了膀胱癌细胞的增殖调控作用。
目前膀胱癌主要治疗方法仍依靠手术切除,对于保留膀胱的患者,术后灌注化疗是一种可预防肿瘤复发的有效、可靠手段[9]。临床上,CCM治疗肿瘤主要通过干扰肿瘤细胞增殖和促进肿瘤细胞凋亡来实现,这在以前有类似报道。Chauhan等[10]研究发现,长期食用姜黄的地区,其大肠癌及尿路上皮细胞癌的患病率显着低于其他地区。HCPT是发现的喜树碱衍生物,具有抗癌活性高、毒性低等价值,是临床上用于膀胱癌化疗的重要药物。羟基喜树碱影响生物体内TopⅠ的活性能力,此酶在调节超螺旋、连锁、去连锁等一系列包括核酸解节作用方面发挥作用,作用于DNA拓扑结构,引起相关细胞走向死亡。凋亡与基因的激活、表达和调控等有关,所以说是生物清除危害机体细胞的主要手段,在生物发育成长、免疫系统成熟、稳定组织及衰老中发挥关键作用[11]。中药是目前研究肿瘤机制及治疗的热点,开发抑制增殖、促肿瘤细胞凋亡的中药是未来研究方向。研究表明,化疗药物通过诱导细胞凋亡这一抗癌机制将会被认为是控制癌症生长及增殖的最佳途径[12-13]。本实验发现CCM和HCPT诱导膀胱癌细胞凋亡的可能机制,为膀胱癌的联合用药方案提供了可行性实验研究依据。
本实验结果显示,单药组及联合用药组均可诱导膀胱癌BIU-87细胞凋亡,联合用药组细胞凋亡率显着高于单药组(P<0.05),说明CCM和HCPT联合用药方案对膀胱癌可产生更好的疗效。在RT-PCR与Western blot检测中观察到单药组和联合用药组,YAP、TEAD1表达量均下降明显(P<0.05)。CCM和HCPT都干扰了YAP、TEAD1的表达,而联合用药作用更明显。其机制可能为药物通过作用癌基因YAP,进而干扰下调TEAD1的表达来实现抑制膀胱癌细胞的增殖,促进其凋亡。
综上所述,Hippo信号通路中YAP和TEAD1表达与膀胱癌发生、发展密切相关,可能成为肿瘤新的生物标志物之一,为膀胱癌基因靶向治疗提供实验依据,指明新的方向。CCM和HCPT均能诱导膀胱癌BIU-87细胞凋亡,两药联用具有叠加效应,其机制可能为通过抑制YAP进而阻断TEAD1的表达来抑制膀胱癌细胞增殖,诱导其凋亡。至于CCM和HCPT如何抑制Hippo信号通路核心因子YAP,以及对下游产生连锁的一系列影响,从而诱导膀胱癌凋亡,以后将进一步去深究证实。
[1]Oudard S.Progress in emerging therapies for advanced prostate cancer[J].Cancer Treat Rev,2013,39(3):275-289.
[2]Gota VS,Maru GB,Soni TG,et al.Safety and pharmacokinetics of a solid lipid volcurcumin particle formulation in osteosarcoma patients and healthy unteers[J].Agric Food Chem,2010,58(4):2095-2099.
[3]Walters DK,Muff R,Langsam B,et al.Cytotoxic effects of curcumin on osteosarcoma cell lines[J].Invest New Drugs,2008,26(4):289-297.
[4]Epstein J,Sanderson IR,Macdonald TT,et al.Curcumin as a therapeutic agent:the evidence from in vitro,animal and human studies[J].Br J Nutr,2010,10(3):1545-1557.
[5]Zhao B,Lei QY,Guan KL.The Hippo-YAP pathway:new connections between regulation of organ size and cancer [J].Curr Opin Cell Biol,2008,20(6):638-646.
[6]Kessler CA,Bachurski CJ,Schroeder J,et al.TEAD1 inhibits prolactin gene expression in cultured human uterine decidual cells [J].Mol Cell Endocrinol,2008,295(1):32-38.
[7]Steinhardt AA,Gayyed MF,Klein AP,et al.Expression of Yes-associated protein in common solid tumors [J].Hum Pathol,2008,39(11):1582-1589.
[8]Li N,Xiao H,Zheng HX,et al.The expression of Yes-associated protein in urothelial tumors of ladder and its clinical significance [J].Shanxi Med Univ,2011,42(5):383-386.
[9]Clark PE,Agarwal N,Biagioli MC,et al.Bladder cancer [J].J Natl Compr Canc Netw,2013,11(4):446-475.
[10]Chauhan DP.Chemotherapeutic potential of curcumin for colorectal cancer [J].Curr Pharm Des,2002,8(19):1695-1706.
[11]Nitiss JL.Investigating the biological functions of DNA topo-isomerases in eukaryotic cells [J].J Biochim Biophys Acta,1998,1400(1/2/3):63-81.
[12]Fishel ML,Newell DR,Griffin RJ,et al.Effect of cell cycle inhibition on Cisplatin-induced cytotoxicity [J].J Pharmacol Exp Ther,2005,312(1):206-213.
[13]McKnight JJ,Gray SB,O′Kane HF,et al.Apoptosis and chemotherapy for bladder cancer [J].J Urol,2005,173(3):683-690.
Effects of curcumin combined with hydroxycamptothecin on the expression of YAP,TEAD1 gene and biological function in human bladder cancer cell line BIU-87*
HeJiang1,CaoJianjia2,ChenKehong2,WangDelin2△,ShengXia2,LiWenbin2,HuangLiangliang2
(1.GastroenterologyandNeurologyCenter,University-TownHospital,ChongqingMedicalUniversity,Chongqing401331,China;2.DepartmentofUrology,theFirstAffiliatedHospital,ChongqingMedicalUniversity,Chongqing400016,China)
ObjectiveTo investigate the expression of curcumin (CCM) combined with hydroxycamptothecin (HCPT) on YAP,TEAD1 and apoptosis in human bladder cancer cell line BIU-87.MethodsCCM and HCPT were separately treatment and combined treatment of bladder cancer BIU-87 cells.Immunohistochemical(IHC) method was used to detect expression of YAP and TEAD1 in bladder cancer and tissue adjacent to carcinoma;Apoptosis rate of the human bladder cancer cell BIU-87 was detected by flow cytometry(FCM) instruments after CCM and HCPT were administered alone or in combination;Detection of YAP,TEAD1 gene mRNA and protein expression changes was depended on RT-PCR and Western blot.ResultsThe results showed that YAP and TEAD1 had positive expressions in bladder cancer and tissue adjacent to carcinoma (P<0.05),the difference had obvious significance.The results of detection by FCM showed that CCM and HCPT both induced apoptosis of bladder cancer cell BIU-87 effectively.The mRNA and protein expression of YAP and TEAD1 in human bladder cancer cell BIU-8 significantly reduced in both CCM group and HCPT group,and mRNA and protein expression of YAP and TEAD1 was lower in the combination group(P<0.05).ConclusionCCM and HCPT combination anti-cancer mechanism may be through inhibiting the Hippo signaling pathway in YAP cancer gene expression,cut TEAD1,and induce bladder cancer cell apoptosis.
curcumin;urinary bladder neoplasms;hydroxycamptothecinm;YAP;TEAD1
10.3969/j.issn.1671-8348.2016.25.002
国家自然科学基金资助项目(30972999)。
何江(1974-),主治医师,硕士,主要从事泌尿系肿瘤基础和临床方面的研究。
,E-mail:dlwangws@sina.com。
R737.14
A
1671-8348(2016)25-3462-04
2016-03-20
2016-06-08)



