姚智慧,程远雄△,赖文岩,蔡开灿
(南方医科大学南方医院:1.呼吸科;2.心血管内科;3.心胸外科,广州 510515)
·论 着·
达比加群对凝血酶诱导的人气道平滑肌细胞收缩和增殖的影响
姚智慧1,程远雄1△,赖文岩2,蔡开灿3
(南方医科大学南方医院:1.呼吸科;2.心血管内科;3.心胸外科,广州 510515)
目的 探讨达比加群对凝血酶诱导的人气道平滑肌(HASM)细胞收缩和增殖的影响。方法 将原代培养的HASM细胞用于实验。用免疫荧光的方法观察细胞收缩的形态学变化;用Western blot法分析α-actin蛋白相对表达量;用cck8法检测平滑肌细胞增殖能力。结果 达比加群能显着抑制凝血酶诱导的HASM细胞骨架重组和收缩蛋白α-actin的表达(P<0.05)。对血管紧张素Ⅱ(AngⅡ)、转化生长因子-β1、血小板源性生长因子、乙酰甲胆碱、凝血酶的促增殖能力进行比较,凝血酶显着强于AngⅡ,仅次于10%胎牛血清(P<0.05)。达比加群呈浓度依赖性和时间依赖性地抑制了凝血酶诱导的HASM细胞增殖(P<0.05)。结论 达比加群能够显着抑制凝血酶诱导的HASM细胞收缩和增殖。
平滑肌细胞;凝血酶;达比加群;血管紧张素Ⅱ;转化生长因子-β
气道高反应性和气道重塑是哮喘的两大病理特征,是导致哮喘患者气道狭窄、气流受限、肺功能持续下降的主要原因。气道平滑肌细胞作为气道的主要收缩细胞,是气道高反应性最终效应的执行者。同时,其增殖不仅使气道平滑肌层收缩能力增强,而且通过参与气道重塑进一步加剧哮喘患者气流受限。因此,彻底控制气道平滑肌细胞收缩和增殖对哮喘患者尤其是难治性哮喘患者的治疗及改善预后有重要意义。多项研究显示,在哮喘炎症状态下,哮喘气道凝血系统过度激活,凝血酶活性显着高于健康对照组[1-2]。过度激活的凝血酶可诱导人气道平滑肌(HASM)细胞、肺成纤维细胞收缩和增殖[3]。然而,凝血酶在肺成纤维细胞的这一作用在体内外试验中都已证实可被新型高效的直接凝血酶抑制剂-达比加群所抑制[4-5]。本试验以HASM细胞为试验对象,探讨达比加群对凝血酶诱导的HASM细胞收缩和增殖的影响,以期为达比加群可能成为治疗哮喘气道高反应性和气道重塑药物提供试验依据。
1 材料与方法
1.1 材料 胎牛血清、高糖DMEM培养基、胰蛋白酶购于美国Gibco公司;人凝血酶、罗丹明鬼笔环肽购于美国Sigma公司,达比加群购于德国Boehringer Ingelheim Pharma公司;cck8试剂购于日本同仁公司;小鼠抗平滑肌α肌动蛋白(α-SMA),BCA100蛋白定量分析试剂盒和全蛋白提取试剂盒购于碧云天生物技术研究所;小鼠抗GAPDH抗体购于北京博奥森生物技术有限公司;FITC-山羊抗小鼠二抗购于北京中杉金桥生物科技有限公司;小鼠IgG-HRP二抗购于杭州弗德生物技术有限公司。
1.2 方法
1.2.1 原代人气道平滑肌细胞的培养 本试验获南方医科大学南方医院伦理委员会批准(NFEC-201109-K1)。试验前均已告知患者试验目的并签署知情同意书。取南方医院胸外科肺叶切除手术标本,采用组织块贴壁法培养原代HASM细胞。细胞从组织块爬出、融合后,用0.125%胰酶消化,部分变圆时以10%FBS立即终止。以后按1∶2常规传代,取3~6代对数生长期细胞用于试验研究。
1.2.2 免疫荧光 将细胞以30%~40%的密度均匀种于处理过的玻片上,待细胞长至50%~60%融合时分为对照组、凝血酶组、凝血酶+达比加群组刺激30 min。PBS液轻柔漂洗2遍后,用3.75%多聚甲醛固定30 min,TritonX-100通透5 min,5%BSA室温封闭1 h。然后用α-SMA抗体4 ℃孵育过夜或罗丹明鬼笔环肽室温孵育45 min。PBS漂洗3遍后室温孵育荧光二抗30 min或予以DAPI室温复染5 min,封片后在正置荧光显微镜下观察。
1.2.3 Western blot检测α-actin蛋白的表达 常规接种6 cm平皿,细胞饥饿过夜后,分对照组、凝血酶组、凝血酶+达比加群组。细胞经预冷的PBS液冲洗2次,加入80 μL蛋白裂解液冰上裂解,收集细胞。转移至EP管,4 ℃ 12 000 r/min离心15 min,收集上清液,用BCA法测定蛋白浓度。10% SDS-PAGE凝胶电泳分离蛋白后湿转至PVDF膜,5%BSA室温封闭1 h,α-actin一抗4 ℃孵育过夜;次日二抗室温孵育2 h。采用ECL化学发光法曝光显示目的条带。用Gel-Pro analyzer图像分析软件分析条带灰度值,以α-actin/GAPDH代表目的蛋白的相对表达量。
1.2.4 cck8细胞增殖实验 常规消化细胞后计数,以8×103个/孔的密度将200 μL细胞悬液种于96孔培养板,37 ℃孵育过夜。细胞刺激预先设计的浓度和时间后,按每孔10 μL加入cck8溶液,37 ℃避光孵育2 h,用酶标仪检测吸光度值A450。
1.3 统计学处理 应用Graphpad Prism 6软件统计数据,多组间经方差分析具有统计学差异后,选用Bonferroni′s多重检验进行组间比较。P<0.05为差异有统计学意义。
2 结 果
2.1 原代HASM细胞培养与鉴定 采用组织块贴壁法分离培养HASM细胞。约2周后原代细胞从贴壁组织边缘长出,并以组织块为中心向周边延伸直至融合。见图1。
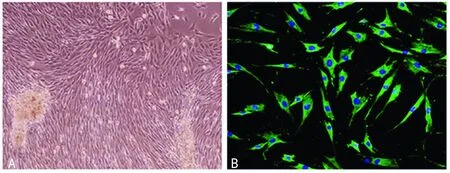
A:原代HASM细胞从组织爬出后逐渐融合呈现“峰谷征”;B: 免疫荧光染色可见α-SMA为绿色荧光,DAPI染核呈蓝色荧光。
图1 原代HASM细胞形态及表型鉴定(×100)
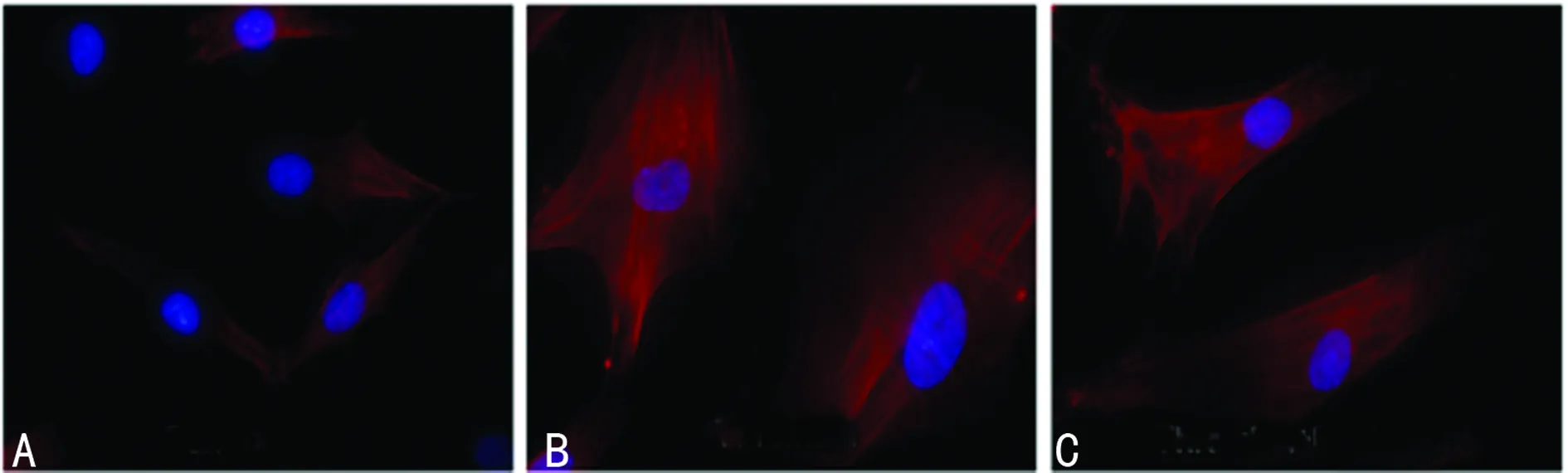
A:对照组;B:凝血酶组;C:凝血酶+达比加群组。
图2 达比加群对凝血酶诱导的HASM细胞骨架重组的抑制(×1 000)
2.2 达比加群对凝血酶促HASM细胞收缩效应的影响 以罗丹明鬼笔环肽标记细胞骨架,从形态学上观察细胞收缩变化。如图2所示,凝血酶(1 U/mL)刺激HASM细胞30 min后,细胞骨架重组,细胞张力明显增加,并可见浓密的F-actin应力纤维。达比加群与凝血酶共培养后,张力减弱,F-actin应力纤维稀疏。为了进一步证明达比加群能够抑制凝血酶诱导的HASM细胞收缩,笔者用Western blot检测α-actin蛋白的表达。如图3所示,凝血酶诱导的α-actin表达被达比加群显着抑制(P<0.05)。
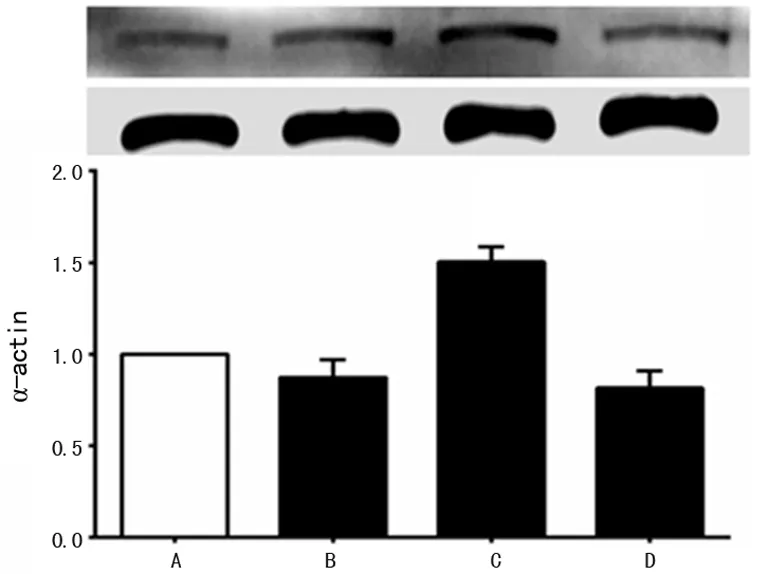
A:对照组;B:达比加群组;C:凝血酶组;D:凝血酶+达比加群组。
图3 达比加群对凝血酶诱导的HASMα-actin蛋白表达的抑制
2.3 多种促生长介质对HASM细胞增殖能力的比较 多年来,本课题组专注于血管紧张素Ⅱ(AngⅡ)、转化生长因子-β1(TGF-β1)、血小板源性生长因子(PDGF)、乙酰甲胆碱(Mch)、凝血酶促HASM重塑机制的研究[6],但未对其促增殖能力进行比较。如图4所示,与对照组相比,凝血酶促增殖能力最强,仅次于10%FBS;PDGF(20 ng/mL)、TGF-β1(2 ng/mL)、AngⅡ (10-7mol/L)同样能促进HASM细胞生长(P<0.05),而Mch无促增殖作用(P>0.05)。凝血酶与PDGF、TGF-β1、AngⅡ相比,只有凝血酶与AngⅡ的促增殖能力比较差异有统计学意义(P<0.05)。
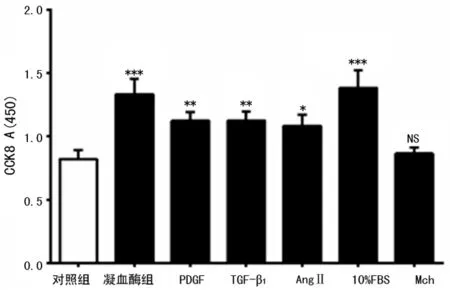
*:P<0.05,**:P<0.01,***:P<0.001,与对照组比较。
图4 多种促增殖介质对HASM细胞促增殖能力的对比
2.4 达比加群对凝血酶促HASM细胞增殖效应的影响 选取100~5 000 ng/mL达比加群与凝血酶(1 U/mL)共同刺激HASM细胞48 h。如图5所示,1 000、3 000、5 000 ng/mL达比加群可显着抑制凝血酶诱导的HASM细胞增殖,5 000 ng/mL作用最强(P<0.05)。然而经统计学分析,单用5 000 ng/mL达比加群已经对HASM细胞有毒副作用。因此,本研究选取3 000 ng/mL达比加群进行后续试验。
为了进一步检测达比加群是否可持续性抑制凝血酶诱导的HASM细胞增殖,本研究将达比加群(3 000 ng/mL)与凝血酶共同刺激HASM 细胞12~72 h后检测各培养孔吸光度值。如图6所示,从24 h开始,达比加群呈时间依赖性地抑制了凝血酶诱导的HASM细胞增殖(P<0.05)。
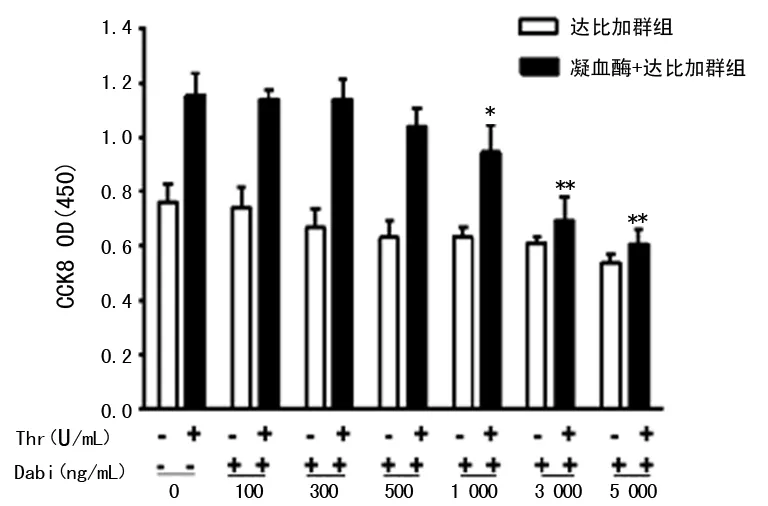
*:P<0.01,**:P<0.001,与凝血酶组比较。
图5 达比加群浓度依赖性地抑制凝血酶诱导的HASM细胞增殖
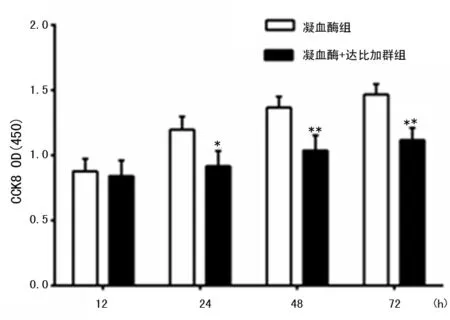
*:P<0.05,**:P<0.01,与单用凝血酶相比。
图6 达比加群时间依赖性地抑制凝血酶诱导的HASM细胞增殖
3 讨 论
近年来,肺内凝血已成为哮喘防治的研究热点。多家权威杂志新近报道,凝血不仅发生在受损血管,还发生在哮喘炎性气道[7-8]。研究发现哮喘患者处于血栓前状态。与健康对照组相比,哮喘患者血管性血友病因子抗原(vWF),血浆D二聚体和纤溶酶原激活物抑制剂-1显着升高[9];凝血功能主要包括活化部分凝血活酶时间、血浆凝血酶时间、血浆凝血酶原时间缩短和纤维蛋白原显着升高[10]。在哮喘炎症状态下,肺内毛细血管网通透性增加,凝血因子、组织因子大量涌入肺泡间隔,从而启动内、外源性凝血途径,导致肺脏局部处于高凝状态,凝血酶过度产生[8]。据文献报道,哮喘急性发作或稳定期哮喘患者局部肺组织予以过敏原激发后,凝血酶活性显着高于健康对照组[11]。过度激活的凝血酶通过刺激气道平滑肌细胞和成纤维细胞收缩、增殖,诱导多种细胞因子、生长因子产生而广泛参与哮喘气道高反应性、气道重塑过程。因此,凝血酶已成为哮喘患者降低气道高反应性,延缓气道重塑的重要靶点。
已有研究报道凝血酶及凝血酶受体激活肽可诱导豚鼠气道及离体支气管环收缩[12]。本研究从细胞水平证实凝血酶可刺激HASM细胞骨架重组和收缩蛋白α-actin表达。并且本研究进一步证明新型高效的直接凝血酶抑制剂达比加群可阻断凝血酶的这一作用(图2、3)。这与达比加群在肺成纤维细胞可抑制凝血酶诱导的胶原凝胶收缩和细胞骨架重组的结果一致[4]。
AngⅡ、TGF-β1、PDGF、凝血酶都是良好的HASM细胞有丝分裂原。已有研究发现,凝血酶可通过诱导MAPK磷酸化刺激HASM细胞增殖[13]。本研究对多种促生长介质的增殖能力进行了对比,结果显示凝血酶的促增殖能力显着强于AngⅡ,仅次于阳性对照10%FBS(图4)。这可能与凝血酶和AngⅡ各自受体在HASM细胞的表达水平及靶器官不同有关。
本研究通过达比加群浓度梯度和时间进程相关试验证明,达比加群可呈浓度与时间相关性抑制凝血酶诱导的HASM细胞增殖(图5、6)。这与达比加群可阻断凝血酶诱导的人肺成纤维细胞增殖的结果是一致的。但是本试验中选取的达比加群最佳浓度3 000 ng/mL明显高于其在人肺成纤维细胞的浓度1 000 ng/mL。虽然本试验中1 000 ng/mL达比加群也能抑制凝血酶的作用,这可能是由于HASM细胞和肺成纤维细胞对达比加群的敏感性以及对达比加群溶解剂二甲基亚砜(DMSO)的耐受程度不同。DMSO作为助溶剂刺激细胞超过一定浓度时会对细胞的生长产生抑制作用;国内外文献报道的浓度范围因细胞种类不同而异,公认标准为DMSO浓度在0.1%以下时对细胞的生长无影响。在本试验中,5 000 ng/mL达比加群组的DMSO浓度为0.5%,已经对HASM细胞的生长产生了抑制作用。另外,凝血酶的生物学效应主要通过水解凝血酶受体PAR1介导。已有研究证实,达比加群能够通过阻断凝血酶催化水解PAR1,减少下游信号通路ERK1/2和AKT的磷酸化,并降低脐静脉和脑内皮细胞的通透性[14]。达比加群在HASM细胞对凝血酶诱导的收缩和增殖的抑制作用是否也与PAR1相关以及下游信号通路变化如何,将是本课题组后续研究的方向。
目前,糖皮质激素是治疗哮喘的主要药物,但这只能控制哮喘气道炎症却不能充分抑制气道平滑肌细胞增殖等导致的气道重塑。另外,在临床试验中,对哮喘患者予以肝素为代表的抗凝治疗只能缓解哮喘患者主观症状,而肺功能无明显改善[15]。究其原因可能与肝素不能特异阻断凝血级联反应及凝血酶有关。达比加群是继华法林之后50年来上市的首个新型口服抗凝血药物,已被美国等多个西方国家权威指南推荐替代华法林用于心房颤动的抗凝治疗,其适应证还在不断拓宽。与维生素K拮抗剂华法林相比,达比加群不仅能特异阻断凝血酶,还具有起效快,可预见的药代动力学和药效学参数,无需定期监测凝血功能,不易与食物及其他药物发生相互作用等优势[16]。研究显示,在屋尘螨诱导的哮喘小鼠模型中,达比加群能够抑制Th2型细胞因子白细胞介素-4水平。而本研究结果证明,达比加群可显着抑制哮喘关键因子凝血酶诱导的HASM细胞收缩和增殖。因此,达比加群依赖其抗凝特异性及药理学优势可能成为新的哮喘抗凝治疗药物。
总之,凝血酶诱导的HASM细胞收缩和增殖能被达比加群所抑制。本研究结果为达比加群成为治疗哮喘气道高反应性和气道重塑药物提供了细胞学证据。
[1]Brims FJH,Chauhan AJ,Higgins B,et al.Coagulation factors in the airways in moderate and severe asthma and the effect of inhaled steroids[J].Thorax,2009,64(12):1037-1043.
[2]SchoutenM,LeviM.Earlyactivationofcoagulation after allergen challenge in patients with allergic asthma[J].J Throm Haemostasis,2009,7(9):1592-1594.
[3]Chambers RC.Procoagulant signalling mechanisms in lung inflammation and fibrosis:novel opportunities for pharmacological intervention?[J].Br J Pharmacol,2008,153 Suppl 1:S367-S378.
[4]Bogatkevich GS,Ludwicka-Bradley A,Silver RM.Dabigatran,a direct thrombin inhibitor,demonstrates antifibrotic effects on lung fibroblasts[J].Arth Rheum,2009,60(11):3455-3464.
[5]Bogatkevich GS,Ludwicka-Bradley A,Nietert PJ,et al.Antiinflammatory and antifibrotic effects of the oral direct thrombin inhibitor dabigatran etexilate in a murine model of interstitial lung disease[J].Arth Rheum,2011,63(5):1416-1425.
[6]霍雅婷,程远雄,赖文岩,等.Wnt/β-连环蛋白信号通路在诱导气道平滑肌细胞外基质蛋白沉积中的作用[J].重庆医学,2015,44(35):4897-4899.
[7]Phimister EG,Lambrecht BN,Hammad H.Asthma and Coagulation[J].New Engl J Med,2013,369(20):1964-1966.
[8]de Boer JD,Majoor CJ,van T Veer C,et al.Asthma and coagulation[J].Blood,2012,119(14):3236-3244.
[9]Sneeboer MM,Majoor CJ,de Kievit A,et al.Prothrombotic state in patients with severe and prednisolone-dependent asthma[J].J Allergy Clin Immunol,2015,137(6):1727-1732.
[10]赵丹,哈依努尔,克丽别娜·吐尔逊.支气管哮喘患者凝血功能状态的临床分析[J].临床肺科杂志,2013,18(9):1701-1702.
[11]Terada M,Kelly EA,Jarjour NN.Increased thrombin activity after allergen challenge:a potential link to airway remodeling?[J].Am J Respir Crit Care Med,2004,169(3):373-377.
[12]Cicala C,Bucci M,De Dominicis G,et al.Bronchoconstrictor effect of thrombin and thrombin receptor activating peptide in guinea-pigs in vivo[J].Br J Pharmacol,1999,126(2):478-484.
[13]Lin CC,Shyr MH,Chien CS,et al.Thrombin-stimulated cell proliferation mediated through activation of Ras/Raf/MEK/MAPK pathway in canine cultured tracheal smooth muscle cells[J].Cell Signal,2002,14(3):265-275.
[14]Chen B,Soto AG,Coronel LJ,et al.Characterization of thrombin-bound dabigatran effects on protease-activated receptor-1 expression and signaling in vitro[J].Mol Pharmacol,2015,88(1):95-105.
[15]Monagle K,Ryan A,Hepponstall M,et al.Inhalational use of antithrombotics in humans:Review of the literature[J].Throm Res,2015,136(6):1059-1066.
[16]Scaglione F.New oral anticoagulants:comparative pharmacology with vitamin K antagonists[J].Clin Pharm,2013,52(2):69-82.
Influence of dabigatran on thrombin induced contraction and proliferation of human airway smooth muscle cells*
YaoZhihui1,ChengYuanxiong1△,LaiWenyan2,CaiKaican3
(1.DepartmentofRespiration;2.DepartmentofCardiology;3.DepartmentofCardiothoracicSurgery,NanfangHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510515,China)
Objective To investigate the effects of dabigatran on thrombin-induced contraction and proliferation of human airway smooth muscle (HASM) cells.Methods The primary cultured human bronchial smooth muscle cells were used in this experiment.The immunofluorescence method was used to observe the morphological changes of HASM cells contraction,and the α-actin protein relative expression was analyzed by Western blot.The proliferation ability of HASM cells was assessed by cck8 assay.Results Dabigatran could significantly inhibit the thrombin induced HASM cytoskeleton reorganization and α-actin protein expression (P<0.05).In addition,in the comparison of the stimulated proliferation ability of HASM cells among AngⅡ,TGF-β1,PDGF,and Mch and thrombin,thrombin was stronger than AngⅡ,and was second to the 10%FBS (P<0.05).Moreover,thrombin-induced HASM cell proliferation was inhibited by dabigatran in a concentration-dependent and time-dependent manners (P<0.05).Conclusion Dabigatran can significantly inhibit the contraction and proliferation of HASM cells induced by thrombin.
smooth muscle cells;thrombin;dabigatran;ngiotensinⅡ;transforming growth factor-β
10.3969/j.issn.1671-8348.2016.31.001
广东省自然科学基金资助项目(s2012010009036);南方医院院长基金资助项目(2014A001)。
姚智慧(1988-),硕士,住院医师,主要从事哮喘气道重塑方面的研究。△
,E-mail:drchengyx@qq.com。
R541.75
A
1671-8348(2016)31-4321-03
2016-02-18
2016-06-06)



