曾韫璟,高 力,张 曦,孔佩艳,刘 耀,刘 红,曾东风,彭贤贵
(第三军医大学新桥医院全军血液病中心,重庆 400037)
·经验交流·
重庆市首例CAR-T细胞治疗难治性急性B淋巴细胞白血病并文献复习
曾韫璟,高 力△,张 曦,孔佩艳,刘 耀,刘 红,曾东风,彭贤贵
(第三军医大学新桥医院全军血液病中心,重庆 400037)
目的 观察重庆市首例嵌合抗原受体T细胞(CAR-T)治疗复发难治性急性B淋巴细胞白血病的效果并文献复习。方法 60岁女性患者,2014年9月以“活动后乏力、皮肤紫癜”起病,2014年11月在该院确诊为急性B淋巴细胞白血病,多次联合化疗未达完全缓解,骨髓原幼淋巴细胞在75%~88%。2015年4月2日行外周血淋巴细胞单采、培养,2015年4月11日,予氟达拉滨40 mg(第1~3天)+环磷酰胺300 mg(第1~2天)、400 mg(第3天)方案预处理。2015年4月16日输注培养后的嵌合CD19抗原受体T细胞1×106/kg。结果 输注30 d后骨髓细胞学为完全缓解,微小残留病阴性。第60天骨髓检查发现白血病复发;流式免疫分型提示白血病细胞不表达CD19。输注嵌合CD19抗原受体T细胞第6天患者出现发热、血压下降等炎性因子释放综合征表现,经对症处理后好转。结论 CAR-T细胞治疗技术是治疗难治复发CD19抗原阳性急性淋巴细胞白血病的有效方法,能够降低耐药患者体内肿瘤负荷,甚至达到完全缓解,但白血病复发的问题任然存在,部分复发病例出现CD19抗原缺失。
嵌合抗原受体T细胞;细胞治疗;白血病, 双表型, 急性
嵌合抗原受体T细胞(chimericantigen receptor T cells,CAR-T cells)治疗技术是目前最先进的免疫细胞治疗技术,国外也是近两年才成热点。复发难治性白血病是临床面临的一大挑战,是白血病患者死亡的主要原因,严重制约白血病疗效。近年来,尝试CAR-T治疗难治性B淋巴细胞来源血液肿瘤,取得了令人振奋的疗效,对于复发难治性急性B淋巴细胞白血病,完全缓解率甚至可达70%~90%[1-3]。但目前尚无专门针对CAR-T细胞治疗后复发率、复发患者特征及挽救治疗方法的大宗病例研究。本科室在重庆市首次采用嵌合CD19抗原受体T细胞这一国际先进技术治疗复发难治性急性B淋巴细胞白血病,现报道如下。
1 资料与方法
1.1 一般资料 患者,女,年龄60岁,2014年9月以“活动后乏力、皮肤紫癜”起病,2014年11月血常规:白细胞3.11×109/L,血红蛋白88 g/L,血小板15×109/L。流式免疫分型CD10+/CD20+/CD22+/CD19+/CD79a+/CD38+/HLA-DR+;白血病相关基因:BCR-ABL、MLL-AF4、SIL-TAL1、E2A-PBX1、E2A-HLF、HOX11、HOX12、CAML-AF10均为阴性;染色体核型:46,XX(5)/48,XX,+4,dic(7)(q11;q34),+9,16q+(5);明确诊断为急性淋巴细胞白血病。先后给予长春地辛+吡柔比星+培门冬酶+泼尼松方案1疗程,环磷酰胺+中剂量阿糖胞苷+硫唑嘌呤1疗程,环磷酰胺+吡柔比星+长春地辛+地塞米松+大剂量甲氨蝶呤方案1疗程,环磷酰胺+长春地辛+依托泊苷+培门冬酶+泼尼松方案1疗程化疗,多次复查骨髓细胞学均未达完全缓解,原幼淋巴细胞在75%~88%范围。2015年4月9日骨髓细胞学提示增生明显活跃,淋巴细胞异常增生占95.5%,原始+幼稚淋巴细胞占77%。流式细胞学检查:CD19+/CD34-/CD10+/CD38-/CD20+细胞占66.4%。
1.2 方法 患者于2015年4月2日行外周血淋巴细胞单采,共采集淋巴细胞4.88×109个。采集物流式微小残留病(MRD)检查无白血病克隆,淋巴细胞于体外进行分选、培养和转染。2015年4月11日,给予氟达拉滨40 mg(第1~3天)+环磷酰胺300 mg(第1~2天)、400 mg(第3天)方案预处理。预处理结束后(2015年4月15日)复查骨穿刺:骨髓增生活跃,淋巴细胞异常增生占90%,原始+幼稚淋巴细胞占88%;骨髓细胞流式:CD19+/CD34-/CD10+/CD38-/CD20+细胞占60.1%。2015年4月16日输注培养后的嵌合CD19抗原受体T细胞1×106/kg。输注后第7、14、30、60天复查骨髓细胞学,隔日复查血常规、炎性标志物[C反应蛋白(CRP)、白细胞介素-6(IL-6)、肿瘤坏死因子2(TNF2)],根据病情需要复查肝功能、肾功能、免疫球蛋白、EB病毒、巨细胞病毒、淋巴细胞亚群等指标;每天监测患者生命体征。
2 结 果
2.1 骨髓细胞学输注CAR-T后第7天 骨髓增生活跃,淋巴细胞占23%,原始+幼稚淋巴细胞占18%。输注第14天:骨髓增生降低,淋巴细胞占20%,幼稚淋巴细胞偶见;组织细胞有吞噬血小板及颗粒现象。输注第30天:骨髓增生活跃,淋巴细胞占16%,形态正常,达完全缓解。输注第60天:骨髓增生明显活跃,淋巴细胞异常增生占75%,原始+幼稚淋巴细胞占75%。
2.2 骨髓流式细胞检测输注第7天 CD19+/CD34-/CD10+/CD38-/CD20+细胞占8.6%。输注第30天:CD19+/CD34-/CD10+/CD38-/CD20+细胞为0。输注第60天:可见异常B淋巴细胞,CD19-/CD10+/CD34+/CD20-/CD38+/CD45-,占74.7%。
2.3 造血恢复情况 白细胞、血小板变化情况见表1。
2.4 并发症 输注后第62天患者出现双下肢肌肉酸痛,间断发热,体温波动在37.4~37.8 ℃,炎性标志物水平明显升高(图1) 输注后第71天患者下肢肌肉痛缓解,但体温高峰达39.6 ℃,并出现血压下降至80/40 mm Hg。给予补液、多巴胺持续静脉滴注升血压治疗后患者体温下降,血压可维持在正常范围,炎性因子水平逐渐下降,输注后第12天起缓慢减撤多巴胺使用。患者发热期间多次抽取血液进行细菌培养、真菌培养,均为阴性;CAR-T输注后多次巨细胞病毒和EB病毒核酸检查均阴性。
2.5 体内CAR-T数量(占外周血单核细胞比例) 输注后第7天为0.37%;第16天为2.16%;第29天为1.10%。
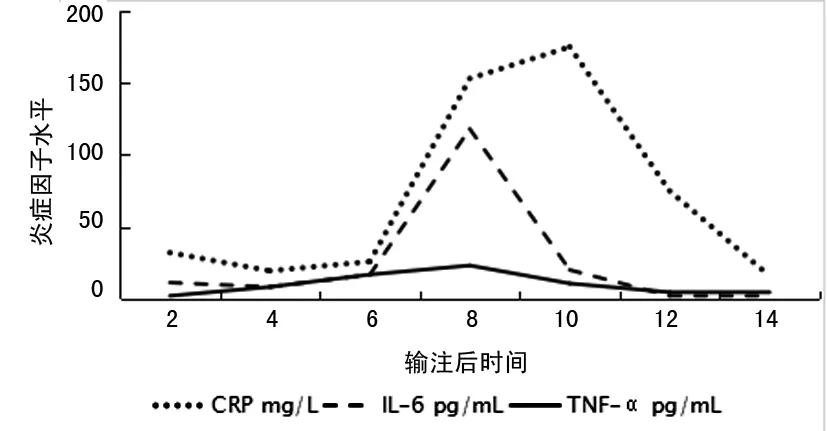
图1 炎症因子变化情况
3 讨 论
CAR-T是将靶抗原受体基因片段通过基因工程技术,转导到正常T细胞基因序列中的具有靶向杀伤功能的T淋巴细胞;其杀伤作用不依赖于主要组织相容性复合体,无须抗原呈递、双信号系统激活、共刺激作用,所以能规避大多数肿瘤耐药和免疫逃逸机制,直接杀伤肿瘤细胞[4]。其中研究最多、技术最成熟的是嵌合CD19抗原受体T细胞治疗B淋巴细胞肿瘤,2013年就有相关报道[5-6]。2014年3个较大样本临床试验显示嵌合CD19抗原受体T细胞治疗复发难治性急性淋巴细胞白血病完全缓解率达70%~90%[1,2,7]。本例老年患者,初诊有复杂染色体核型异常,多次化疗未缓解,为难治性白血病。因此,本科室启动了重庆市首例嵌合CD19抗原受体T细胞治疗,治疗后30 d流式微小残留病(MRD)转阴,显示了良好疗效。
CAR-T治疗主要并发症包括重症感染、炎性因子释放综合征(cytokine release syndrome,CRS)和神经毒性[6,8]。本例患者输注后第7、14、30天外周血流式检测CD19+细胞均为0,由于输注免疫球蛋白及预防性抗病毒治疗,全程层流床保护隔离,故未感染。输注第6天患者出现肌肉酸痛、发热、血压下降,CRP、IL-6明显升高,为1级CRS,未使用托珠单抗和激素,对症处理后好转。
CAR-T细胞治疗后仍面临复发,复发时间与复发率和细胞培养方法、后续治疗、疾病类型等相关。CAR-T输注后给予后续治疗的患者有较长的无病生存时间[9]。本例患者在CAR-T细胞输注后第30天流式MRD检测无CD19+白血病细胞,因造血恢复欠佳未予后续化疗,建议行异基因造血干细胞移植。但输注后第60天骨髓细胞学原始+幼稚淋巴细胞占75%,流式提示复发白血病细胞CD19为阴性。
CD19阴性克隆复发在CAR-T细胞治疗中偶有报道,也见于Blinatumomab治疗后的急性B淋巴细胞白血病患者[10]。可能是疾病早期即存在少量CD19-克隆,CD19+克隆被CAR-T清除后,CD19-克隆增殖导致复发。减少CAR-T治疗后CD19阴性克隆复发的策略有:(1)嵌合多种抗原受体的T细胞:除CD19抗原受体外,还可同时表达CD22、CD23、ROR1等B细胞抗原受体,提高CAR-T对肿瘤细胞的特异性结合及杀伤能力[11];(2)TRUCK T:可诱导释放IL-12,起到趋化其他免疫细胞(如NK细胞和巨噬细胞)杀伤肿瘤细胞的作用;(3)供者来源CAR-T: 除针对性地杀伤表达靶抗原的肿瘤细胞,供者来源的未转染T细胞还能清除受者丢失了CD19抗原的肿瘤细胞,可防止因肿瘤抗原逃逸导致的复发。
虽然现在CAR-T治疗尚不能取代造血干细胞移植,但其能降低耐药患者的肿瘤负荷,甚至达到完全缓解,可作为异基因造血干细胞移植前的桥接治疗,或移植后复发耐药患者的挽救治疗。此外,对于CAR-T输注的时间、次数、数量等问题也需要更多的临床研究来回答。
[1]Davila ML,Riviere I,Wang X,et al.Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J].Sci Transl Med,2014,6(224):224-225.
[2]Lee DW,Kochenderfer JN,Stetler-Stevenson M,et al.T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults:a phase 1 dose-escalation trial[J].Lancet,2015,385(9967):517-528.
[3]Maude SL,Teachey DT,Porter DL,et al.CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia[J].Blood,2015,125(26):4017-4023.
[4]Maude S,Barrett DM.Current status of chimeric antigen receptor therapy for haematological malignancies[J].Br J Haematol,2016,172(1):11-22.
[5]Grupp SA,Kalos M,Barrett D,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J].N Engl J Med,2013,368(16):1509-1518.
[6]Brentjens RJ,Riviere I,Park JH,et al.Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J].Blood,2011,118(18):4817-4828.
[7]Maude SL,Frey N,Shaw PA,et al.Chimeric antigen receptor T cells for sustained remissions in leukemia[J].N Engl J Med,2014,371(16):1507-1517.
[8]Carpenter RO,Evbuomwan MO,Pittaluga S,et al.B-cell maturation antigen is a promising target for adoptive T-cell therapy of multiple myeloma[J].Clin Cancer Res,2013,19(8):2048-2060.
[9]Ghorashian S,Pule M,Amrolia P.CD19 chimeric antigen receptor T cell therapy for haematological malignancies[J].Br J Haematol,2015,169(4):463-478.
[10]Portell CA,Wenzell CM,Advani AS.Clinical and pharmacologic aspects of blinatumomab in the treatment of B-cell acute lymphoblastic leukemia[J].Clin Pharmacol,2013,5(Suppl 1):5-11.
[11]Fedorov VD,Sadelain M,Kloss CC.Novel approaches to enhance the specificity and safety of engineered T cells[J].Cancer J,2014,20(2):160-165.
曾韫璟(1982-),主治医师,硕士,主要从事造血微环境、造血干细胞移植相关研究。△
,E-mail:1575423600@qq.com。
10.3969/j.issn.1671-8348.2017.06.037
R457.2;R733.7
B
1671-8348(2017)06-0834-03
2016-10-03
2016-11-02)



