董显燕,钟 涛,黄郁波,易 玲,曾海江,钟小梅
(江西省赣州市人民医院/南昌大学附属赣州医院儿科 341000)
论着·临床研究
血清25-羟维生素D与过敏性紫癜发病风险关系的病例对照研究
董显燕,钟 涛,黄郁波,易 玲,曾海江,钟小梅
(江西省赣州市人民医院/南昌大学附属赣州医院儿科 341000)
目的 探讨人体血清25-羟维生素D[25(OH)D]与过敏性紫癜(HSP)发病风险的关系。方法 采用酶联免疫吸附法检测53例HSP患者和161例随机对照儿童血清25(OH)D水平,并采用调查问卷收集研究对象基本资料。以214例研究对象的25(OH)D水平四分位数为依据将其分为4个区间,用Logistic回归模型评价各区间血清25(OH)D水平与HSP发病风险的关联程度。结果 病例组血清25(OH)D水平中位数为11.40 ng/mL,对照组为15.36 ng/mL,两组差异有统计学意义(P<0.05)。以最低浓度组即第1区间为参考水平,第2、3、4区间OR值及95%CI分别为0.468(0.341~0.771)、0.442(0.302~0.627)、0.339(0.199~0.501)。采用前进法对性别、抽血季节进行校正,校正后第2、3、4区间OR值及95%CI分别为0.459(0.333~0.741)、0.408(0.317~0.611)、0.387(0.221~0.517),25(OH)D水平的升高与HSP发病风险的下降存在线性相关(P<0.05)。结论 HSP发病风险随血清25(OH)D水平的增高而降低,25(OH)D可能是HSP发病的一项保护因素。
紫癜,过敏性;25-羟维生素D;病例对照研究
过敏性紫癜(henoch-Schonlein purpura,HSP)是以免疫复合物介导的坏死性小血管炎为主要病理改变的全身性疾病[1]。目前,儿童HSP不仅发病愈来愈多,而且重症病例也较以往多见,尽管对HSP的研究已有200多年的历史,但其发病机制至今尚不清楚,因此其病因和发病相关因素受到普遍关注。维生素D(VitD)是人体必需的脂溶性维生素,通过作用于细胞中维生素D受体(VDR)发挥生物学作用,25-羟维生素D[25(OH)D]是VitD的活性形式,近年来发现其在免疫调节方面新的重要功能。国内外研究表明,血清VitD水平与幼年特发性关节炎[2]、系统性红斑狼疮(SLE)[3]、类风湿性关节炎(RA)等自身免疫性疾病的发病率呈负相关,VitD及其代谢产物与疾病的发生、发展有密切关系。本研究应用病例对照研究探讨25(OH)D和HSP发病风险的关系。
1 资料与方法
1.1 一般资料 2013年9月至2015年9月在本科确诊的HSP住院患儿53例为病例组。所有患儿均符合诊断标准,诊断标准参照儿童HSP诊疗指南解读[5]。对照组161例为同期无免疫系统疾病的门诊或住院患者。所有病例采用统一的调查问卷收集与本研究相关的信息包括身高、体质量、抽血时间等。本研究获得了医院医学伦理委员会批准且所有患者均签署了知情同意书。两组病例在性别、年龄、身高、体质量、抽血时间等方面差异均无统计学意义(P>0.05),见表1。
1.2 方法 血清25(OH)D水平的检测:病例组在入院当天、对照组在就诊时抽取静脉血2 mL,离心3 min,收集分离血清置-70 ℃冰箱保存。两组血清25(OH)D水平检测采用罗氏E17O电化学发光免疫分析仪,试剂盒均来自罗氏诊断有限公司,严格按照试剂盒说明书操作。
2 结 果
2.1 基本情况 共纳入研究对象214例,研究对象25(OH)D水平的第1、4分位数、第2、4分位数、第3、4分位数分别为11.00、13.24、18.48 ng/mL,病例组血清25(OH)D水平中位数为11.4 ng/mL,对照组为15.36 ng/mL,两组差异有统计学意义(P<0.05)。年龄、性别、体质量、抽血季节的差异均无统计学意义(P>0.05 ),见表2。
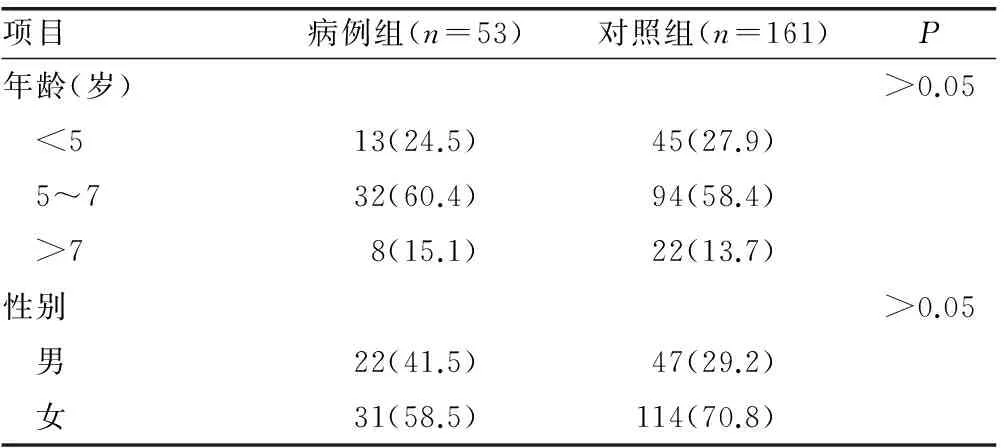
表1 两组基本资料比较
2.2 不同变量中25(OH)D水平分布及对比 性别和抽血季节组间25(OH)D水平比较,差异均有统计学意义(均P<0.05);体质量组间差异无统计学意义(均P>0.05),见表3。
2.3 25(OH)D水平与HSP发病Logistic回归分析 将25(OH)D水平按照四分位数从低到高将研究对象分为 1、2、3、4共4个区间,各变量赋值情况见表3,以最低水平组即第1区间为参考水平,第2、3、4区间OR值及95%CI分别0.468(0.341~0.771)、0.442(0.302~0.627)、0.339(0.199~0.501)。采用前进法对性别、抽血季节进行校正,校正后第2、3、4区间OR及95%CI分别为0.459(0.333~0.741)、0.408(0.317~0.611)、0.387(0.221~0.517),25(OH)D水平的升高与CD发病风险的下降存在线性关(P<0.05),见表4、5。
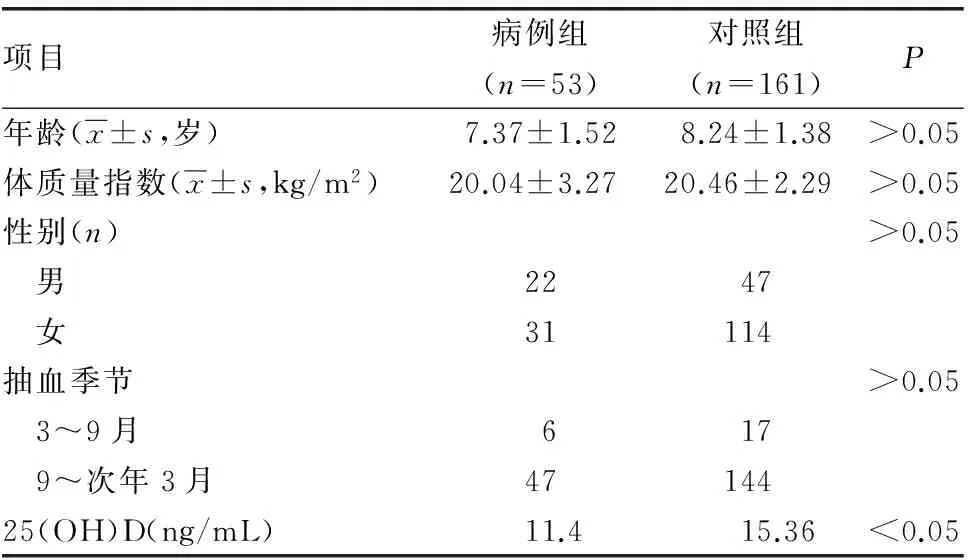
表2 两组基本情况比较
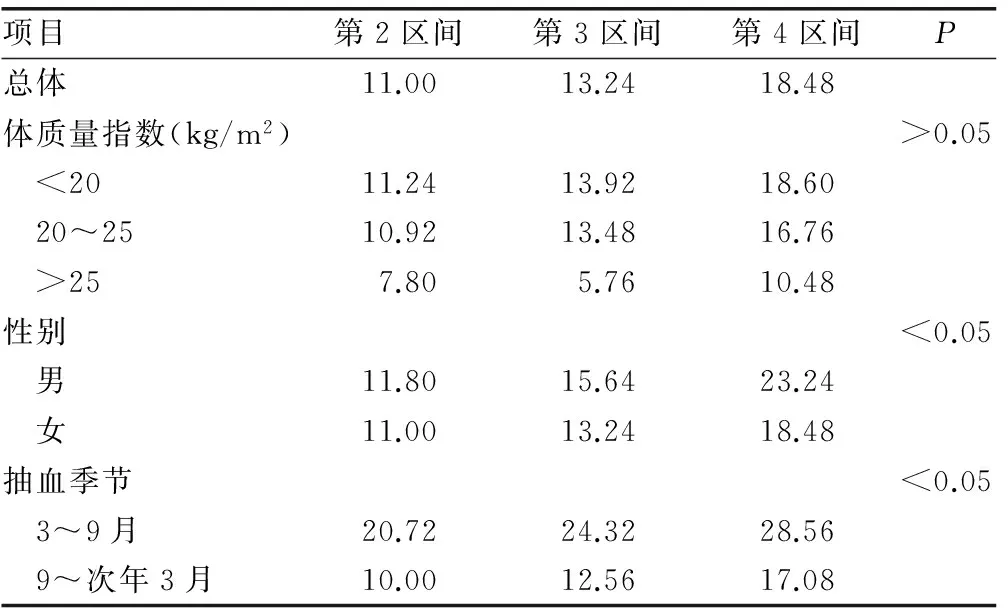
表3 25(OH)D水平在不同变量中的分布(ng/mL)

表4 Logistic回归模型中各变量赋值情况
Y:因变量;X:自变量。
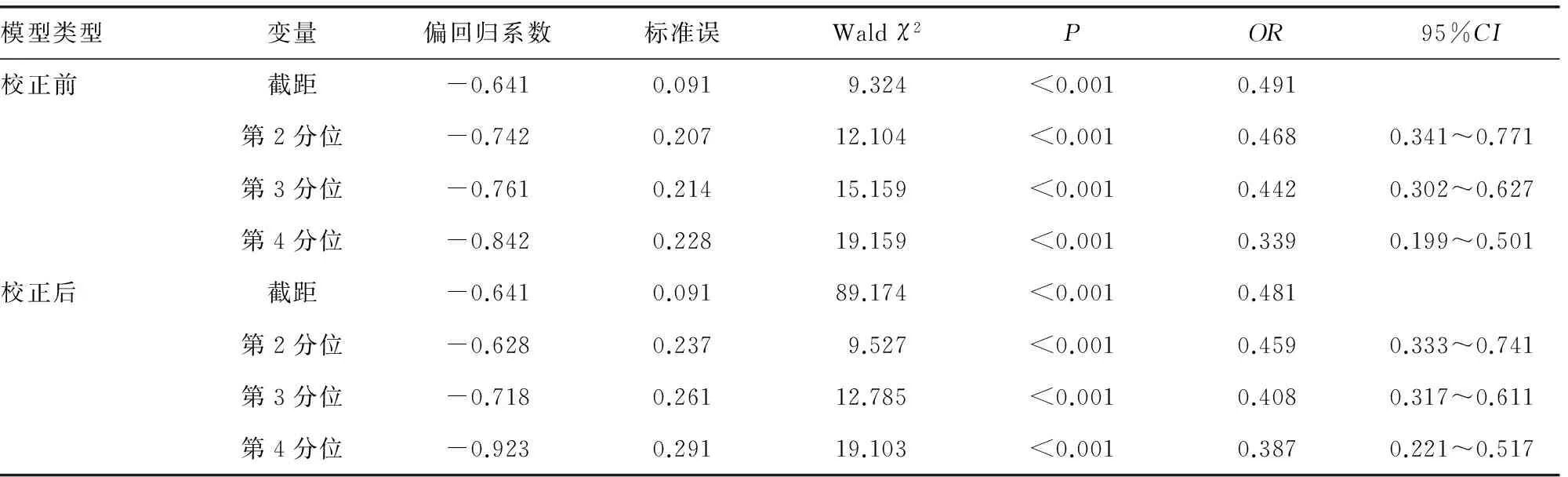
表5 校正后25(OH)D水平与HSP发病风险Logistic回归分析
3 讨 论
HSP是儿童时期最常见、发病率最高的一种自身免疫性血管炎,多发于学龄期儿童,临床特征以非血小板减少性紫癜、关节炎/关节痛、腹痛、胃肠道出血及肾损害为主[5]。目前对HSP的主要致病机制研究已取得一定进展,但其确切的发病机制仍不明了,认为病因可能涉及感染、免疫紊乱、遗传等因素,其发病机制以IgA介导的体液免疫异常为主,IgAI沉积于小血管壁引起的自身炎性反应和组织损伤在HSP发病中起重要作用,细胞功能改变、细胞因子和炎症介质的参与、凝血与纤溶机制紊乱、易感基因等因素在HSP发病中也起着重要作用[6]。VitD是一类脂溶性维生素,属固醇类衍生物,是包括人类在内的高等动物生命必需的重要营养素,是维持人体健康发育必不可少的物质[7-8]。VitD受体广泛存在于多种组织细胞中,如骨骼肌细胞、血管内皮细胞、免疫细胞等,表明VitD除参与骨骼代谢外,还有其他更为广泛的骨外生物学效应,如调节免疫。研究表明,VitD被广泛关注,正是由于其在一些慢性疾病中的重要作用,尤其是自身免疫性疾病[9]。焦卓敏等[10]研究发现VitD通过改变和刺激分子表达、增加调节性T 细胞(Treg)的比例以及增强IL-4 的分泌能力抑制多发性硬化相关自身免疫反应。进一步研究表明,VitD通过调节被激活的T淋巴细胞向Th2细胞分化并产生细胞因子、抑制T淋巴细胞凋亡[11]。HSP患儿存在免疫调节异常,包括T淋巴细胞亚群、炎性因子和趋化因子比例失调等,HSP血管炎症可能与VitD及其相关分子有密切关系[12]。
本研究应用采用酶联免疫吸附法检测患儿外周血25(OH)D水平,发现与健康儿童相比,HSP患儿25(OH)D水平明显减低。郭桂梅等[13]通过对HSP患儿趋化因子的研究发现HSP患儿存在单核细胞趋化蛋白-1(MCP-1)和IL-8的过量表达。同时通过对VitD的研究发现VitD可下调Toll样受体4信号,抑制其下游炎性因子及趋化因子的表达[14]。由此笔者认为,引起血管壁炎症性破坏的原因是由于25(OH)D合成减少,趋化因子及其受体表达增加,引起下游炎性介质的释放。
本研究还发现,HSP男性患儿与HSP女性患儿相比较,HSP男性患儿25(OH)D水平明显减低,二者比较差异有统计学意义(P<0.05)。这与方湘玲等[15]对236例HSP患儿的临床分析一致,其发现HSP男性儿童患病率较女性儿童患病率高。这与儿童生长发育规律有关,女性儿童发育较男性儿童较早,对25(OH)D的吸收及转运较男性儿童好,更不容易引起VitD缺乏。试验组与对照组性别比例对试验结果的影响有待进一步收集实验组大样本研究。
VitD主要来源为通过日光照射,皮肤7-脱氢胆固醇转化而来,故VitD的缺乏与季节及地理位置有关[16-17]。在本研究中,冬春季节患儿25(OH)D水平显着低于夏秋季节,进一步证实了这一点。究其原因,冬季或处于较高纬度时,人体暴露在阳光下的时间减少,从而使VitD的合成减少[19]。对HSP进行流行病学调查结果也显示HSP发病季节以当年9月至次年3月为发病高峰。对HSP发病和25(OH)D水平进行Logistic回归分析,将性别、抽血季节等状况进行校正,各区间OR均小于1,拟合优度检验结果显示该模型拟合效果较好,趋势性检验结果显示HSP发病风险与25(OH)D浓度存在线性相关关系,说明随着体内25(OH)D水平的增高,人群发病风险降低,25(OH)D水平可能是HSP发生的保护因素。本研究也存在不足之处,首先病例对照研究固有的缺陷使本研究不能阐明HSP发病与25(OH)D水平的因果关系,其次对于HSP各种亚型与25(OH)D之间的关系尚有待进一步研究。
综上所述,HSP患儿存在25(OH)D 水平缺乏或不足,低水平25(OH)D与HSP的发生有一定相关性,推测补充VitD可能有助于疾病的预防及恢复。鉴于本研究是HSP发病相关因素的探索性研究,所得结论是否适用于其他地区和不同人群,以及年龄层次对结果是否有影响,均尚有待进行大样本多中心的研究。
[1]丁云峰,李志辉,吴天慧,等.儿童过敏性紫癜伴胰腺损害的临床特征[J].中华实用儿科临床杂志,2013,28(7):525-527.
[2]王颖,卢美萍等.维生素D含量与幼年特发性关节炎的关系[J].中国当代儿科杂志,2015,17(4):375-378.
[3]Iruretagoyena M,Hirigoyen D,Naves R,et al.Immune response modulation by Vitamin D:role in systemic lupus erythematosus[J].Front Immunol,2015,12(6):513-520.
[4]黎书,王峥.儿童过敏性紫癜诊疗指南解读[J/CD].中华妇幼临床医学杂志(电子版),2014,10(6):733-736.
[5]Kawasaki Y.The pathogenesis and treatment of pediatric Henoch-schonlein purpumnephritis[J].Clin Exp Nephml,2011,15(5):648-657.
[6]Lau KK,Suzuki H,Novak J,et al.Pathogenesis of henoch.SchSnleinpurpura nephritis[J].Pediatr Nephrol,2010(25):19-26.
[7]Nisar MK,Masood F,Cookson P,et al.What do we know about juvenile idiopathic arthritis and vitamin D? A systematic literature review and meta-analysis of current evidence[J].Clin Rheumatol,2013,32(6):729-734.
[8]王晓燕,金春华,吴建新,等.血清25-羟维生素D在佝偻病诊断中的应用价值[J].中国当代儿科杂志,2012,14(10):767-770.
[9]Cutolo M.Further emergent evidence for the vitamin D endocrine system involvement in autoimmune rheumatic disease risk and prognosis[J].Ann Rheum Dis,2013,72(4):473-475.
[10]焦卓敏,富羽弘,张凤,等.1,25二羟基维生素D3缓解急性实验性自身免疫性脑脊髓炎的机制[J].中华神经科杂志,2008,88(33):2350-2354.
[11]Guo J,Ma Z,Ma Q,et al.1,25(OH)D Inhibits hepatocellular carcinoma development through reducing secretion of inflammatory cytokines from immunocytes[J].Curr Med Chem,2013,20(33):4131-4141.
[12]姜乃可,何红翠,岑岭,等.过敏性紫癜急性期血清中IL-6、IL-8、VEGF水平变化及意义[J].实用临床医药杂志,2013,17(11):116,121.
[13]郭桂梅,何威逊,刘冰,等.紫癜性肾炎患儿单核细胞趋化蛋白-1表达的研究[J].临床儿科杂志,2008,26(8):686-689.
[14]Gambhir V,Kim J,Siddiqui S,et al.Influence of 1,25-dihydroxy vitarainD3 on TLR4 induced activation of antigen presenting cells is dependent on the order of receptor engagement[J].Immunobiology,2011,216(9):988-996.
[15]方湘玲,易着文,党西强,等.儿童过敏性紫癜236例临床分析[J].临床儿科杂志,2006,24(1):46-49.
[16]Ulitsky A,Ananthakrishnan AN,Naik A,et al.Vitamin Ddeficiency in patients with inflammatory bowel disease:association with disease activity and quality of life[J].J Parenter Enteral Nutr,2011,35(3):308-316.
[17]El-Matary W,Sikora S,Spady D.Bone mineral density,vitamin D,and disease activity in children newly diagnosed with inflammatory bowel disease[J].Dig Dis Sci,2011,56(3):825-829.
[18]LaaksoS,Valta H,Verkasalo M,et al.Impaired bone health in inflammatory bowel disease a case.Control study in 80 pediatric patients[J].Caleif Tissue Int,2012,91(2):121-130.
A case-control study on the relationship between serum 25- hydroxy vitamin D and the risk of Henoch-Schonlein purpura
DongXianyan,ZhongTao,HuangYubo,YiLing,ZengHaijiang,ZhongXiaomei
(DepartmentofPediatrics,GanzhouPeople′sHospital&theAffiliatedHospitalofNanchangUniversity,Ganzhou,Jiangxi341000,China)
Objective To explore the relationship between serum 25-hydroxy vitamin D [25(OH)D] concentrations and the risk of Henoch-Schonlein purpura (HSP).Methods A case control study was designed.Serum 25(OH)D concentrations were measured by radioimmunoassay in 214 participants,including 53 HSP patients and 161 status-matched healthy controls.Information concerning demographic data,genetic,background,and environmental exposures was collected using questionnaire.The study participants were divided into four groups according to quartile range of 25(OH)D concentration and logistic regression modeling was used to evaluate the relation with HSP risk by estimating odds ratios(OR)and 95%confidence intervals(CI).Results The HSP group had a significantly lower concentration of 25(OH)D than the control group (the median in the HSP group was 11.4 ng/mL;controls:15.36 ng/mL,P<0.05).When the first interval was set as the reference level,theOR(95%CI)of the second,third,and fourth intervals were:0.468(0.341-0.771),0.442(0.302-0.627),0.339 (0.199-0.501).After adjusting the analysis for the presence of pathogenic related confounding factOR,theOR(95%CI)of the second,third,and fourth intervals were:0.459(0.333-0.741),0.408(0.317-0.611),0.387(0.221-0.517).The 25(OH)D level was inversely correlated with the risk of HSP(P<0.05).Conclusion The risk of HSP was decreased with the increase of serum 25 (OH) D concentration,25 (OH) D may be a protection factor in the pathogenesis of HSP.
purpura schoenlein-henoch;25-hydroxy vitamin D;case-control study
董显燕(1972-),主任医师,本科,主要从事儿童危重病救治工作。
10.3969/j.issn.1671-8348.2017.08.022
R725.9
A
1671-8348(2017)08-1076-03
2016-09-22
2016-12-02)



