刘晓东,刘国艳,王存斌
(天津市北辰医院麻醉科 300400)
全身麻醉(以下简称全麻)苏醒期躁动是指在全麻苏醒期表现出兴奋、躁动及定向障碍状态,以及出现一些不适当行为如无意识的肢体动作、哭喊等[1]。全麻苏醒期躁动极其不利于患者自身健康,对于临床上需要术后安静的手术也造成极大的阻碍[2],可能会引起患者手术切口破裂、血液循环系统紊乱,出现血压、心率升高,严重者可能会出现心血管疾病等[3]。有研究发现,表面全麻手术患者更容易出现苏醒期躁动,尤其对于老年患者,全麻苏醒期躁动会增加其心肺等器官的负荷,甚至引起器官功能紊乱或衰竭[4]。右美托咪定(dexmedetomidine DEX)是一种α2肾上腺素能受体激动剂,具有良好的镇静、镇痛、抗焦虑作用[5],常用于麻醉辅助用药。本研究主要观察DEX对于缓解老年患者全麻膝关节置换术(total knee arthroplasty,TKA)术后苏醒期的疼痛与躁动的作用,为临床上DEX的使用提供一定参考,现报道如下。
1 资料与方法
1.1 一般资料 选择本院2015年1月至2016年1月在全麻下行TKA的老年患者60例,根据随机数字表法将患者分为观察组与对照组,每组30例。观察组:男17例,女13例;年龄60~70岁,平均 (65.71±3.03)岁。对照组:男20例,女10例;年龄60~70岁,平均 (68.71±1.26)岁。60例患者麻醉前根据患者体质状况和对手术危险性进行的美国麻醉师协会(ASA)分级均为Ⅰ~Ⅱ级[6],无重要脏器功能障碍,无精神神经系统疾病,肝、肾功能未见异常,排除严重感染、恶性肿瘤、患有严重心脑血管疾病的患者。患者均知情同意本次研究且签署《知情同意书》,本研究经医院伦理委员会批准。
1.2 方法
1.2.1 麻醉方法及监测 两组患者均无术前用药。入室后连接心电监护仪,对血压、心率、血氧饱和度等指标进行监测,一旦术中出现联合用药等因素导致的心律缓慢、血压下降、心律不齐,立即进行抢救。使用脑电双频指数(BIS)监测麻醉深度。观察组患者静脉泵入0.50 μg/kg DEX溶液20 mL,微泵15 min静脉注射完毕;对照组静脉泵入等容量的生理盐水。麻醉诱导均采用丙泊酚2.00 mg/kg、舒芬太尼0.20~0.30 μg/kg、顺式阿曲库铵2.00 mg/kg静脉注射,待患者意识完全消失后插入3号喉罩,接呼吸机机械通气,潮气量(VT)8~10 mL/kg,呼吸频率12次/分,维持呼气末二氧化碳分压(PETCO2)为35~45 mm Hg。麻醉维持:两组患者持续吸入2%~3%七氟烷,氧流量2 L/min,瑞芬太尼0.10~0.20 μg·kg-1·min-1,间断追加顺式阿曲库铵0.05 mg/kg。两组患者术中均维持BIS 40~60。两组患者均术毕停吸七氟烷,同时调大新鲜气体流量(8 L/min)加快七氟烷洗出。术毕两组患者均静脉注射新斯的明1.00 mg和阿托品0.50 mg拮抗残余肌肉松弛。两组患者均采用术中关节腔内局部注射镇痛药物(即“鸡尾酒治疗法”)及患者自控镇痛(PCA)作为术后镇痛。
1.2.2 观察指标 观察比较两组患者手术时间、苏醒时间、拔管时间、苏醒期躁动及疼痛情况。术后躁动情况采用Riker镇静-躁动评分(sedation agitation seale,SAS)标准:7分,危险躁动;6分,非常躁动;5分,躁动;4分,安静合作;3分,镇静;2分,非常镇静;1分,不能唤醒。当SAS>5分时应通知医生,同时对患者给予镇静药物治疗或应用约束带,以防躁动及相关意外事件的发生[7]。疼痛情况采用视觉模拟评分(visual analogue scale/score,VAS)评价,评分标准:0分为无痛,10分为难以忍受的最剧烈的疼痛[8]。
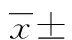
2 结 果
2.1 两组患者术后恢复情况比较 两组患者的手术时间、自主呼吸时间、睁眼时间比较,差异无统计学意义(P>0.05),见表1。
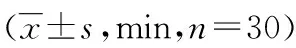
表1 两组患者术后恢复情况比较
2.2 两组患者苏醒期疼痛及躁动情况比较 观察组中无SAS>5分的患者,对照组有3例患者的SAS>5分,两组比较差异有统计学意义(P<0.05)。观察组患者麻醉苏醒期安静、合作,能进行良好的沟通,在苏醒期自主通气良好,且苏醒期疼痛情况和躁动情况明显少于对照组 (P<0.05)。两组患者疼痛及躁动相关评分比较见表2。
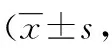
表2 两组患者疼痛及躁动相关评分比较分,n=30)
3 讨 论
全麻患者在苏醒期躁动由于患者意识和行为分离而产生的一种精神状态,患者全麻术后苏醒期躁动的原因可能与患者年龄、术前用药、手术类型、手术时间、内环境紊乱、麻醉用药的残留作用、切口疼痛及术后各种不良刺激等因素有关[2,4]。研究表明,全麻后患者的苏醒期躁动发生率较高,可能因为虽然麻醉药物中枢性抑制作用消失,但仍有部分残留药物发挥作用,影响大脑皮层和上行网状激活系统,导致患者兴奋、躁动和定向障碍等情况发生[9]。
DEX作为α2肾上腺素能受体激动剂,能够高度选择作用于脑干蓝斑核[10],其相关作用机制为:激动中枢突触后及交感神经末梢突触前受体,从而抑制手术操作或麻醉诱导等引发的交感神经兴奋,进而抑制去甲肾上腺素释放,阻断疼痛传导,使交感神经张力下降,发挥镇痛、镇静、抗焦虑等作用[11]。研究表明,DEX通过脊髓背角初级传入神经纤维的突触前膜、抑制神经递质释放的作用机制,可有效抑制躁动症状的发生,从而预防并减轻苏醒期躁动[12]。值得注意的是,由于DEX主要通过肾脏排泄,年老患者的肾功能降低,因此对年老患者应当谨慎选择剂量。65岁以上患者用药后心动过缓和低血压的发生率较高,因此使用本品时需考虑降低剂量,建议以 0.50μg/kg为负荷剂量,而且应输注10min以上[13]。
本研究中观察组患者静脉泵入0.50μg/kgDEX溶液20mL,微泵15min静脉注射完毕;对照组静脉泵入等容量的生理盐水。结果表明,与对照组比较,观察组患者麻醉苏醒期躁动情况发生率及躁动分级低,且在苏醒期自主通气良好,交感神经系统的兴奋性明显降低,苏醒期疼痛情况和躁动情况明显降低,差异有统计学意义(P<0.05)。因此,DEX降低全麻老年TKA术后苏醒期躁动效果明显,对减少术后意外事件,保障患者医疗安全具有积极的意义,值得临床推广。
[1]FREDERICKHJ,WOFFORDK,DELISLEDEARG,etal.Arandomizedcontrolledtrialtodeterminetheeffectofdepthofanesthesiaonemergenceagitationinchildren[J].AnesthAnalg,2016,122(4):1141-1146.
[2]童珊珊,李军,彭春玲,等.麻醉恢复室的成年患者全麻苏醒期躁动危险因素分析[J].重庆医学,2015,44(10):1340-1342.
[3]岳海龙,彭小静.不同剂量右美托咪定减少全麻苏醒期躁动的效果观察[J].中国实用神经疾病杂志,2015,9(24):120-121.
[4]杨荣宽.老年全麻手术苏醒期患者躁动发生状况及其危险因素[J].实用临床医药杂志,2016,20(1):163-165.
[5]李伟光.右美托咪定预防神经外科全麻术后躁动的临床观察[J].医药,2016(10):00227.
[6]李响.美国麻醉医师协会分级在老年肝癌患者外科治疗风险评估中的作用[J].实用老年医学,2015,29(9):755-758.
[7]师利香.Riker镇静躁动评分对脑出血患者麻醉苏醒后躁动的影响[J].当代医学,2015,21(22):93-94.
[8]李雪薇.护理评估在视觉模拟评分中的临床应用[J].现代医药卫生,2016,32(12):1912-1913.
[9]康颖颖,郑学杰.小儿全身麻醉苏醒期躁动的危险因素分析[J].中国农村卫生,2016(12):74-75.
[10]蔡东妙,汪海松,杨华凌.右美托咪定预防神经外科全麻术后躁动的临床研究[J].中国保健营养,2015,25(13):7-8.
[11]孙哲,元元,王国林,等.右美托咪定对瑞芬太尼痛觉过敏的影响及机制研究进展[J].国际麻醉学与复苏杂志,2015,36(5):451-454.
[12]高峰,吴雨佳.右美托咪定对静吸复合麻醉骨折手术患者苏醒期躁动及术后机械痛阈值的影响[J].山东医药,2016.56(28):100-102.
[13]李天佐.右美托咪定在麻醉中的应用[J].北京医学杂志,2010,32(8):587-590.



