张明坤,贾润萍,崔玲玲,叶燕林,孙锦峰,王 玲△
(1.郑州大学公共卫生学院,郑州 450001;2.郑州大学附属第二医院营养科,郑州 450000)
血尿酸(SUA)是机体内嘌呤代谢的产物,SUA水平的高低主要取决于SUA的排泄和产生,二者之间维持着一种动态平衡,以保证SUA处于正常水平。当尿酸(UA)产生过多且又排泄障碍的时候,必然会导致SUA水平升高,引起高尿酸血症(HUA),进一步增加了痛风发生的可能性,严重危害人体健康。在我国经济发达的城市和沿海地区,HUA患病率为5.0%~23.5%[1-4],接近西方发达国家水平[5]。HUA是多种心血管危险因素及相关疾病[代谢综合征(MS)、2型糖尿病、高血压、心血管事件及死亡、慢性肾病等]的独立危险因素[6-7]。SUA 水平升高不仅直接导致高尿酸血症和和痛风的发生,也是各种心脑血管疾病的独立危险因素。近些年研究发现,SUA水平升高是遗传和环境两个方面共同作用的结果,与多种疾病均存在相关性,高血压、糖尿病、肥胖、血脂紊乱等内分泌疾病的发生也常常伴随着SUA水平的升高,而高血压、糖尿病、肥胖、血脂紊乱作为MS的重要组成部分,与SUA水平是否存在关联性尚未有定论。本研究对MS各因素与SUA水平的关系性进行研究,现报道如下。
1 资料与方法
1.1一般资料 采用机械随机抽样的方法,从某医院2013年的体检人群中抽取8 285例作为研究对象,其中男5 109例,年龄(44.28±12.58)岁;女3 176例,年龄(44.36±11.59)岁。MS的诊断标准[3]参考中华医学会糖尿病分会(CDS)[1]:超重和(或)肥胖,BMI≥25 kg/m2;高血压,收缩压(SBP)≥140 mm Hg和(或)舒张压(DBP)≥90 mm Hg;空腹血糖(FPG)≥6.1 mmol/L;血脂紊乱,三酰甘油(TG)≥1.7 mmol/L和(或)高密度脂蛋白胆固醇(HDL-C)<0.9 mmol/L(男)、1.0 mmol/L(女)。上述指标,满足3项及以上者就可以诊断为MS。8 285例调查对象均未服用影响SUA水平的药物。
1.2方法 将研究对象分为MS组和非MS组,又根据CDS对MS的诊断标准和MS因素数量的多少将MS组分为5个亚组,0组为无MS因素异常组,1~4组分别代表有1~4个MS因素异常。由于SUA水平受性别及雌激素水平的影响,在临床HUA的诊断中不同性别也执行不同的诊断标准,SUA≥417 μmol/L(男性)和大于或等于357 μmol/L(女性)为HUA。以性别,是否足以诊断为HUA为依据将所入选的对象分为男性组和女性组,组内又分为HUA亚组和非HUA亚组。在以上试验分组的基础上,对SUA水平与MS及其因素关系进行研究分析。体格检查:使用经校正过的身高和体质量测量计测量身高(m)、体质量(kg),并计算BMI=体质量(kg)/身高(m)2;使用汞柱式标准血压计测量SBP、DBP;实验室检查:8 285例研究对象正常饮食,于次日清晨抽取空腹静脉血。采用日立7600全自动生化分析仪检测SUA、FPG、TG、HDL-C。

2 结 果
2.1一般资料 MS组的年龄、BMI、SBP、DBP、FPG、TG和SUA明显高于非MS组,而HDL-C明显低于非MS组(P<0.05);男性MS发病率高于女性,见表1。

表1 两组一般资料比较
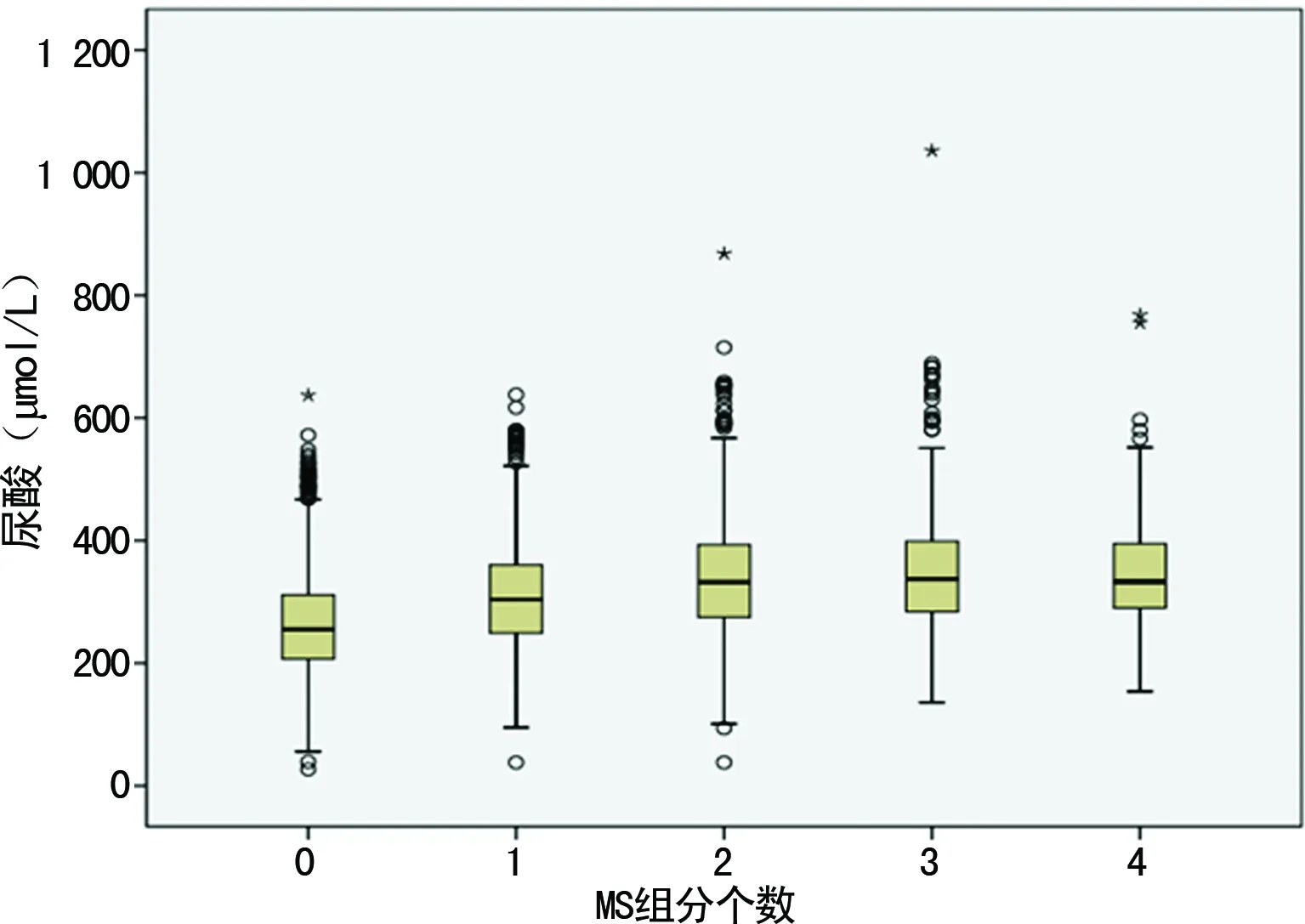
图1 血UA水平与MS因素的关系
2.2SUA与不同MS因素组的相关性 根据CDS对MS诊断标准,通过研究分析发现,包括0、1、2、3、4个MS因素的亚组中SUA分别为255.00(207.00,311.00)、304(249.00,360.00)、322.00(274.50,393.00)、337.00(284.00,399.00)、333.00(289.75,397.25),差异有统计学意义(P<0.05)。随着MS因素的增加,SUA水平总体呈升高趋势,尤其是MS因素为2个以上时,与0、1个MS因素因异常的SUA水平有明显差异(P<0.05),2个以上MS因素间SUA水平比较差异无统计学意义(P>0.05),见表2、图1。

表2 不同数量MS因素组间SUA值的比较(μmol/L)
a:P<0.05,与0组比较;b:P<0.05,与1组比较;c:P<0.05,与2组比较
2.3SUA水平与MS各因素之间的相关关系 用Spearman等级相关分析SUA水平与MS各因素之间的关系,结果表明SUA水平与BMI、SBP、DBP、FPG、TG呈正相关关系,而与HDL-C呈负相关关系(表3)。SUA分布属于非正态分布,按照Z分数转换方法将UA进行正态转化,经过Kolmogorov-Smimov Z检验近似正态分布(Z=0.003,P=0.20)。以Z分数转换后的血UA水平为因变量,BMI、SBP、DBP、FPG、TG、HDL-C为自变量,行多元逐步回归分析。建立回归模型,并经方差分析,按α=0.01水准,可以认为Z分数转换后SUA水平与腹围、DPG、FPG之间有直线关系(F=346.12,P<0.01),建立多元回归线性方程为:Y=-2.135+0.066X1+0.010X2+0.155X3-0.379X4,(Y代表Z分数转化后的SUA浓度,X1代表BMI,X2代表DBP,X3代表TG、X4代表HDL-C),结果显示血SUA水平与BMI、DBP、TG和HDL-C关系更加密切;BMI、DBP、TG与SUA呈正相关,HDL-C与SUA呈负相关。

表3 SUA水平与MS各因素之间的相关关系
2.4UA水平作为MS的危险因素
2.4.1UA水平与MS检出率的关系 不同性别各组MS检出率比较差异有统计学意义(P<0.05),见表4。
2.4.2单因素Logistic回归分析 单因素Logistic回归分析结果显示,SUA水平与MS的发生明显相关(OR=1.007,95%CI0.006~1.007,P<0.05)。
2.4.3ROC曲线 根据有无MS分层,按照SUA水平描绘男女性ROC曲线,计算曲线下面积(AUC)。男性AUC为0.608(95%CI0.582~0.634,P<0.01),女性AUC为0.744(95%CI0.705~0.783,P<0.01),结果显示UA对MS具有较好的诊断价值。确定诊断界点,男性和女性中MS最佳临界诊断点为360.5、256.5,相对应的男性诊断灵敏度为46.49%,特异度为69.94%;女性灵敏度为71.94%,特异度为67.24%,见图2、3。
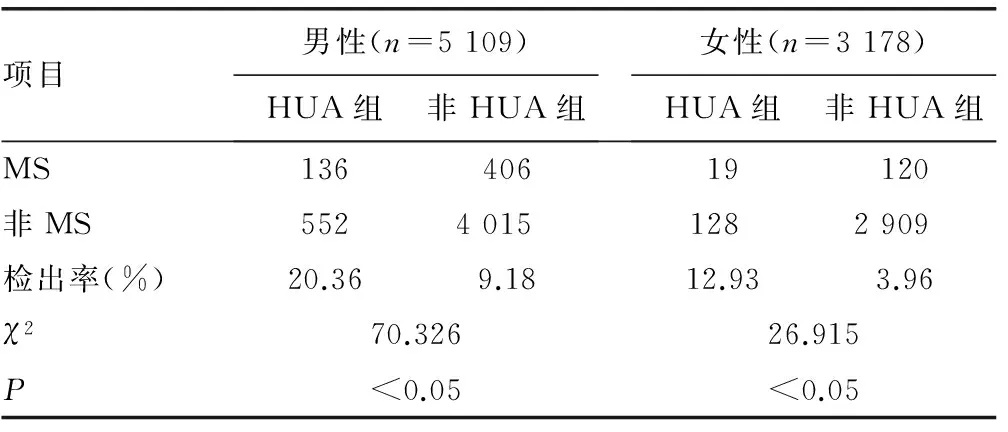
表4 SUA水平与MS检出率的关系
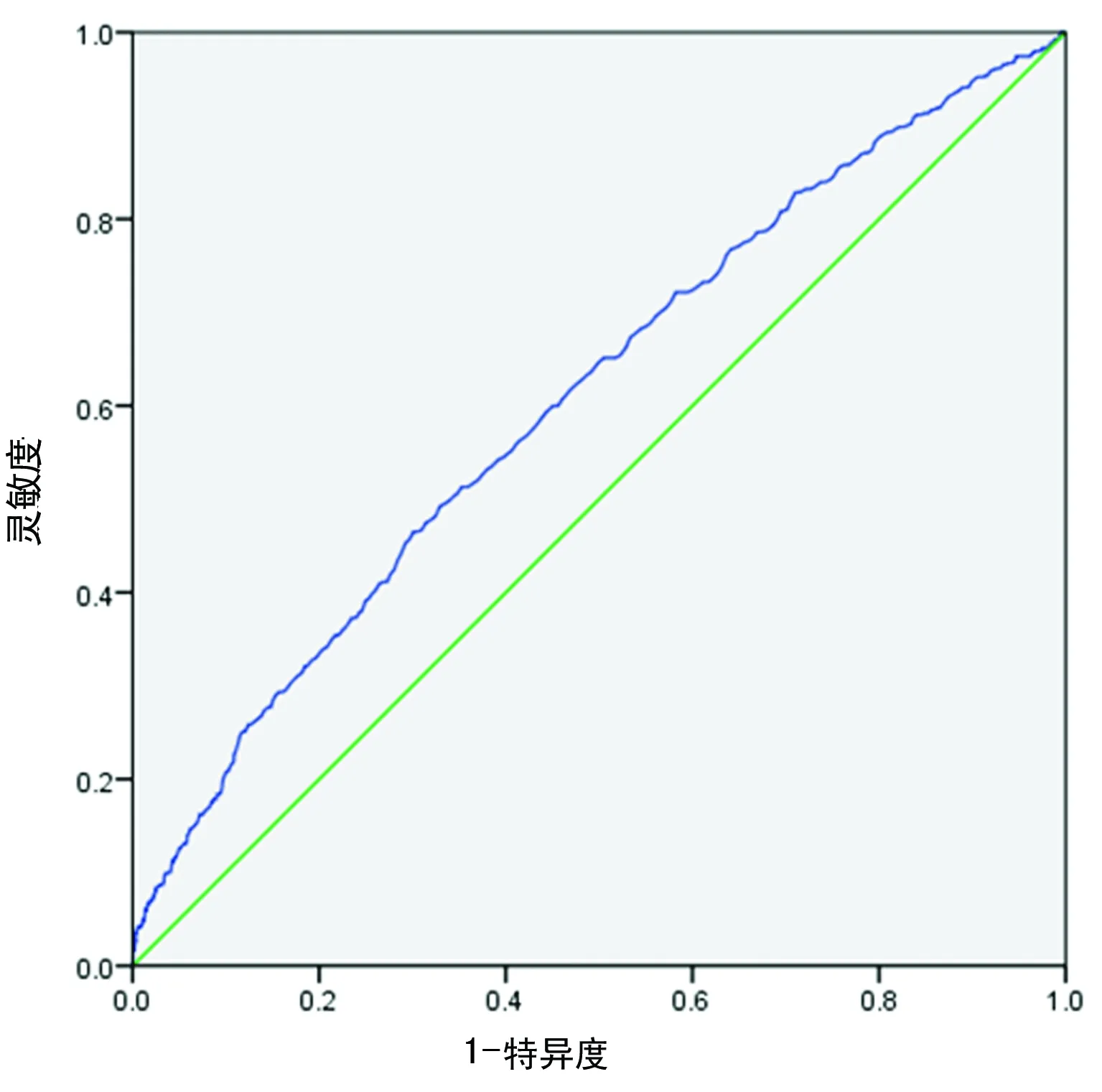
图2 男性MS人群SUA水平的ROC曲线

图3 女性MS人群SUA水平的ROC曲线
3 讨 论
MS指人体的蛋白质、脂肪、碳水化合物等物质发生代谢紊乱,在临床上出现一系列综合征,主要包括肥胖、高血压、血脂异常、高血糖等代谢异常状况。针对MS的研究一直是医学研究重点,针对不同种族人群也有不同的定义和诊断标准,2004年CDS发布了适合中国人的MS诊断标准。随着社会生活方式的重大转型,“富贵病”成了人类一大负担,针对MS研究的宽度及广度都在不断扩展。HUA作为心血管疾病的一个独立危险因素在MS中的作用正引起人们的重视,大量研究表明,HUA是多种代谢性疾病及心血管疾病的独立危险因素,有观点认为高SUA是继高血压、高血脂和高血糖“三高”之后的第4个重要危险指标[8]。HUA是糖尿病发生、发展的独立危险因素,有研究表明,一般人群中SUA水平每增加60 μmol/L,新发糖尿病的风险增加17%[9]。在具有代谢性疾病的患者中,如高血压、肥胖、糖尿病患者,其体内的3-磷酸甘油醛脱氢酶活性降低,影响尿酸的合成,造成HUA发生[10]。HUA可以通过多种方式影响血压水平,SUA结晶沉积于血管内壁,造成血管弹性降低,增加了外周阻力,从而影响血压水平;而血糖、血脂、SUA的相互作用,会加重内皮损伤,导致动脉粥样硬化,血压调节失衡。同时高血压会反过来造成SUA水平升高,高血压使肾小球缺氧,乳酸生成增多,跟UA竞争性排泄,间接导致SUA水平升高。
本研究结果显示,MS组的BMI、SBP、DBP、FPG、TG和SUA水平均高于非MS组,且随着MS因素数量的增加,SUA水平升高;并且HUA组中MS患者明显高于非HUA组。由此可见,SUA水平与MS发生关系密切,回归分析及相关性分析亦表明SUA与MS各因素之间存在相关性。研究发现,随着MS诊断因素的增加,研究对象SUA水平呈上升趋势[11]。临床及试验研究表明,健康人群SUA水平异常不仅引起血管的硬化,同时会引起肾的炎性病变,增加机体对盐分敏感性,对血压水平也有影响[12]。也有研究发现HUA本身就是血脂异常的一种表现[13]。有报道指出腹型的肥胖相较于其他类型的肥胖SUA水平更高[14]。JOHNSON 等[15]的研究发现2型糖尿病易合并HUA可能是因为大部分患者有高胰岛素血症,而胰岛素能促进肾脏对UA的重吸收,从而影响肾脏对UA的排泄而导致SUA水平升高。以上均说明HUA在MS的演变与进展中发挥着重要作用。
综上所述,血UA水平与MS及其因素存在关联性,二者相互作用,加速疾病进展,提示可以利用血UA水平来诊断预测MS,医生应重视对SUA水平的监测,对异常者进行积极有效的干预,预防MS的发生,进而控制心脑血管疾病的进展。
参考文献
[1]王德光,郝丽,戴宏,等.安徽省成人慢性肾脏病流行病学调查[J].中华肾脏病杂志,2012,28(2):101-105.
[2]阎胜利,赵世华,李长贵,等.山东沿海居民高尿酸血症及痛风五年随访研究[J].中华内分泌代谢杂志,2011,27(7):548-552.
[3]周弋,齐慧,赵根明,等.上海市浦东新区居民高尿酸血症与慢性肾病相关性研究[J].中华流行病学杂志,2012,33(4):351-355.
[4]任佳伟.高尿酸血症和痛风的流行病学及其危险因素的研究进展[J].医学信息,2014(24):684.
[5]UK A J,SISKIN P A.Epidemiology of hyperemia and gout[J].Am Manga Care,2005,11(151):435-442.
[6]中华医学会内分泌学分会.高尿酸血症和痛风治疗的中国专家共识[J].中华内分泌代谢杂志,2013,29(11):913-920.
[7]中华医学会糖尿病学分会代谢综合征研究协作组.中华医学会糖尿病学分会关于代谢综合征的建议[J].中国糖尿病杂志,2004,12(3):156-161.
[8]BALDWIN W,MCRAE S,MAREK G,et al.Hyperuricemia as a mediator of the proinflammatory endocrine imbalance in the adipose tissue in a murine model of the metabolic syndrome[J].Diabetes,2011,60(4):1258-1269.
[9]KODAMA S,SAITO K,YACHI Y,et al.Association between serum uric acid and development of type 2 diabetes[J].Diabetes Care,2009,32(9):1737-1742.
[10]张敏,宋秀霞,姜涛.高尿酸血症与代谢综合征的相关性分析[J].中国现代医学杂志,2008,18(5):623-625.
[11]岳桂英.代谢综合征与高尿酸血症的临床处理与再认识[J].实用糖尿病杂志,2003,11(4):10-11.
[12]WATANABE S,KANG D H,FENG L,et al.Uric acid,hominoid evolution,and the pathogenesis of salt-sensitivity[J].Hypertension,2002,40(3):355-360.
[13]LI D X.Hyperuricemia and metabolic syndrome[J].Sec Endoc Foreign Med Sic,2004(11):368-388.
[14]MATSUURA F,YAMASHITA S,NAKAMURA T,et al.Effect of visceral fat accumulation on uric acid metabolism in male obese subjects:visceral fat obesity is linked more closely to overproduction of uric acid than subcutaneous fat obesity [J].Metabolism,1998(47):929-933.
[15]JOHNSON R J,NAKAGAWA T,SANCHEZ-LOZADA L G,et al.Sugar,uric acid,and the etiology of diabetes and obesity[J].Diabetes,2013,62(10):3307-3315.



