王 静,杨立宏
(内蒙古自治区赤峰市医院肾内科 024000)
近年来,肾细胞癌的发病率呈上升趋势,约占肾恶性肿瘤的80%~90%,以及成人实体肿瘤的2%~3%。临床上可通过手术切除治疗肾细胞癌,但是仍有高达30%~40%的患者出现转移或复发[1]。有资料显示,肾癌的高发年龄为40~55岁,以透明肾细胞癌为主,约占肾癌的85%[2]。国内外有些研究表明机体免疫系统调节失衡可能与肾透明细胞癌的发病有关[3-4]。目前肾癌的治疗方法仍在不断的研究中,如靶向药物治疗等,但是很多晚期肿瘤患者未能得到有效解决及治疗。随着科技的发展,关于细胞因子研究越来越多,国内外研究者对于机体免疫反应生理及病理意义认识有了进一步提高。白细胞介素-35(IL-35) 是一种抗炎性细胞因子,能够参与免疫反应调节。IL-35大部分是由T细胞分泌,是T 细胞发挥免疫调节作用的关键细胞因子。许白叶等[5]报道称,IL-35在多种肿瘤组织中存在高表达的情况,能够促进肿瘤组织部位血管增生。本研究对IL-35在肾癌中的表达水平及其与肾癌临床病理特征之间的关系进行分析,现报道如下。
1 资料与方法
1.1一般资料 选取2015年6月至2016年10月间于本院择期行手术治疗的肾透明细胞癌患者60例(肾透明细胞癌组),收集其临床资料,及肿瘤组织和癌旁组织的标本。另取同期于本院健康查体中心行健康查体的50例健康志愿者为对照组。肾透明细胞癌组中男38例,女22例,年龄(53.16±7.92)岁;观察组中男31例,女19例,年龄(52.37±8.57)岁。纳入标准:(1)非透明细胞肾癌及LPRAML诊断符合WHO制定的相关标准;(2)临床资料完善;(3)自愿参加本研究,并签订知情同意书。排除标准:(1)术前接受过内分泌治疗;(2)术前存在急慢性炎症;(3)既往肿瘤病史。本研究已由医院伦理委员会批准。
1.2方法
1.2.1收集和处理标本 全部受试者在接受治疗前均采集空腹时外周静脉血样本5 mL,置于抗凝管中。水平离心机2 500 r/min离心20 min,取上层血清置于 EP 管中保存在-80 ℃。剩余的血液样本加入红细胞裂解液10 mL,反应8 min后2 500 r/min水平离心10 min,分离出外周血单个核细胞,置于2 mL EP管中,加入1 mL TRIzol,-80 ℃保存。收集术中新鲜标本组织,包括肿瘤组织、癌旁组织及正常肾脏组织,储存转运使用液氮罐,置于-80 ℃保存。
1.2.2实验方法
1.2.2.1酶联免疫吸附法(ELISA)检测血清中IL-35水平 使用人IL-35 ELISA 试剂盒检测肾透明细胞癌组及对照组血清中IL-35水平,按照试剂盒说明书检测,所有样本均检测2次取平均值。实际水平计算:以标准品水平为纵坐标,光密度(OD)值为横坐标,绘出标准曲线。由标准曲线查出相应水平,乘以稀释倍数,即为样品的实际水平。
1.2.2.2实时定量PCR方法检测 提取PBMCs及肾组织细胞中总RNA,并将总RNA逆转录为cDNA,并用实时定量PCR测定细胞中IL-35相关的EB病毒诱导基因3(EBI3)及亚基免疫因子53(p35)表达水平。总RNA提取使用RNA提取试剂盒,实时定量PCR引物序列如下,EBI3上游5′-GCTCCCTACGTGCTCAAT-3′,下游5′-CCCTGACGCTTGTAACGG-3′;p35上游5′-TCCTCCCTTGAACCGGAA-3′,下游5′-TGACAACGGTTTGGAGGG-3′。
1.2.2.3免疫荧光染色观察 IL-35在肾癌组织及正常组织中的表达。对肾透明细胞癌组织及正常肾癌组织进行了EBI3及P35的免疫荧光染色,分别为FITC标染抗p35抗体,而RITC标染抗EBI3抗体。

2 结 果
2.1患者临床资料比较 肾透明细胞癌患者平均肿瘤直径为(4.30±2.31)cm;TNM-T分期中T1期 36例,T2期13例,T3期9例,T4期2例;肿瘤分期Ⅰ期37例,Ⅱ期10例,Ⅲ期11例,Ⅳ期2例。两组患者在年龄及性别方面比较差异无统计学意义(P>0.05)。
2.2两组血清IL-35水平比较 肾透明细胞癌组血清中IL-35为(107.52±56.83)pg/mL,对照组为(66.25±17.33)pg/mL,差异有统计学意义(t=5.326,P=0.015)。不同年龄及性别的患者的血清中IL-35水平比较差异无统计学意义(P>0.05),不同肿瘤分期及淋巴结转移患者的IL-35水平比较差异有统计学意义(P<0.01),见表1。

表1 IL-35表达量与肾癌的临床病例特征间的关系

A:两组PBMCs中EBI3及p35的表达量;B:在肾透明细胞癌组织、癌旁组织及正常肾组织的EBI3及p35的表达量
图1 EBI3及p35表达量比较

图2 两组IL-35亚基表达量
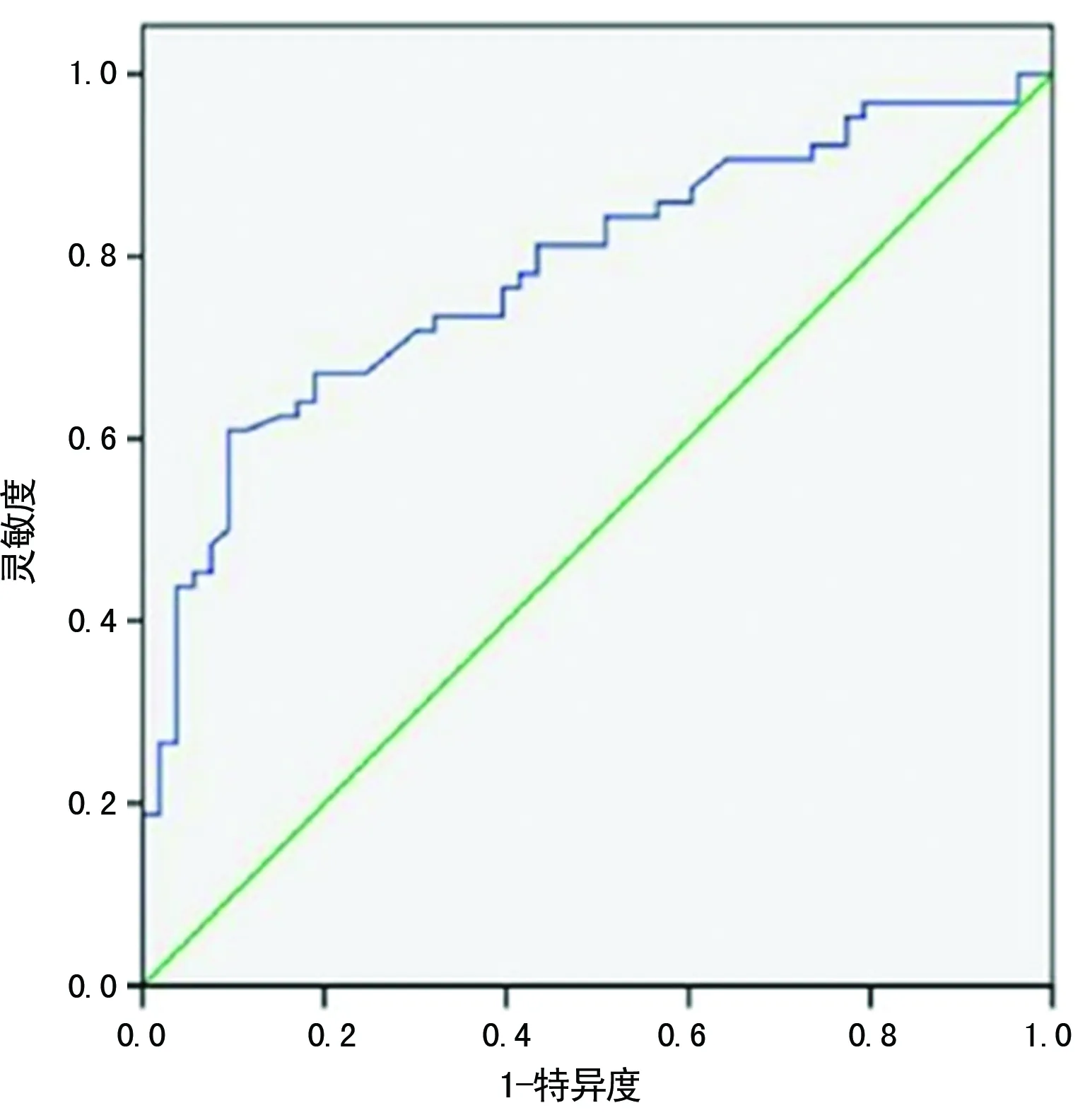
图3 ROC曲线结果
2.3患者mRNA水平上EBI3及p35表达量对比 在mRNA水平上,肾透明细胞癌组PBMCs中EBI3及p35的表达量明显高于对照组。肾癌组织、癌旁组织及正常肾组织之间EBI3及p35的表达量比较,肾癌组织中的EBI3及p35的表达量均明显高于癌旁组织和正常组织,见图1。
2.4两组EBI3及p35表达量对比 EBI3及p35在肾透明细胞癌组中均呈现高表达,明显高于对照组中的表达量,差异有统计学意义(t=18.316,P<0.01),见图2。
2.5肾透明细胞癌组ROC曲线分析结果 最佳截点为IL-35 80.13 pg/mL时,曲线下面积为0.776,在诊断方面,其灵敏度为61.3%,特异度为91.1%,诊断正确率为73.2%,见图3。
3 讨 论
IL-35是一种由p35及EBI3两个亚基组成的免疫抑制细胞因子,由EBI3蛋白和p35亚基组成的异源二聚体,是IL-12家族的新成员[6]。有研究发现IL-35是重要的抗炎因子,对机体的自身免疫疾病及调节移植排斥等方面均发挥着重要作用[7]。国内外关于IL-35与免疫性疾病的相关研究也较多,也比较深入,而与肿瘤的进展相关研究较少。IL-35与多种肿瘤疾病具有相关性,如皮肤黑色素瘤及鼻咽癌等均发现IL-35的表达。IL-35能诱导Treg细胞增殖,抑制辅助性T细胞17型(Th17)细胞的分化,能够改善胶原性关节炎临床症状。DONG等[8]经研究证实IL-35在胸膜结核性胸腔积液中表达量较高。总结最近国内外关于IL-35的相关研究,发现它在肿瘤发生、发展、预后及转归中起重要作用。但也有研究发现IL-35能够抑制肿瘤生长并提高肿瘤细胞凋亡的敏感性[9]。但目前关于IL-35在肾脏恶性肿瘤的发生、发展中的作用的研究较少,有待进一步研究。
ZHANG等[10]研究报道经实验在肿瘤微环境中检测到IL-35及调节性T细胞(Treg)明显增加。本研究发现肾癌患者的血清IL-35水平明显高于健康志愿者,与ZHANG等[10]的结论部分一致。本文通过绘制ROC曲线判断IL-35对肾透明细胞癌的诊断价值,发现IL-35水平能够作为一种新指标来诊断肾癌,最佳截点为IL-35 80.13 pg/mL,其灵敏度为61.3%、特异度为91.1%,诊断正确率为73.2%。JIN等[11]曾发表文章称胰腺导管腺癌患者的血清中IL-35水平明显升高,IL-35参与了疾病的病理生理过程。此外也有研究发现关于黑色素瘤及结肠癌组织的研究,均发现IL-35水平增加,IL-35能通过抑制CD4+T细胞的增殖,进而抑制机体的抗肿瘤免疫。此外,IL-35能够促进肿瘤血管的增生,促进肿瘤的生长[12-13]。IBUSUKI等[14]曾报道非小细胞肺癌患者的血清IL-35水平与淋巴转移密切相关。此外,本研究发现血清IL-35水平与肿瘤分期及淋巴结转移密切相关,与IBUSUKI的研究结果部分一致。肿瘤分期及淋巴结转移是判断癌症患者预后的一项重要指标,所以本研究认为血清中IL-35水平可以在一定程度上反映肾透明细癌的预后。
本研究对IL-35 mRNA在肾癌中的表达水平也进行了研究,发现肾透明细胞癌组外周血单个核细胞中IL-35的亚基(EBI3及p35)的表达量明显高于对照组;而肾癌组织中的EBI3及p35的表达量均明显高于癌旁组织和正常组织。体内IL-35由Treg分泌,有免疫负调控的作用,通过基因表达分析发现,其他多种组织也可以表达IL-35。有研究证实EBI3在急性粒细胞白血病细胞及霍奇金淋巴瘤中均表达升高[15-16]。本研究认为临床上推广通过肾脏穿刺活检,检测IL-35 mRNA有一定的困难,建议推广应用血液中检测IL-35水平来判断疾病的严重程度及预后,也更加方便快捷。
综上所述,IL-35在肾透明细胞癌患者的外周血及组织中均明显升高,血清中IL-35水平与临床分期及淋巴结转移密切相关,能够在一定程度上反映肾透明细胞癌预后。本研究为单中心研究,且样本数量较少,建议进行多中心合作,扩大样本数量,进一步研究IL-35的具体功能及相关机制。
参考文献
[1]赵丽,王萍.白介素-35与心血管疾病关系研究进展[J].广西医学,2017,39(1):84-86.
[2]张晴,魏淑萍,黄鹏飞,等.肾透明细胞癌病理分级与其超声特征的相关性分析[J].医学研究生学报,2017,30(10):1071-1074.
[3]FAN Y G,ZHAI J M,WANG W,et al.IL-35 over-expression is associated with Genesis of gastric cancer[J].Asian Pac J Cancer Prev,2015,16(7):2845-2849.
[4]徐一鹏,朱绍兴,刘维辉,等.IL-2、IFN-α、IFN-γ对肾透明细胞癌786-0细胞中B7-H4表达的影响[J].中国肿瘤生物治疗杂志,2013,20(5):547-551.
[5]许白叶,张静,王清海,等.阻断白介素-3减轻脓毒血症小鼠的炎症反应[J].中国现代医学杂志,2016,26(13):28-36.
[6]SKROMBOLAS D,WYLIE I,MAHARAJ S,et al.Characterization of an IL-12 p40/p35 truncated fusion protein that can inhibit the action of IL-12[J].J Interferon Cytokine Res,2015,35(9):690-697.
[7]NING X W,JIAN Z J,WANG W.Low serum levels of interleukin 35 in patients with rheumatoid arthritis[J].Tohoku J Exp Med,2015,237(2):77-82.
[8]DONG X,YANG J.High IL-35 pleural expression in patients with tuberculous pleural effusion[J].Med Sci Monit,2015,21(8):1261-1268.
[9]陶千山,翟志敏.IL-35及其诱导产生的
新型调节性T细胞——iTR35细胞[J].国际免疫学杂志,2013,36(5):329-332.
[10]ZHANG Y,SUN H,WU H,et al.Interleukin 35 is an Independent prognostic factor and a therapeutic target for nasopharyngeal carcinoma[J].Contemp Oncol,2015,19(2):120-124.
[11]JIN P,REN H,SUN W,et al.Circulating IL-35 in pancreatic ductal adenocarcinoma patients[J].Hum Immunol,2014,75(1):29-33.
[12]黄崇标,田野,崔焱,等.白细胞介素35的在肿瘤发展中的作用[J].中国肺癌杂志,2016,19(4):230-235.
[13]LIU H,ZHANG W,TIAN F F,et al.IL-35 is involved in the pathogenesis of Guillain-Barré syndrome through its influence on the function of CD4+T cells[J].Immunol Invest,2015,44(6):566-577.
[14]IBUSUKI K,SAKIYAMA T,KANMURA S,et al.Human neutrophil peptides induce interleukin-8 in intestinal epithelial cells through the P2 receptor and ERK1/2 signaling pathways[J].Int J Mol Med,2015,35(6):1603-1609.
[15]WANG J,TAO Q,WANG H,et al.Elevated IL-35 in bone marrow of the patients with acute myeloid leukemia[J].Hum Immunol,2015,76(9):681-686.
[16]曹蕾,范磊,徐卫,等.第56届美国血液学年会研究热点报道:慢性淋巴细胞白血病治疗研究进展[J].中华血液学杂志,2015,36(4):358-360.



