王 燕,田 薇,刘 颖,靳 钦,张 曙
(南通大学附属医院病理科,江苏南通 226001)
肝细胞癌是最常见的恶性肿瘤之一,每年约有60万新增病例,死亡人数大于25万[1]。目前临床最常见的治疗方法仍是手术切除和肝脏移植,另外肿瘤细胞对其化疗药索拉非尼极易产生耐药性,且该药毒性较强[2-3]。 因此,鉴定新型的生物分子标记对有效治疗肝细胞癌是必要的。死亡结构域相关蛋白(Daxx)最初是YANG等发现的一种新型的高度保守蛋白,存在与人体正常细胞和肿瘤细胞中,Daxx在肝细胞癌中的表达及临床意义国内鲜有报道。本研究应用组织芯片、免疫组化法及Western blot检测其在肝细胞癌中的表达情况,分析其与临床病理参数及预后的关系,探讨其表达在肝细胞癌发生、发展中的作用。
1 资料与方法
1.1一般资料 收集本院2017年 6 月5例肝细胞癌患者手术切除的新鲜癌组织及正常肝组织,冻存备用。收集2010-2012年280例患者的相关肝组织,其中130例肝细胞癌组织,18例肝炎组织,32例肝硬化组织及100例正常肝组织,术前患者均未经任何抗肿瘤治疗,均有相应的临床病理资料及随访记录,随访率达100%,随访截至2017年6月。本研究符合人体试验伦理学标准,并得到伦理委员会的批准,均经患者知情同意。
1.2试剂 鼠抗人Daxx抗体购于英国Abcam公司,HRP标记山羊抗鼠IgG购于美国Sigma公司,细胞核浆蛋白提取试剂盒购于中国碧云天生物技术有限公司,DAB显色试剂盒购于中国北京中杉金桥生物技术有限公司。
1.3方法
1.3.1组织芯片联合免疫组织化学法 收集的患者标本均经福尔马林固定、石蜡包埋后,制成组织芯片。经4 μm切片,脱蜡、水化、微波处理及抗原修复后,免疫组织化学行Daxx标记。阳性对照为自身对照,一抗的同型对照作为阴性对照。组织芯片结果由两位高年资的病理诊断医师在双盲情况下进行结果判读。阳性结果为细胞质或细胞核呈棕黄色或棕褐色颗粒状。结果判读:在高倍镜下(×400)分别对每个位点计数100个细胞,计4个位点,共400个细胞,记录染色强度和阳性细胞所占的百分比。染色强度:无着色0分,黄色弱阳性1分,浅棕色中阳性2分,棕褐色强阳性3分;阳性细胞百分比:≤5% 0分,6%~25% 1分,26%~50% 2分,51%~75% 3分,>75% 4分;染色强度和阳性细胞百分比评分相乘,大于或等于1 分为阳性。
1.3.2Western blot 取5例新鲜肝细胞癌组织及正常肝组织,使用细胞核浆蛋白试剂盒分别提取提取核浆蛋白,经紫外分光光度仪蛋白定量后分别取50 μg进行Western blot检测,内参为β-actin。最后加ECL显色液显影。
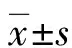
2 结 果
2.1Daxx在肝细胞癌中的表达 在正常肝组织、肝炎组织及肝硬化组织中Daxx蛋白主要表达于细胞核,差异有统计学意义(P<0.05),见表1。在肝细胞癌中Daxx蛋白表达于细胞质,表达阳性率为30.8%(40/130),见图1;Western blot 结果与免疫组化结果一致,见图2。
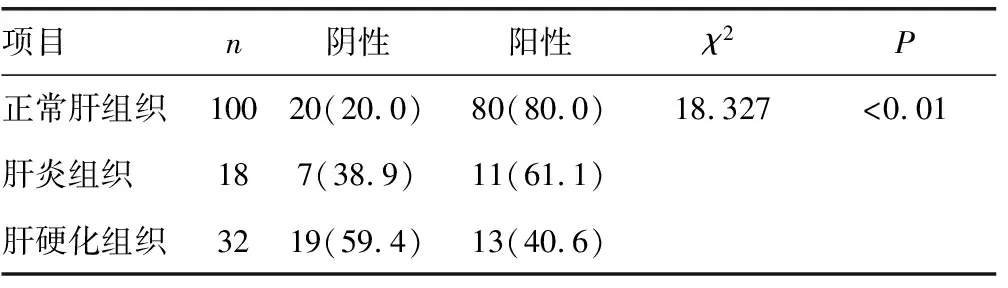
表1 Daxx蛋白在正常肝组织、肝炎组织及肝硬化组织中的表达情况[n(%)]
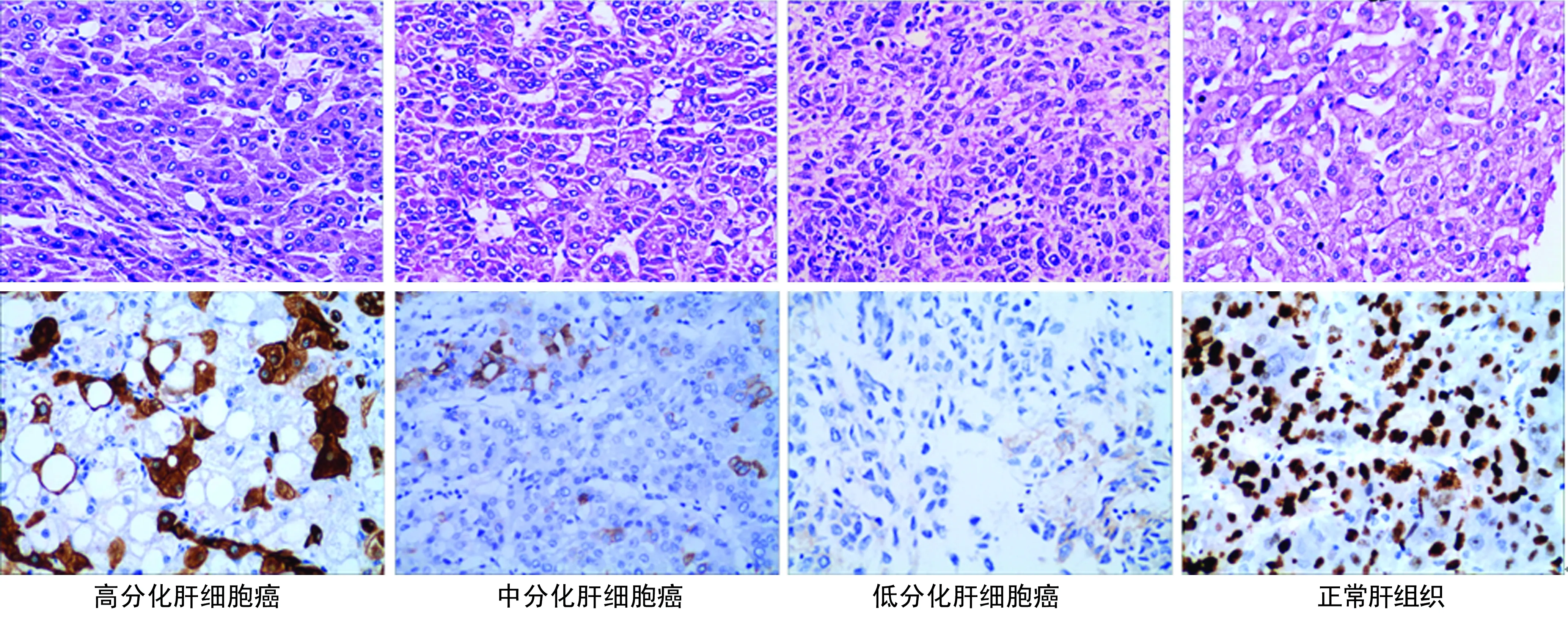
图1 免疫组化检测Daxx在不同分化程度的肝细胞癌及正常肝组织中的表达(×400)
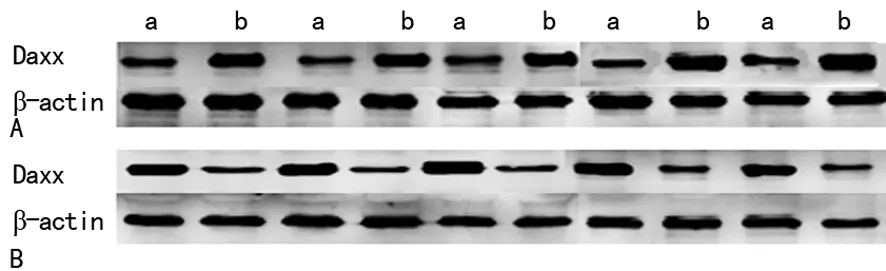
A:肝细胞癌组织;B:正常肝组织;a:核蛋白;b:浆蛋白
2.2Daxx表达与肝细胞癌临床病理参数的关系 Daxx在肝细胞癌中的表达与患者AFP、肝炎史、肝硬化史、肿瘤分化程度、TNM分期、门静脉癌栓及Ki67表达相关(P<0.05),而与患者性别、年龄、饮酒史、肿瘤数目、肿瘤大小及肿瘤部位不相关(P>0.05),见表2。
2.3预后分析 Kaplan-Meier生存曲线显示 Daxx阴性组患者的5年总生存期(OS)及无进展生存期(PFS)比阳性组更短,见图3。单因素生存分析显示 Daxx的表达程度、TNM分期、门静脉癌栓及Ki67表达程度与患者术后生存期相关(P<0.05)。COX比例风险回归模型多因素分析进一步显示Daxx表达程度、TNM分期及Ki67表达程度为影响OS及PFS的独立危险因素,见表3、4。
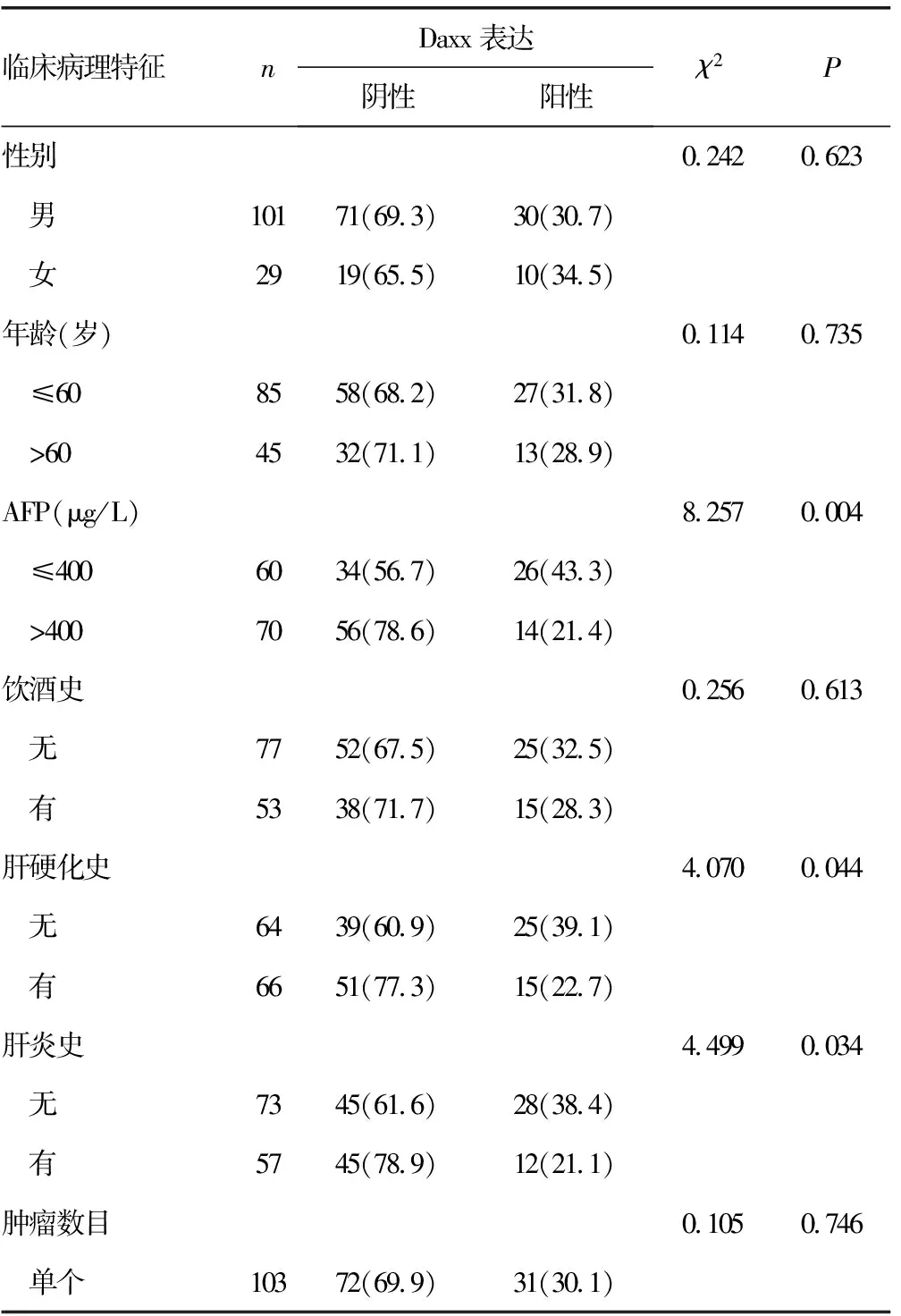
表2 Daxx表达与肝细胞癌患者临床病理参数的关系[n(%)]
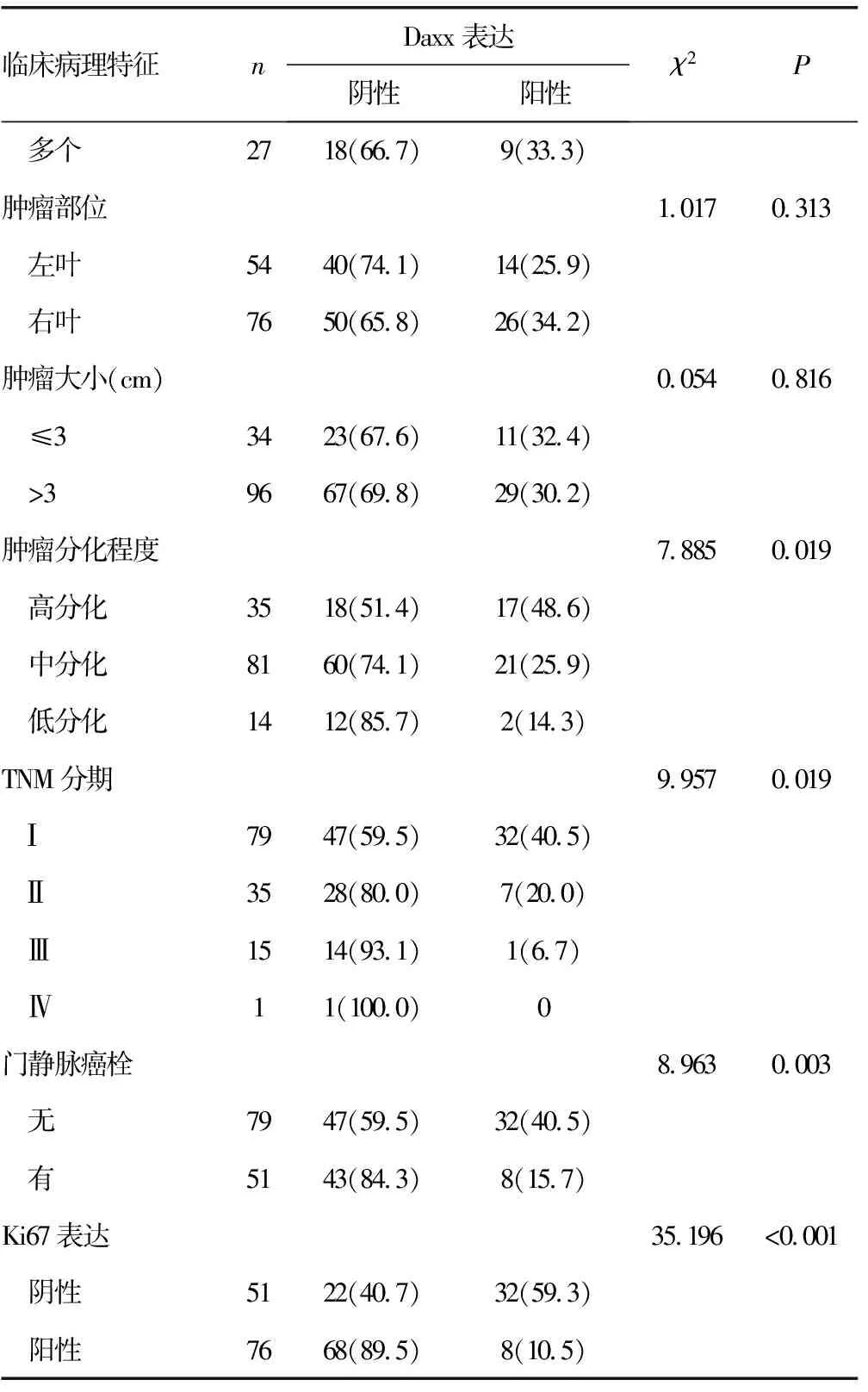
续表2 Daxx表达与肝细胞癌患者临床病理参数的关系[n(%)]
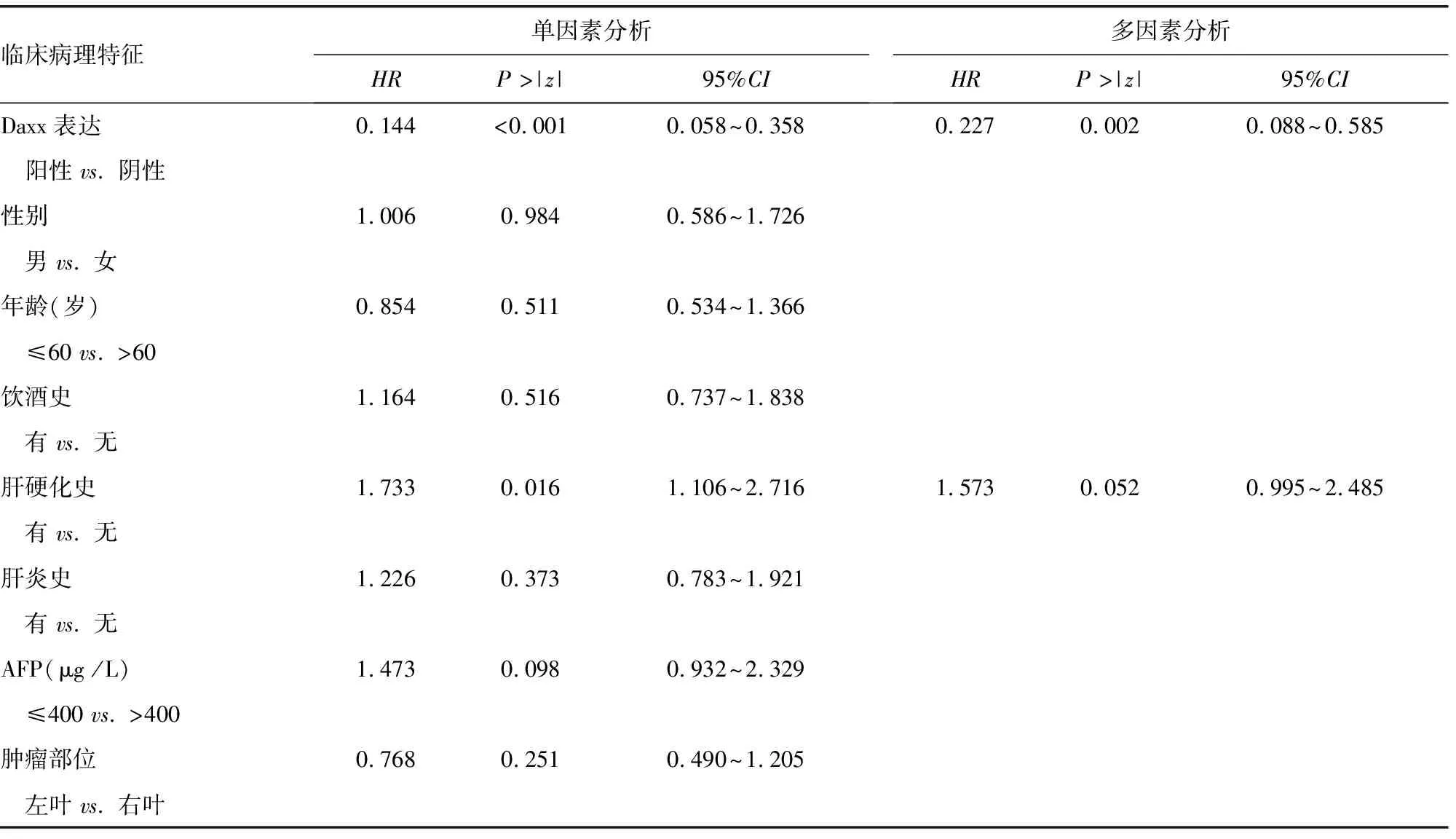
表3 单因素和多因素分析肝细胞癌患者临床病理特征与OS的关系
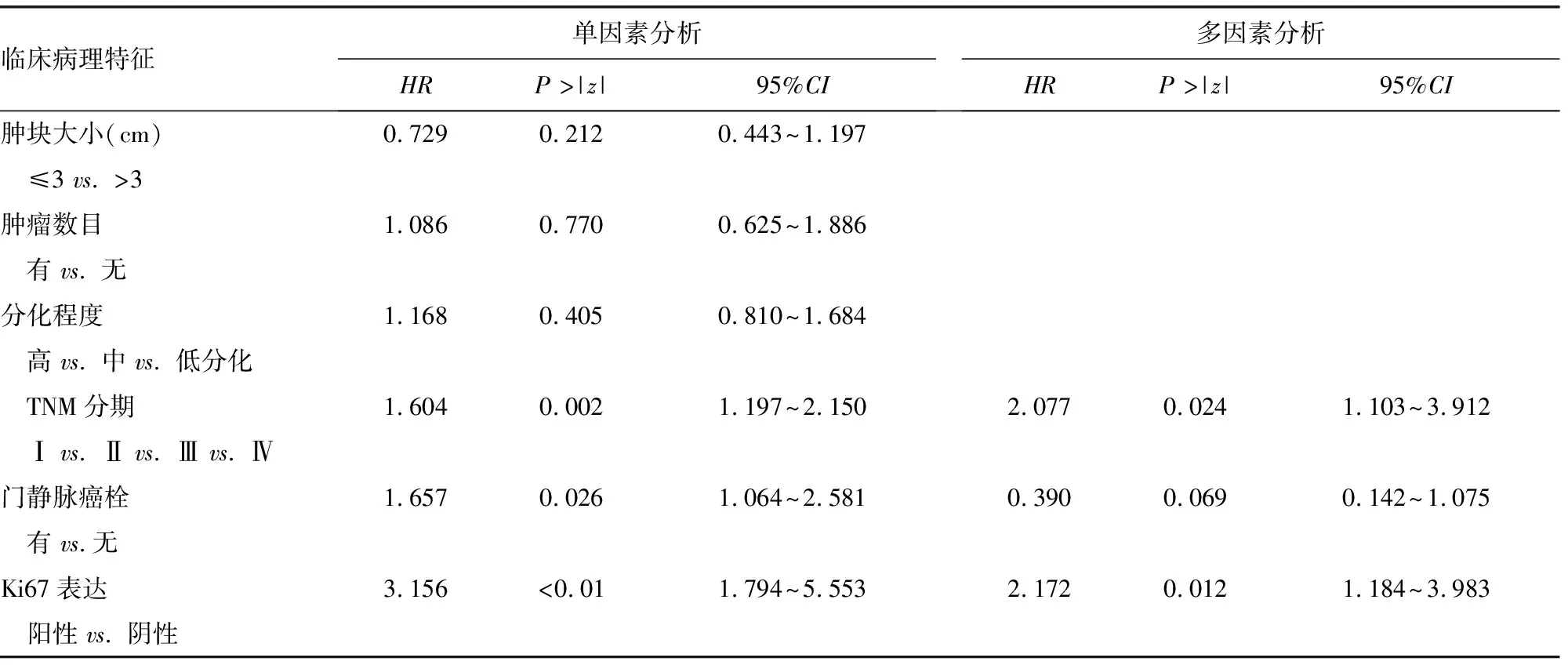
续表3 单因素和多因素分析肝细胞癌患者临床病理特征与OS的关系
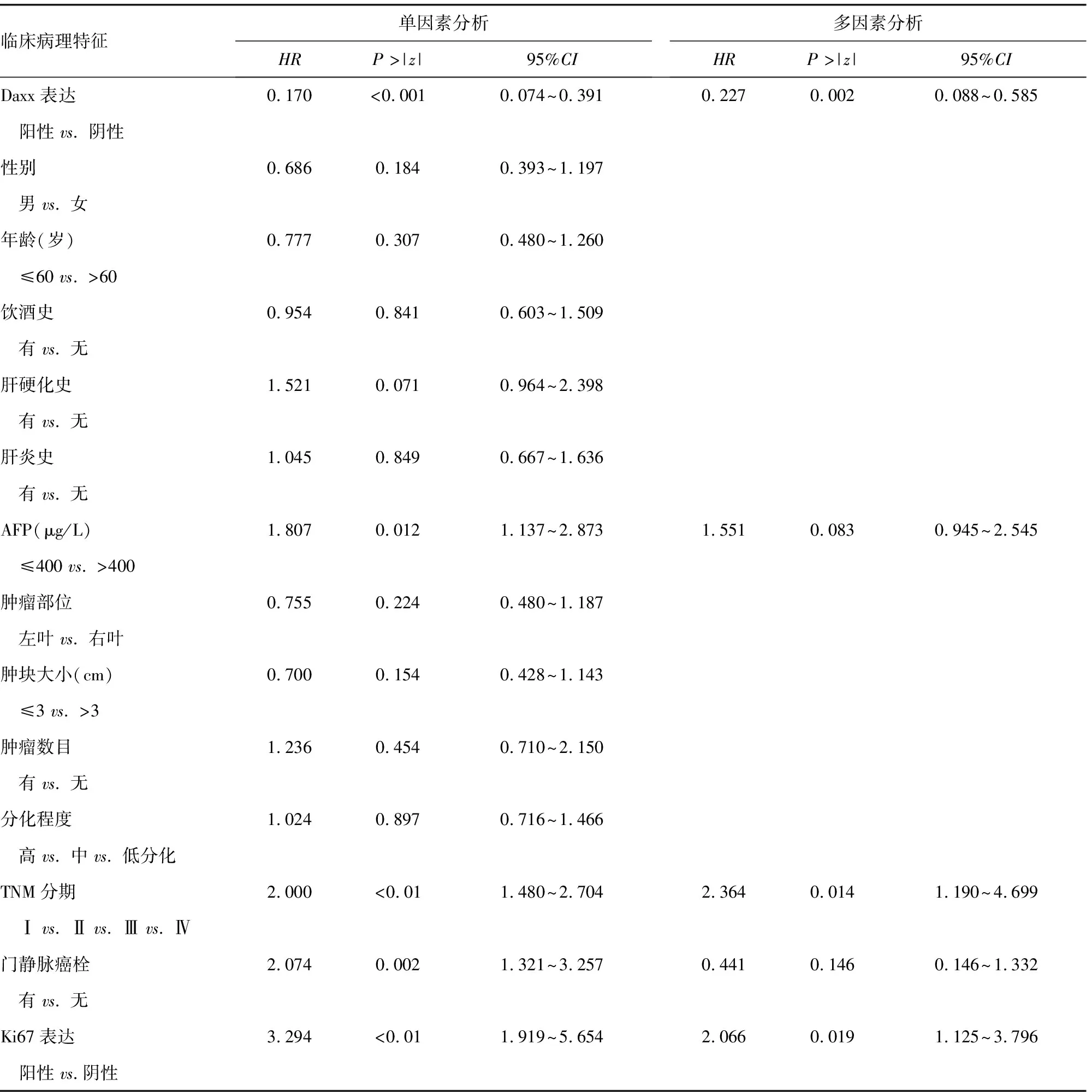
表4 单因素和多因素分析肝细胞癌患者临床病理特征与PFS的关系
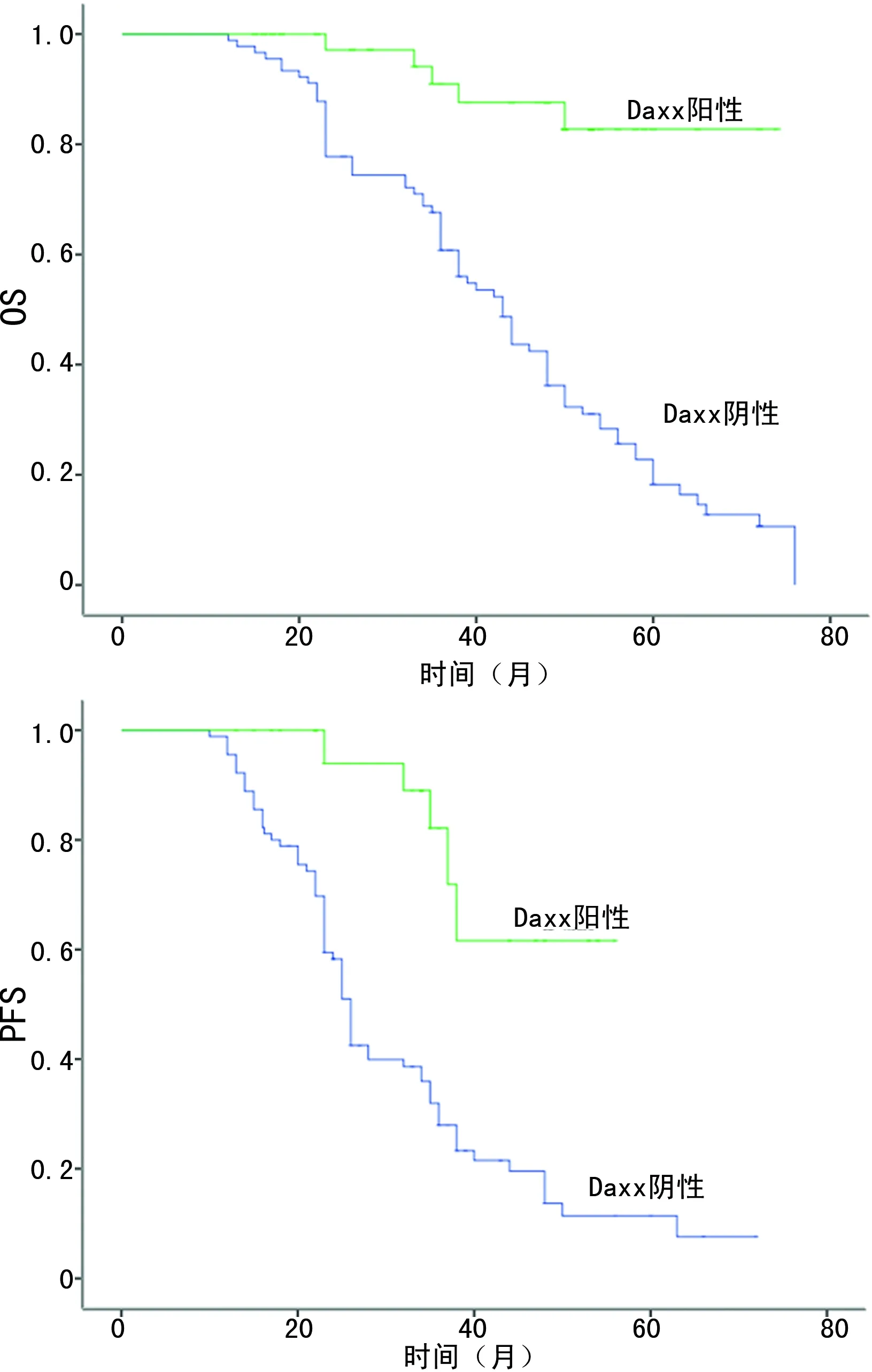
图3 肝细胞癌患者中Daxx不同表达的OS及PFS的生存曲线
3 讨 论
肝细胞癌是一种起源于肝细胞的恶性肿瘤,是全球第二大癌症杀手,第三大癌症死因,在我国发病率居世界首位。到目前为止,肝细胞癌的发病率和病死率居高不下,因此有必要寻找更为有效更为安全的生物治疗方案。
Daxx基因定位于6号染色体短臂2区1带3亚带,全长约315 kb,含有7个外显子、6个内含子及4个结构域(酸性氨基酸结构域1个、配对兼性双螺旋2个、 SPT结构域1个),它们共同参与了Daxx的转录调控。Daxx蛋白含有740个氨基酸,由于转录后修饰的不同,存在3种不同的形式,相对分子质量为120×103、97×103和70×103。
Daxx是一种多功能蛋白,可与多个蛋白相互作用,共同参与细胞凋亡。其生物活性的发挥与其在亚细胞间的分布、表达、定位及转位相关。有研究最初提出Daxx在胞浆中是作为Fas蛋白的下游,参与其凋亡通路发挥促凋亡作用,但最新研究发现,Daxx在T细胞存活中发挥了新的作用,但在Fas诱导的细胞凋亡中是不必要的[4];另外,Daxx可作为细胞凋亡的启动子与细胞凋亡信号调节激酶1(ASK1)相互作用,通过JNK和p38途径启动凋亡;也可以和前列腺细胞凋亡反应蛋白4(PAR-4)通过ZIP激酶的磷酸化来诱导凋亡[5]。而当Daxx定位于细胞核时,它可以抑制诸如ETS143、Pax342、NF-κB、E2F120、p53和p73等转录因子的表达[6],进而发挥抗细胞凋亡作用,另有研究发现Daxx可发挥潜在的抗细胞凋亡的功能[7]。
Daxx与多种肿瘤如胰腺神经内分泌肿瘤、卵巢癌及胶质母细胞瘤的发生发展密切相关[8]。NETSAWANG等[9]在研究登革病毒衣壳蛋白(DENVC)的过程发现,Daxx 能够与核内定位的 DENVC共同诱导肝细胞癌HepG2 细胞的凋亡,其高表达能够促进HepG2细胞凋亡,该凋亡与过氧化氢相关。Daxx能特异的结合于原癌基因c-met启动子区域,同时有HDAC2水平的升高,可见HDAC2参与Daxx对c-met启动子的转录抑制。另有研究发现在乳腺癌及非小细胞肺癌中,Daxx与c-met表达成负相关,进一步说明Daxx对c-met的转录有一定的抑制作用[10],而c-met基因过表达是肝细胞癌手术切除患者复发和生存的不良预后因素[11],由此可以推断Daxx可能与肝细胞癌的预后相关。
另一方面,Daxx在病毒的防御及抑制转录等方面也发挥了巨大的作用。近年研究显示,Daxx可与多种细胞因子及病毒蛋白相互作用,共同参与调节病毒的复制周期,而一些病毒蛋白的合成或病毒的感染又可反过来影响 Daxx 在细胞内的定位,进而影响其功能的发挥[12]。有研究发现,ZIP激酶可与Daxx共定位,与PML一起维持PML-NBs结构与功能的稳定性,该稳定不利于病毒的复制及转录[13]。另外Daxx也参与了HSV-1 ICP27对NF-κB活性的抑制[14]。
本研究显示,Daxx蛋白主要表达于正常肝组织、肝炎组织及肝硬化组织的细胞核,肝细胞癌组织的细胞质,并且与患者的AFP、肝炎史、肝硬化史、肿瘤分化程度、TNM分期、门静脉癌栓及Ki67表达有关,由此推测Daxx蛋白可能与肝炎病毒相互作用,而病毒的感染影响了该蛋白在细胞中的定位,导致其由细胞核转位到细胞质,进而发挥抑制肝细胞癌细胞凋亡的作用。进一步分析Daxx在肝细胞癌组织中的表达与患者预后的相关性,结果表明Daxx是影响肝细胞癌预后的因素之一。
综上所述,Daxx的高表达有可能抑制肝细胞癌的发生、发展、侵袭与转移,可作为判断肝细胞癌预后的独立因子,具体的作用机制及其与肝炎病毒的关系有待于进一步的研究和探索。



