苗建波,安少波,徐 雷,张晓蕾,胡喜田,吴志红,都 伟
(石家庄市第一医院心血管内科 050011)
冠状动脉介入术的发展与广泛应用显着改善了冠心病患者总体预后与生活质量,但术后发生的支架内血栓(stent thrombosis,ST)形成仍是困扰临床的重要难题[1]。药物涂层支架的应用使支架内再狭窄发生率明显降低,而ST形成并未明显减少。目前,临床认为ST形成的主要机制在于药物涂层支架导致血管再内皮化延迟。因此,加快血管内皮化有利于恢复血管功能,预防ST形成。既往观点认为,受损血管边缘内皮细胞迁移、增生是完成血管再内皮化的主要途径[2]。而现代医学显示,起源于骨髓的干细胞或内皮祖细胞(endothelial progenitor cell,EPC)经血管损伤激活后,迁移至损伤血管区域,参与血管再内皮化[3]。有研究表明,粒细胞集落刺激因子能够激活EPC,促进血管再内皮化,但其促炎作用较强,在安全性方面欠缺[4]。血管内皮生长因子(VEGF)亦可通过刺激骨髓作用,激活EPC,从而促进血管再内皮化,防止术后ST形成,同时VEGF促炎作用较弱,安全性较高。本研究通过设计随机对照实验,观察VEGF对新西兰兔腹主动脉支架植入后血管内皮再生速率及血管内皮功能的恢复,旨在为减少支架植入术后ST形成等并发症的发生提供新的靶点与理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物 健康新西兰白兔35只,雄性,年龄4~6个月,体质量2.5~3.0 kg,购自四川动物养殖中心。
1.1.2实验仪器与试剂 苦味酸固定液:将1.2 g苦味酸加至100 mL蒸馏水内,使溶液形成饱和状态;改良苏木精染液:苏木精0.25 g、硫酸铝钾0.5 g、碘酸钠25 mg、冰醋酸1 mL、甘油15 mL、无水乙醇2 mL、蒸馏水33 mL;1%盐酸-乙醇分化液:45.5 mL 70%乙醇、0.5 mL浓酸盐;促蓝液:硫酸镁与碳酸氢铵分别2.00、0.35 g,蒸馏水100 mL。恒温箱、二氧化碳(CO2)培养箱、酶标仪、光学显微镜、天平等。
1.1.3实验饲料 高脂饲料,含15%蛋黄粉、0.5%胆固醇、5%猪油、79.5%普通饲料。
1.2 方法
1.2.1建立高脂血症动物模型 分笼饲养新西兰兔,观察7 d后,抽取兔静脉血,检测总胆固醇、低密度脂蛋白、高密度脂蛋白等各项血脂指标,完成各项测定后,开始喂养高脂饲料,持续喂养3周,剔除高脂饲料中胆固醇,继续喂养至6周后,复查血脂水平。
1.2.2组织形态学分析 处死新西兰兔5只,取其腹主动脉切片观察脂质沉积与动脉硬化程度。将腹主动脉置于苦味酸饱和溶液中固定,采用乙醇脱水,二甲苯透明、石蜡包埋,制作石蜡块,连续切片,行苏木精-伊红(HE)染色,经光学显微镜观察动脉粥样硬化斑块。
1.2.3实验动物分组 采用随机数字表法将余下30只新西兰兔分为两组:裸金属支架组、裸金属支架+VEGF组,各15只。
1.2.4支架植入 两组实验动物均植入裸金属支架,在动物导管室进行所有操作,确保无菌操作流程。术前3 d开始喂服阿司匹林(山西新宝源制药有限公司,批号:国药准字H14020945),25 mg/d;氯吡格雷(深圳信立泰药业股份有限公司,批号:国药准字H20000542),75 mg/d。经兔耳缘静脉注射3%戊巴比妥(上海新亚药业有限公司,批号:国药准字H31021725)1 mL/kg,麻醉完成后,将兔固定于操作台上,将其腿部毛褪去。应用聚维酮碘与75%乙醇脱碘消毒腿部皮肤,于消毒区域铺巾,铺巾范围小于消毒区域,作为手术视野。抽取2 mL利多卡因(紫光古汉集团衡阳制药有限公司,批号:国药准字H43021924),局部浸润麻醉。将兔腿部皮肤切开,逐层分离,显露右股动脉,行穿刺针穿刺,见回血喷射后,置入导引钢丝,并于腹主动脉内送入6 F引导管。经引导管予以100 U/kg肝素钠,透视条件下,钢丝进入腹主动脉,注意避开肾动脉分叉,沿钢丝进入造影导管,做腹主动脉造影,测量血管直径,确定目标血管,造影结束后将造影导管撤出。采用3.5 mm直径的球囊携带支架植入腹主动脉,球囊支架与血管直径比为1.1~1.2∶1.0。将球囊充盈至8 atm,维持10 s,待支架与血管壁完全贴合后,将球囊撤出,造影观察血管,血管通畅,无影像学异常后,将造影管与鞘管退出,严格止血、逐层缝合伤口,用碘酒消毒皮肤。兔清醒后,送至笼内继续饲养。术后常规肌内注射800 kU青霉素(天津华津制药有限公司,批号:国药准字H12021258),2次/天,共注射3 d。
1.2.5应用VEGF 裸金属支架+VEGF组植入支架后,即刻经导管予以40 μg VEGF121,随后于术后第2~9、16~23、31~38天,经皮下应用VEGF121,1 μg/d。裸金属支架组注射等剂量与频率的生理盐水。
1.2.6检测外周血EPC 所有实验动物手术前均经耳缘静脉取2 mL静脉血,乙二胺四乙酸(EDTA)抗凝,采用密度梯度离心法将单个核细胞分离,收集细胞1×106个重悬于100 μL磷酸缓冲盐溶液(PBS)中,加至流式管内,同时加入异硫氰酸荧光素(FITC)标记的CD34与藻红蛋白(PE)标记的CD45各20 μL,用于同型对照。另一流式管内,加抗凝血100 μL、FITC标记的IgG120 μL、PE标记的IgG120 μL。4 ℃下避光孵育,洗涤,根据说明书要求上机,流式检测外周血中CD34+/CD45+的EPC百分率,计数EPC。
1.2.7检测血管再内皮化速率 分别于术后15、30、60 d,由各组中随机选出新西兰兔5只,将其处死。取支架覆盖段腹主动脉,包括相邻上下血管段5 mm,横向剪开支架植入段血管,平均分为两段,其中一段以4%多聚甲醛固定,行脱水、透明、石蜡包埋处理,随后进行HE染色,对内膜增生程度进行观察;另一段采用2%戊二醛溶液浸泡、固定,应用梯度乙醇脱水,经临界点干燥与镀膜,在电镜下扫描观察血管内皮化程度,测算内皮覆盖率。
1.3观察指标 比较两组术后1、7、14、28 d EPC数量与术后15、30、60 d损伤血管再内皮化速率。
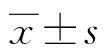
2 结 果
2.1EPC数量比较 两组术后13 d,均出现2只新西兰兔死亡,15 d时处死5只用于检测血管再内皮化速率。裸金属支架+VEGF组各时段EPC数量均明显高于裸金属支架组,差异均有统计学意义(P<0.05),见表1。
2.2损伤血管再内皮化速率 15 d后,两组均出现明显的血管再内皮化,其中裸金属支架+VEGF组基本完成内皮化;30 d后,两组内皮化完成,但裸金属支架组细胞形态仍与正常内皮存在较大差异,裸金属支架+VEGF组细胞变长,已接近于正常内皮层形态;60 d后,裸金属支架表面完全覆盖,但存在纤维状结构。裸金属支架+VEGF组血管内支架表面未出现变化,提示支架植入30 d后内膜损伤过程在已完成,见图1~3。
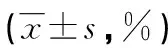
表1 两组EPC数量比较
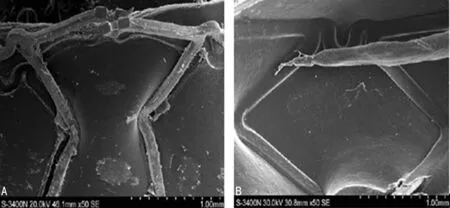
A:裸金属支架组;B:裸金属支架+VEGF组图1 术后15 d两组损伤血管再内皮化程度(×50)
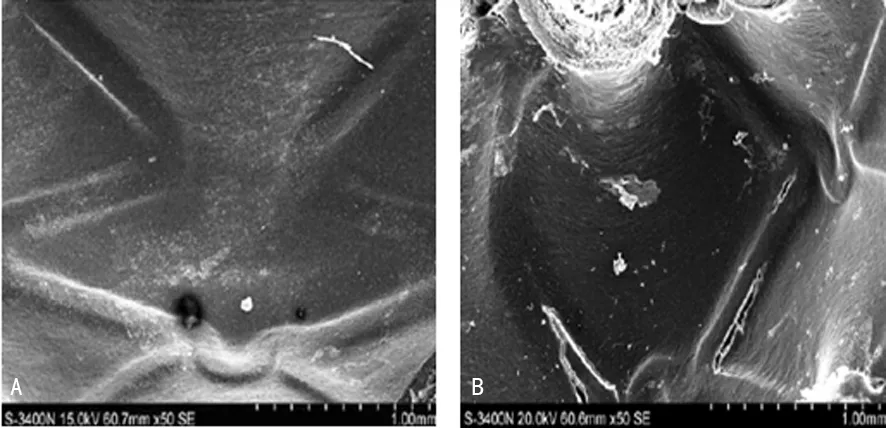
A:裸金属支架组;B:裸金属支架+VEGF组图2 术后30 d两组损伤血管再内皮化程度(×50)
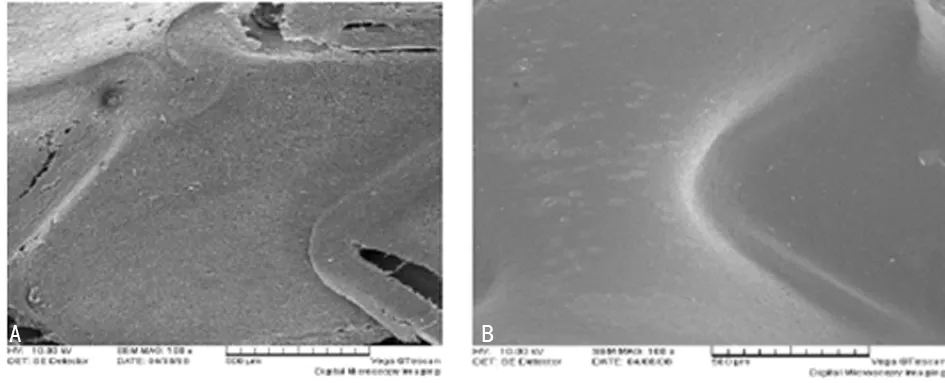
A:裸金属支架组;B:裸金属支架+VEGF组图3 术后60 d两组损伤血管再内皮化程度(×50)
3 讨 论
EPC在冠状动脉支架植入引起的血管损伤修复中的作用报道较少,既往有报道患者行冠状动脉血管成形术后,内皮细胞数量在外周循环中明显增多,内皮细胞集落形成在24 h内增加2~3倍[5]。另外,单纯行冠状动脉造影而未实施冠状动脉支架植入术患者内皮细胞集落形成单位无明显变化,提示内皮细胞集落形成与血管损伤具有一定关系[5]。以往动物实验中发现,洛伐他汀与辛伐他汀能够激活血管损伤后EPC,促进再内皮化,缓解内膜增生,但有研究提出,仅有特殊的干细胞可促进再内皮化[6]。同时多数研究表明,粒细胞集落刺激因子能够激活EPC,提高再内皮化速率,抑制内膜增生,但研究的缺陷在于动物模型血管损伤仅由介入导管所致,尚未植入支架,故无法显示支架植入后再内皮化程度[7]。而在以狗为实验对象的研究中,主动脉移植术后应用粒细胞集落刺激因子在促进再内皮化的同时,内膜增生十分明显,加之粒细胞集落刺激因子促炎作用显着,其临床应用安全性受到普遍质疑[8]。
本研究选取新西兰兔腹主动脉支架植入模型作为观察对象,结果发现,裸金属支架+VEGF组术后EPC数量明显多于裸金属支架组,且损伤血管再内皮化速率明显大于裸金属支架组,提示VEGF在支架植入术后有助于促进EPC活化,加快损伤血管再内皮化速率,从而改善血流动力学。VEGF主要分泌于血管内皮细胞,是内皮细胞生长与分化不可缺少的因子,其不仅参与胚胎血管形成,在修复血管生理性损伤、促进病理性血管新生中同样扮演着重要角色[9-11]。冠状动脉支架植入术是治疗冠心病的主要手段,能够有效开通狭窄或闭塞动脉,但该术式面临的问题是支架植入后,粥样硬化斑块受压缩而破裂,造成血管内皮损伤,基底膜显露,进而引起血小板聚集,诱发血栓形成[12]。另外,血管内皮损伤可增加多种细胞因子的分泌,导致血管平滑肌细胞过度增殖,造成术后支架内再狭窄。因此,及时修复血管内皮损伤对预防冠状动脉支架植入术后支架内再狭窄十分关键[13]。由于冠状动脉支架植入术损伤血管内皮细胞,导致EPC快速增殖、迁移,其中EPC主要见于骨髓,是多能细胞的一种,在人胚胎血管生成、出生后血管新生及内皮损伤修复等过程中均有参与,当机体出现损伤信号时,EPC在损伤信号的诱导下迁移至损伤局部,并逐渐分化为成熟的血管内皮细胞,促进血管新生与修复[14-15]。VEGF由成熟血管内皮细胞经旁分泌机制分泌,而VEGF亦可通过促进EPC增殖分化,加速内皮生长与修复。VEGF促内皮细胞分裂、增殖的特点如下:(1)VEGF能够通过肝素结合位点与硫酸肝素结合,达到延长自身作用时间的效果;(2)血管内皮细胞与VEGF二者间可形成正反馈效应,进而增强VEGF作用[16];(3)VEGF可通过阻止肿瘤坏死因子α等因子的产生,抑制自身凋亡,从而延长作用时间,实现高效的修复内皮细胞功能。故高水平VEGF可显着加快再内皮化过程,促进内皮细胞屏障功能的恢复,预防血栓形成[17];此外,VEGF可对抗超氧化物等多种有害物质,抑制内皮细胞过度增生,避免或减少术后再狭窄形成。
综上所述,裸金属支架联合VEGF可明显增加EPC水平,促进损伤血管再内皮化,有利于局部组织血流灌注,减轻机体组织损伤。



