崔永华,夏咏本,朱晓文,王张明,韩 清,郑爱东
(南通大学附属建湖医院神经外科,江苏盐城 224700)
高血压性基底节区脑出血患者病情危重、预后不良,有极高的致残率和病死率,手术是其治疗的主要方法之一。本院2013年1月至2016年12月收治50例高血压性基底节区后部脑出血患者,按随机数字法分别采用经侧裂下Rolandic点-岛叶入路和颞叶皮层入路手术,取得较为满意的疗效,现将结果报道如下。
1 资料与方法
1.1一般资料 采用前瞻性研究,依据文献[1-2]的基底节区脑出血CT分型,收集基底节区后部中等血肿量脑出血患者50例。其中男27例,女23例;年龄45~83岁,平均67.7岁;均有高血压病史,在6个月至35年,平均11.7年;入院时格拉斯哥昏迷指数(GCS)评分大于12分14例,9~12分23例,6~8分13例;依据多田公式计算血肿量30~60 mL,平均43.6 mL;左侧基底节区脑出血33例,右侧17例;血肿破入脑室11例。50例患者按随机数字法分为观察组(经侧裂下Rolandic点-岛叶入路,n=25)与对照组(经颞叶皮层入路,n=25),两组患者在年龄、性别及血肿侧别等临床资料方面比较,差异无统计学意义(P>0.05)。纳入标准:(1)均有高血压病史;(2)单侧的基底节区后部血肿;(3)随访6个月及以上。排除标准:(1)动脉瘤、脑血管畸形出血;(2)合并严重基础疾病;(3)凝血功能异常;(4)手术前双侧瞳孔散大;(5)GCS评分3~5分;(6)生命体征严重紊乱。本研究通过医院伦理委员会批准,患方均签署知情同意书。
1.2方法
1.2.1治疗方法 (1)经侧裂下Rolandic点-岛叶入路:参考RHOTON[3]进行外侧裂、侧裂前点、下Rolandic点体表定位。行颞部耳前斜向后上的直切口6~8 cm,微骨瓣或小骨窗开颅手术。开颅剪开硬脑膜暴露外侧裂,术中解剖下Rolandic点,暴露岛叶中后方,电凝岛叶无血管区,切开约1 cm,进入血肿腔,显微镜下清除血肿。(2)颞叶皮层入路:于颞上或中回后部切开大脑皮质1.5~2.0 cm,显微镜下清除血肿。血肿清除后血肿腔敷贴止血纱,密闭缝合硬脑膜,硬脑膜外不放引流,微骨瓣开颅者骨瓣复位。对于脑肿胀、脑皮层塌陷不明显者,头皮切口向上向前延伸,并去额颞顶大骨瓣减压。
1.2.2综合治疗 术后严格控制血压,加强呼吸道管理,常规予以亚低温32~35 ℃,预防感染,控制颅内压,营养脑神经细胞,促苏醒等综合治疗,存活患者尽早康复治疗。
1.3观察指标 比较两组患者手术情况[手术总时间(h总)、手术开始至血肿腔压力释放颅压下降时间(h降)、失血量、去额颞顶大骨瓣减压病例数、术后24 h血肿清除率、再出血发生率、术后48 h脑水肿增加率及术后1周GCS评分、ICU住院时间],术后并发症(失语、视野缺损、癫痫、气管切开、肺部感染、颅内感染),术后6个月格拉斯哥预后(GOS)评分。其中脑水肿增加率,参照血肿体积计算,以术后6 h与术后48 h CT所见血肿腔及其周围低密度区域差值的比值作为统计;术后6个月GOS分级:恢复良好,Ⅰ级;中残,Ⅱ级;重残,Ⅲ级;植物生存,Ⅳ级;死亡,Ⅴ级。

2 结 果
2.1两组手术情况比较 两组患者在h总、失血量、去骨瓣病例数方面比较,差异无统计学意义(P>0.05);观察组h降长于对照组,在再出血发生率、术后24 h血肿清除率、术后48 h脑水肿增加率及1周 GCS评分方面优于对照组,两组比较差异有统计学意义(P<0.05),见表1。
2.2两组术后并发症比较 观察组术后失语、视野缺损及癫痫发生率较对照组低,两组比较差异有统计学意义(P<0.05)。观察组气管切开、肺部感染、颅内感染发生率也低于对照组,但差异无统计学意义(P>0.05),见表2。
2.3两组预后比较 观察组6个月后GOS评分及GOS评分合并项优于对照组,组间比较差异有统计学意义(P<0.05)。见表3、4。
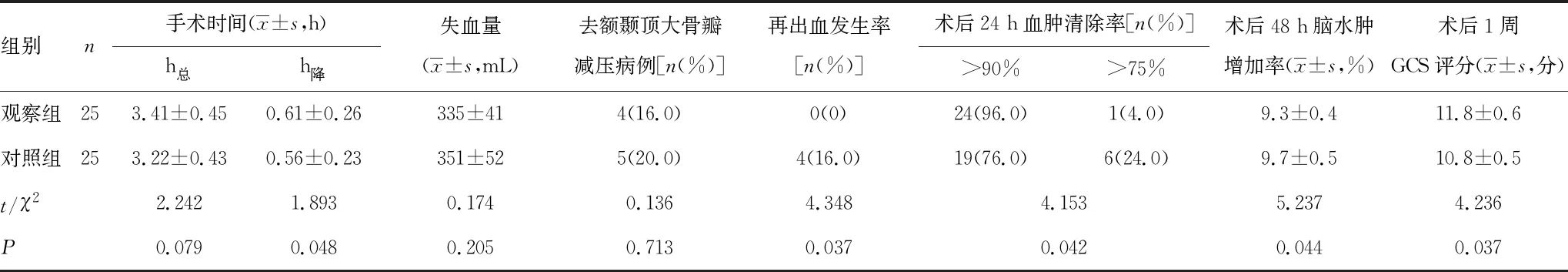
表1 两组手术情况比较

表2 两组术后并发症比较[n(%)]

表3 两组6个月后GOS评分比较(n)

表4 两组6个月后GOS评分合并项比较(n)
3 讨 论
随着显微神经外科技术的发展与应用,针对基底节区脑出血,经侧裂入路及经颞叶皮层血肿清除术是值得推广的两种手术方法[4-6]。侧裂入路解剖点在宽大侧裂前点,但对于基底节区后部出血路径长,有出血点不易控制、血肿不易彻底清除等风险[1,5];在颞叶后部皮质切开虽然路径短,但易伤及颞叶后部及深面的功能区结构[6-8]。本研究采用经侧裂下Rolandic点-岛叶入路与经颞叶皮层治疗基底节区后部血肿对照研究,其结论与大多数学者报道一致[5,9]。本研究结果显示,经下Rolandic点-岛叶入路在再出血发生率、术后24 h血肿清除率、术后48 h脑水肿增加率、术后1周GCS评分、入路相关并发症、预后方面明显优于颞叶皮层入路,是治疗基底节区后部脑出血的有效手段。
下Rolandic点是中央沟下端在外侧裂的投影[10],其与前下方的侧裂前点相距约2.5 cm,由此解剖外侧裂处理基底节后部血肿的优点有:(1)与对照组比较,观察组患者术后6个月GOS评分更优,提示经下Rolandic点-岛叶入路可显着改善患者预后,使一些患者从死亡状态改变为重残或植物状态,以及从重残或植物状态改变为中残或轻残。(2)颞叶皮层造瘘增加了手术入路相关并发症的发生率,术后癫痫、感觉性失语、视野缺损风险明显高于经下Rolandic点-岛叶路,其主要原因在于医源性损伤了颞上回、中回表面后部及深部的功能区结构。观察组上述并发症也有发生,考虑其原因可能为,出血直接破坏了功能区白质纤维,以及侧裂内手术操作也存在轻微的牵拉性损伤。(3)观察组在术后再出血发生率及术后24 h血肿清除率方面均优于对照组(P<0.05),主要因为前者手术路径短、显露充分。下Rolandic点深面是脑岛中后部分,正对基底节后部出血区域,手术路径短。而且由下Rolandic点分离外侧裂可塑性强,术中根据血肿向前或向后分离,并调整岛叶切开方向,操作空间充分,术中便于控制出血点及血肿彻底清除。(4)经下Rolandic点-岛叶入路术后血肿残留少,引起的继发性脑水肿较轻;而皮层造瘘造成的脑损伤及脑水肿相对严重些。因此,术后48 h CT检查结果显示,对照组脑水肿增大率高于观察组(P<0.05),这也是影响术后1周GCS评分因素之一。另外,经下Rolandic点-岛叶入路的缺点在于手术操作相对复杂、费时,故而观察组手术开始至血肿腔压力释放颅压下降时间明显长于对照组,差异有统计学意义(P<0.05)。
经下Rolandic点-岛叶入路关键技术是侧裂无损伤分离,对此笔者的经验如下:(1)侧裂下Rolandic点显露。笔者参考RHOTON[3]进行外侧裂、侧裂前点、下Rolandic点体表定位,选择耳前斜向后上的直切口6~8 cm,下Rolandic点居于骨窗中央,骨窗前下方能够达到解剖侧裂前点。小骨窗开颅术中及时调整骨窗去除方向、范围,满足下Rolandic点-岛叶入路显露,一般头皮切口6.0 cm、骨孔直径2.5~3.0 cm;微骨瓣开颅既要充分显露又要保证骨瓣一次成形,选择稍长手术切口、稍大骨瓣,一般头皮切口8.0 cm、骨瓣直径3.0~3.5 cm。(2)侧裂分离。小骨窗开颅因受血肿挤压,脑组织易从骨窗膨出,使得下Rolandic点处侧裂解剖更加困难。可先挑开侧裂前点蛛网膜释放脑脊液,待脑组织稍塌陷再行解剖。对于下Rolandic点处难以解剖的,可采用水分离技术撑开侧裂[11-13]。在分离的侧裂内填少量明胶海绵或一侧脑板轻轻挡一挡,以保持蛛网膜张力,便于侧裂的进一步分离。也可采用PaperKnife技术[14],即先分离稍深处额颞叶间隙,使得表浅的蛛网膜及粘连如纸样更易解剖。(3)侧裂血管保护。侧裂浅静脉的额支与颞支间无分支血管,侧裂分离应在两者之间进行,而且应尽量避免静脉损伤及过度牵拉。一旦破裂出血,应使用止血纱、小片明胶海绵加脑棉“三明治”压迫,切忌电凝止血;不要盲目地离断侧裂静脉,万一要离断,宁可“丢额保颞”。侧裂深部的走形大脑中动脉及其分支需加以保护,以免损伤造成偏瘫失语。另外,对于脑肿胀、皮层塌陷不明显,以及术前昏迷程度深、严重脑疝等情况,术中及时更改为额颞顶部大骨瓣开颅减压或直接采用大骨瓣开颅是明智的选择;术中出血点确切止血、血肿清除要控制在血脑界面等显微技术,也关乎到手术成败及患者预后。
总之,采用小切口微骨瓣或小骨窗开颅经侧裂下Rolandic点-岛叶入路可有效清除血肿,降低患者视野缺损、失语、癫痫发生率,提高患者远期生存质量,是治疗高血压性基底节区后部脑出血的有效手术方法。



