张天久,俞 松,杨小红,吕 欣,徐艳朋,罗 宇
(遵义医科大学附属医院小儿矫形外科,贵州遵义 563000)
发育性髋关节脱位(developmental dislocation of the hip,DDH)是小儿骨科常见的骨关节畸形之一,致残率较高,治疗不及时或未经正确治疗,易较早出现髋关节退行性变和骨关节炎(osteoarthritis,OA)。研究发现,正常软骨组织中软骨细胞的增殖与凋亡及细胞外基质的降解与合成之间处于一种动态平衡,当这种平衡被打破后即可发生关节退行性变,目前DDH发生髋关节退行性变的机制仍不清楚,可能与髋臼软骨细胞增殖和凋亡异常密切相关[1-2]。白细胞介素-1β(interleukin-1β,IL-1β)和胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)在关节软骨细胞的增殖、发育、成熟和凋亡过程中起重要作用,且两者在软骨细胞中的作用是相互拮抗的[3-4]。本实验通过制作幼兔DDH动物模型,检测不同时期髋臼软骨细胞中IL-1β和IGF-1的表达情况,探讨IL-1β和IGF-1在DDH髋臼软骨细胞增殖和凋亡中的作用和意义,为儿童DDH退行性髋关节炎的预防和治疗提供参考,现报道如下。
1 材料与方法
1.1材料 兔抗IL-1β多克隆抗体(bs-0812R,北京博奥森生物技术有限公司);兔抗IGF-1多克隆抗体(bs-0014R,北京博奥森生物技术有限公司);辣根过氧化物酶标记山羊抗兔IgG(H+L,ZB-2301,北京中杉金桥生物技术有限公司);DAB显色试剂盒(CW0125,北京康为世纪生物科技有限公司);鼠抗GAPDH单克隆抗体(TA-08,北京中杉金桥生物技术有限公司,浓度1/3 000);蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂);超高灵敏度化学发光成像系统[Chemi DocTMXRS+,伯乐生命医学产品(上海)有限公司]。
1.2方法
1.2.1实验动物分组及模型制作 4周龄实验幼兔40只,雌雄不限,平均体质量(0.45±0.06)kg;采用硫喷妥钠肌肉注射麻醉,左侧后肢伸膝屈髋位管型石膏固定,右侧后肢不做特殊处理作为对照侧。实验8周后摄髋关节正位片了解造模情况,根据实验侧Shenton线不连续、髋臼指数增大和股骨头位于Perkin方格外侧象限判定为DDH造模成功[5],造模不成功影响实验进程需积极补充造模。选取造模成功的幼兔继续进行实验,分为A、B、C、D 4组,每组8只,分别在石膏固定8、12、16、20周后,采用空气栓塞法处死,在无菌条件下解剖双髋,将双侧髋臼边缘软骨块分为两部分,一部分迅速放入-80 ℃液氮保存,一部分放入10%中性甲醛液固定。
1.2.2免疫组织化学染色检测IL-1β和IGF-1的表达情况 用10%中性甲醛液固定标本,然后行脱钙、脱水、石蜡包埋、3~4 μm切片,常规脱蜡水化后,进行抗原修复,滴加3% H2O2消除组织内源性过氧化物酶的活性,切片封闭后,逐步滴加IL-1β一抗(1∶200)或IGF-1一抗(1∶400)、4 ℃冰箱过夜,室温下孵育45 min,滴加山羊抗兔IgG(H+L)二抗工作液和DAB显色剂工作液,苏木素复染,脱水、透明、封片,镜下观察染色切片,软骨细胞的细胞质或细胞核被染成黄色或棕黄色为阳性,阴性对照用磷酸盐缓冲液(PBS)代替一抗,并用目镜网格测微尺随机选择6个视野(×400)进行观察,记录阳性细胞数量。阳性率用细胞分数来表示,即6个视野内阳性软骨细胞数占软骨细胞总数的比值×100%。
1.2.3Western blot法检测IL-1β和IGF-1的蛋白水平 取出用液氮保存的标本,取0.2 g组织放入研钵中充分研磨,加入500 μL的细胞裂解液研磨至匀浆无明显颗粒,高速离心15 min,BCA蛋白定量法测定蛋白浓度,取上清液移至新的EP管,提取等量蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后转至聚偏氟乙烯(PVDF)膜封闭,加入IL-1β或IGF-1一抗(1∶1 000),4 ℃摇床过夜,37 ℃水浴复温后加二抗(1∶1 000),孵育后漂洗显色,用GAPDH 做内参重复上述步骤,用Quatity One软件扫描各条带灰度值后进行定量分析(目的蛋白相对水平计算公式:目的蛋白灰度值/GAPDH灰度值)。

2 结 果
2.1幼兔DDH造模情况 幼兔在造模过程中肢体活动受限,进食减少,部分幼兔死亡,无关节感染及骨折并发症发生,但经过积极补充造模,未影响实验正常进行。实验过程中共造模成功32只,分成4组,每组8只。
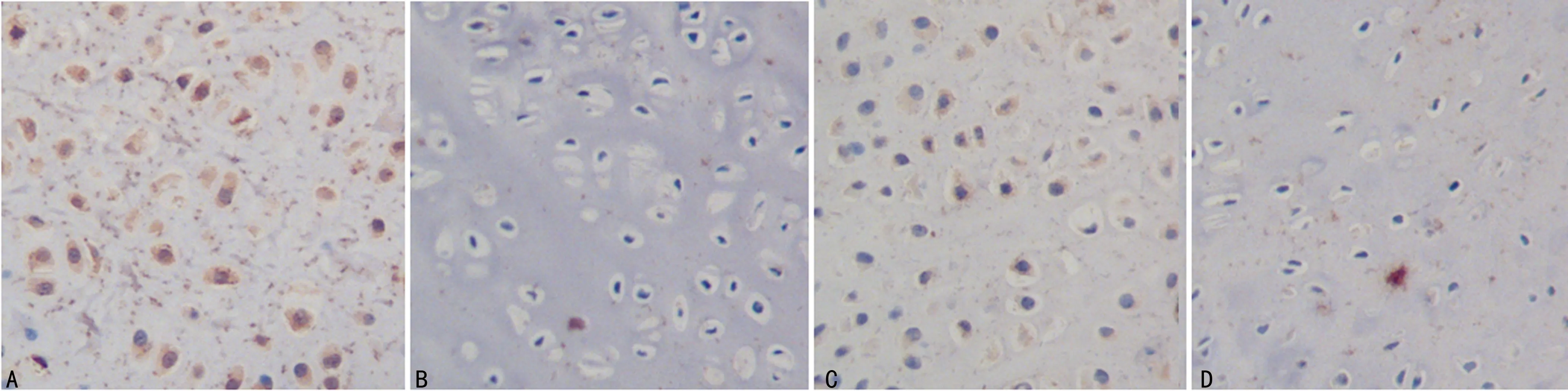
A、C:IL-1β和IGF-1在DDH实验侧髋臼软骨中的表达,细胞质被染成黄色或淡黄色;B、D:IL-1β和IGF-1在DDH对照侧髋臼软骨中的表达,细胞质未见明显着色
图1IL-1β和IGF-1在髋臼软骨中表达(免疫组织化学,×400)
2.2免疫组织化学法检测IL-1β和IGF-1在髋臼软骨细胞中的表达 IL-1β和IGF-1在每组实验侧和对照侧的髋臼软骨细胞中均有不同程度的表达,软骨细胞细胞质被染成黄色或棕黄色。IL-1β在4组中实验侧髋臼软骨中阳性率逐渐增高,B、C和D组实验侧和对照侧比较,差异有统计学意义(P<0.05)。IGF-1在C组实验侧髋臼软骨细胞中的阳性率最高,B、C组实验侧和对照侧比较,差异有统计学意义(P<0.05),见图1,表1、2。

表1 各组髋臼软骨细胞中IL-1β阳性率的变化情况

表2 各组髋臼软骨细胞中IGF-1阳性率的变化情况
2.3Western blot法检测IL-1β和IGF-1在髋臼软骨细胞中的表达水平 IL-1β在实验侧髋臼软骨细胞中的表达水平逐渐增加,在D组中的水平最高,B、C、D组实验侧和对照侧比较,差异有统计学意义(P<0.05)。IGF-1在B组实验侧髋臼软骨细胞中的表达水平最高,B、C组实验侧和对照侧比较,差异有统计学意义(P<0.05),见图2,表3、4。
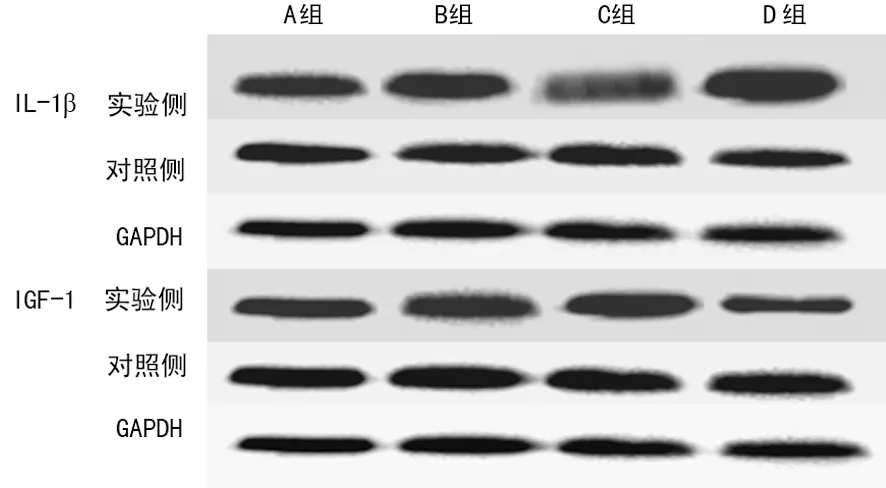
图2 各组髋臼软骨细胞中IL-1β和IGF-1蛋白水平Western blot表3 各组髋臼软骨细胞中IL-1β的蛋白水平比较
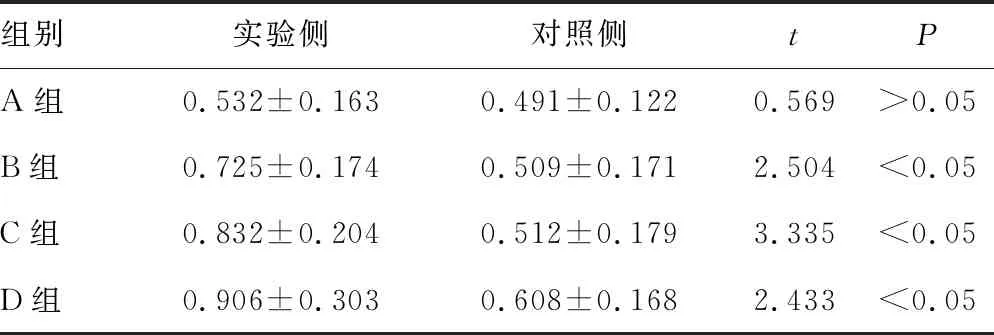
组别实验侧对照侧tPA组0.532±0.1630.491±0.1220.569>0.05B组0.725±0.1740.509±0.1712.504<0.05C组0.832±0.2040.512±0.1793.335<0.05D组0.906±0.3030.608±0.1682.433<0.05

表4 各组髋臼软骨细胞中IGF-1的蛋白水平比较
3 讨 论
DDH是一种儿童早期出现的髋关节发育异常性疾病,可能会随着生长发育好转或加重,若伴有不同程度的髋臼发育不良,易早期发生髋关节退行性变。软骨细胞是关节软骨中的惟一细胞类型,维持着软骨细胞和细胞外基质的动态平衡,儿童髋臼软骨细胞还有软骨内化骨,促进髋臼生长发育的作用。研究发现髋臼软骨细胞的增殖与凋亡活性异常在DDH的发展过程中有着重要意义[1],但具体机制仍不清楚。损伤性细胞因子IL-1β和合成性细胞因子IGF-1是软骨细胞在增殖和凋亡过程中重要的细胞因子,对DDH髋臼软骨细胞的增殖和凋亡也可能有着重要的调控作用。
IL-1β是一种主要的关节软骨退变代谢调节因子,与软骨破裂、基质降解密切相关,可诱导软骨细胞变性和衰老,对软骨细胞凋亡起到重要的调控作用,是OA的主要病因之一[6-7]。IL-1分为IL-1α和IL-1β两种类型,正常软骨细胞可产生少量的IL-1β,当其损伤后可大量合成和分泌大量的IL-1β,并刺激细胞膜上IL-1β受体表达增高,IL-1β与受体结合后将病变的信息传送到细胞内,从而影响了软骨细胞的正常代谢活动,刺激软骨细胞分泌基质金属蛋白酶,加速软骨基质中蛋白多糖及胶原蛋白的降解,抑制蛋白多糖和胶原蛋白的合成,促进软骨细胞凋亡的发生[8-9]。将 IL-1β加入到培养的软骨细胞中,诱发型一氧化氮合酶(iNOS)水平显着增高,一氧化氮合成、释放增加,诱发关节软骨细胞凋亡[10];实验表明OA患者的关节软骨中IL-1β有较高水平的表达[11]。在本实验幼兔DDH动物模型中,免疫组织化学法和Western blot法检测结果均提示实验侧髋臼软骨中IL-1β的水平高于对照组,且随着脱位时间的延长,差异越显着,这可能与DDH自然病程密切相关,即当髋臼和股骨头失去正常的解剖对位关系和生物力学刺激后,可导致了髋臼软骨的损伤和退行性变,诱发和加速髋臼软骨细胞的凋亡。本研究提示IL-1β可能是促进DDH髋臼软骨细胞凋亡的原因之一。
IGF-1是一种具有胰岛素样合成代谢作用和促生长作用的多肽生长因子,促进软骨细胞的增殖、表型的维持和软骨细胞外基质的合成,抑制各种原因诱导的软骨细胞的凋亡[12]。IGF-1在青春期前可通过刺激软骨细胞的增殖和塑形使骨骼呈线性生长,在成人通过刺激软骨细胞合成基质蛋白,抑制软骨细胞的衰老和凋亡;IGF-1同样也能抑制IL-1β诱导的软骨细胞凋亡和对抗IL-1β引起的炎性介质MMP-13[13-14],IGF-1还可联合透明质酸促进大鼠股骨关节软骨缺损的修复,延缓周围软骨的退变[15]。本实验B、C组中实验侧髋臼软骨细胞中IGF-1表达和蛋白水平都较高,可使髋臼软骨细胞保持着较高的增殖活性,抑制IL-1β诱导的软骨细胞凋亡,尚能维持髋臼软骨细胞增殖和凋亡之间的动态平衡,但随着DDH自然病程的延长,髋臼软骨细胞的增殖能力逐渐减弱,即发生髋臼软骨不可逆性的损伤,这和DDH自然病程基本一致,但具体机制仍需要进一步研究。IL-1β和IGF-1在DDH早、中期髋臼软骨中都有较高的表达,但后期IGF-1的表达减弱,提示DDH髋臼软骨细胞在早、中期表现出较强的增殖活性与异常增高的凋亡率,后期增殖活性明显减弱,这与部分文献报道基本一致[1-2],IL-1β与IGF-1在DDH髋臼软骨细胞中的表达异常,导致增殖活性和凋亡率之间失衡,可能是DDH发生髋关节退行性变的原因之一。
本实验制作的幼兔DDH动物模型可模拟人类DDH的自然病程和髋关节的病理生理变化过程,若早期对DDH进行干预和治疗,恢复髋关节的解剖关系及相应的生物力学环境,可能会改变这一自然病程,延缓退行性髋关节炎的发生。若本课题组在治疗DDH时再采用其他方式进行干预,调控髋臼软骨中IL-1β和IGF-1的生物学活性,维持髋臼软骨细胞增殖和凋亡活性的动态平衡,或许在一定程度上能延缓或减少髋关节退行性变的发生,而这需要进一步的实验研究。



