林卓鹏,刘 念,李集源,张艳静,张忠其△
(1.顺德和平外科医院麻醉科,广东佛山 528308;2.南方医科大学顺德医院麻醉科,广东佛山 528308)
经腋路臂丛神经阻滞已广泛应用于上肢手术,与全身麻醉相比,不良反应及术后镇痛需求方面具有一定优势。在外周神经阻滞麻醉中,为提高其安全性,降低局部麻醉(局麻)药中毒的风险,希望使用较低剂量的局麻药以达到良好的阻滞效果。有些研究将右美托咪定、阿片类、地塞米松等药物作为佐剂添加至局麻药中不但可以降低局麻药所需浓度,还可以缩短阻滞起效时间、延长阻滞时间,极大地提高了外周神经阻滞质量[1-3]。也有研究使用不同温度的局麻药进行外周神经阻滞,结果同样发现能影响其浓度、剂量及起效时间[4-6]。温度越低需要阻断神经所需要的局麻药浓度越低[4],然而,不同温度罗哌卡因用于外周神经阻滞最低有效浓度还未知。本研究将采用两种不同温度的罗哌卡因(4 ℃及23 ℃)经超声引导下腋路臂丛神经阻滞半数有效浓度(EC50)的影响,为临床麻醉使用低温罗哌卡因提供用药参考。
1 资料与方法
1.1一般资料 选择2018年7-8月顺德和平外科医院择期行单侧手部手术的患者60例,美国标准协会(ASA)分级Ⅰ~Ⅱ,随机分为2组,每组30例,A组为低温罗哌卡因,B组为室温罗哌卡因,每组容量定量为25 mL。排除标准:无本研究所用药物过敏史,无经腋路臂丛神经阻滞禁忌证,近期无使用其他镇痛药物史等。两组患者男女比例、年龄、身高、体质量、基础平均动脉压(MAP)、神经阻滞30 min后MAP、基础心率(HR)、神经阻滞30 min后HR、手术时间、麻醉维持时间两组差异无统计学意义(P>0.05),见表1。本研究经医院伦理委员会批准,并与患者家属签订麻醉知情同意书。
1.2麻醉方法 本研究手术室温度设定在23 ℃,所有患者入室后均常规吸氧并连接多功能监护仪监测MAP、HR、心电图(ECG)与血氧饱和度(SpO2)并使用加温系统对患者上半身进行加温处理,加温系统温度设置为40 ℃,将测温探头置入患者前额皮肤,持续监测前额皮肤体表温度。神经阻滞技术操作参照前期研究[7]:常规开放外周静脉通道,患者仰卧位,上肢外展90°,将高频线状探头放置于胸大肌与肱二头肌交点,探头扫描呈矢状面且与腋动脉走行相垂直。在超声图像上识别搏动的腋动脉,以及与动脉相伴行的腋静脉,加压探头可使静脉闭合。腋动脉周围可见臂丛神经的分支,它们在超声图像显示为中间呈低回声、外周呈高回声的小圆圈结构。采用长轴平面内技术,穿刺针由超声探头外侧进针,采用多点注射技术分别阻滞位于动脉后外侧的桡神经、上内方的尺神经、上外方的正中神经,以及位于肱二头肌及喙肱肌肌筋膜之间的肌皮神经。根据下一患者浓度,A组预先用生理盐水稀释好的罗哌卡因25 mL密封无菌保存在4 ℃冰箱30 min,B组按照手术室温度保存好的药液稀释后注射。注药后30 min内每5 min测定桡神经、正中神经、尺神经和肌皮神经皮肤阻滞区域疼痛感觉(针刺痛觉评分标准:正常0分、减退1分、痛觉消失2分),测定痛觉消失时间,即麻醉起效时间,痛觉消失2分至正常0分,即为阻滞持续时间。两组初始的罗哌卡因浓度设定为0.5%,以医学序贯实验方法(up-down method)确定下一患者罗哌卡因浓度。若阻滞开始至30 min内感觉神经被阻滞能满足手术切皮要求则定义为“成功”,否则定义为“失败”。如“成功”,下一患者则降低一个浓度,相反则升高一个浓度,浓度相差比值为1.2。对神经阻滞效果不全的病例,加用舒芬太尼0.1~0.2 μg/kg静脉注射行强化麻醉;仍不能满足手术要求者,改行全身麻醉。以术中心率及血压变化降低为基础值的20%定义为心率减慢和血压降低;以术中SpO2低于90%定义为呼吸抑制;以前额皮肤体表温度低于36 ℃为低体温。当出现心率减慢或血压降低时,使用阿托品或麻黄素进行处理;当出现呼吸抑制时,充分给氧,必要时正压通气。
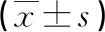
表1 两组患者一般资料比较
-:无数据
1.3观察指标 按顺序记录所有患者用药浓度,记录入室和神经阻滞30 min后的MAP、HR,记录麻醉维持时间,不良反应(恶心、呕吐、寒颤、低体温、注射痛、呼吸抑制、低心率、低血压、止血带反应)等。

2 结 果
2.1两组患者不良反应比较 恶心、呕吐、寒颤、注射痛、呼吸抑制、低心率、低血压、止血带反应等两组比较差异无统计学意义(P>0.05)。见表2。

表2 两组患者不良反应比较(n)
-:无数据
2.2两组患者序贯法反应趋势图比较 两组第1例患者使用罗哌卡因浓度统一设置为0.5%,A组其中20例取得“成功”,10例“失败”,具体分布顺序见图1。B组其中17例取得“成功”,13例“失败”,具体分布顺序见图2。

图1 A组30例患者罗哌卡因浓度序贯图

图2 B组30例患者罗哌卡因浓度序贯图
2.3两组罗哌卡因EC50值 根据序贯法Massey公式计算得出A组罗哌卡因的EC50为0.203%(95%CI:0.163%~0.252%),B组罗哌卡因的EC50为0.322%(95%CI:0.300%~0.345%),两组比较差异有统计学意义 (P<0.05)。
3 讨 论
罗哌卡因作为一种长效局麻药,具有比布比卡因更低的亲脂性,因此心血管及神经系统毒性也更低,目前常应用于外周神经阻滞。虽然毒性较低,但仍然有进入血管造成局麻药中毒可能,因此,应用最合适的浓度或容量在保证麻醉质量的同时又能将局麻药中毒概率降低至最低。ROSENBERG等[4]研究显示,阻断大鼠坐骨神经随着温度的下降所需要的利多卡因浓度也越低。本研究将低温与室温罗哌卡因应用于超声引导下经腋路臂丛神经阻滞,发现A组罗哌卡因EC50为0.203%(95%CI:0.163%~0.252%),B组为0.322%(95%CI:0.300%~0.345%),A组罗哌卡因EC50低于B组,差异有统计学意义(P<0.05)。可见,将局麻药进行低温处理后应用于外周神经阻滞能达到明显降低局麻药所需浓度。
虽然低温本身不能产生麻醉作用,但是低温能使组织局部血管收缩,作用于神经产生类似于局部麻醉样效果。局麻药与温度的改变都会影响神经膜蛋白的构像发生变化,从而影响钠通道通透性。有研究显示,温度越低引起动作电位阈电位越高,其阻断作用越强,因此低温局麻药就能产生越强的麻醉作用[7]。笔者前期研究结果显示,使用低温局麻药能产生更强的麻醉作用,麻醉起效时间更快,维持时间更长[8]。本研究根据痛觉消失的时间定义为阻滞起效时间,痛觉消失2分至正常0分定义为阻滞维持时间,从两组序贯图可以发现,上下患者使用的罗哌卡因浓度并不一致,低温组更多患者使用罗哌卡因浓度较室温组低,结果却显示低温组阻滞起效时间稍快、麻醉维持时间稍长,虽然临床上差异无统计学意义(P>0.05),但提示,如果浓度统一,低温罗哌卡因在阻滞起效时间及维持时间上有的一定的优势,这也可能与笔者前期的研究结果相一致。也有研究使用更高温度局麻药,发现能同时加快感觉与运动阻滞时间[9],还能有效减少寒颤发生率[10]。本研究使用低温(4 ℃)罗哌卡因注射过程中并没有发现患者有寒颤反应,体温监测过程中并未发生低体温现象,其原因可能是:(1)4 ℃局麻药容量较小,不足以影响体温变化;(2)整个围术期笔者给予患者适当的保温措施。
BAINBRIDGE等[11]认为体温与室温局麻药相比,室温产生的注射痛更加明显。但也有研究认为,注射前将局麻药进行加热没有任何好处[12]。注射痛的产生与注射速度、注射部位及参与者年龄密切相关[13]。在临床麻醉操作过程中通常通过降低注药速度以达到有效降低注射痛的产生。虽然有学者有不同的意见,但是HOGAN等[13]通过Meta分析发现,将局麻药加温能明显减少注射痛发生率。本研究采用A组采用的是4 ℃的罗哌卡因进行注射,30例患者中出现了3例注射痛,虽然与B组差异无统计学意义(P>0.05),但是为了降低注射痛的发生率,应该相应地减慢注药速度。
SONG等[14]发现,经超声锁骨上臂丛神经阻滞使95%患者最低有效容量为17 mL。与经锁骨上臂丛不同,腋路臂丛神经更加分散,所需要的麻药容量会更大,一般采用30~40 mL局麻药能获得较好的麻醉效果,在超声技术引导下,可以进一步降低所需容量。本研究罗哌卡因采用的总容量为25 mL,除桡神经给予7 mL,正中神经、尺神经与肌皮神经均给予6 mL。前期研究结果发现,每支神经6 mL的容量就能提供足够的手术镇痛需求。可见,本研究罗哌卡因总容量为25 mL是合理的。
医学序贯法最大的优势就是利用最小的样本量可以得到较为准确的结果[15],但作为本研究的方法,也存在最大的局限性。因为使用这种实验方法得出的罗哌卡因浓度会影响到下一患者浓度选择,而每个个体对疼痛的敏感程度不同就会导致整体结果的不准确,反过来就需要更多的样本量,才可能得到更加准确的结果。另外,其他温度的罗哌卡因如何影响其结果尚需要进一步研究。
综上所述,使用低温(4 ℃)罗哌卡因进行外周神经阻滞能明显降低其EC50,无明显不良反应,值得临床推广应用。



