彭官清,凌 乔,余舒莹
(1.浙江省台州市温岭市第一人民医院感染科 317500;2.浙江省杭州市儿童医院药剂科 310013)
肺炎是指由理化因素、微生物等造成的终末气道、肺泡及肺间质的炎症,最常见的为细菌性肺炎,细菌性肺炎最常见的革兰阴性条件致病菌为肺炎克雷伯杆菌,肺炎克雷伯杆菌是婴儿和新生儿医院获得性肺炎的常见致病菌,严重可危及患儿生命[1-2]。肺部感染后可产生大量炎性细胞因子加重炎症症状[3],核因子-κB(NF-κB) p65和IκB激酶α(IκBα)蛋白在呼吸道炎症中发挥关键作用[4],为目前肺炎药物开发的潜在靶点之一。miRNA-155在炎症、免疫反应、心血管功能等方面具有重要作用,在呼吸系统疾病中,miRNA-155参与肺癌、哮喘、肺结核等疾病的形成过程[5],在肺炎的发生中也具有重要作用[6],但miRNA-155是否通过NF-κB通路参与肺炎的发生、发展过程尚不清楚。本文对重症肺炎大鼠肺组织中miRNA-155表达及过表达miRNA-155对肺组织NF-κB信号通路及其下游炎性细胞因子水平的影响进行研究,以为临床重症肺炎的诊治提供新的思路。
1 材料与方法
1.1材料 实验动物:健康、雌雄各半的SD大鼠45只,体质量180~220 g,购自上海斯莱克实验动物有限公司,动物许可证号为SCXK(沪)2012-0002。主要试剂:兔抗pp65单克隆抗体、兔抗p65单克隆抗体、兔抗磷酸化IκBα(p-IκBα)单克隆抗体、兔抗IκBα单克隆抗体等抗体购自美国Sigma公司,酶联免疫吸附测定(ELISA)试剂盒、二喹啉甲酸(BCA)蛋白定量试剂盒、反转录-聚合酶链反应(RT-PCR)试剂盒、化学发光(ECL)发光液购自美国RB公司,肺炎克雷伯杆菌由温岭市第一人民医院检验科提供(将肺炎克雷伯杆菌在琼脂平皿中培养18 h,调整浓度为1.5×109cfu/mL),miRNA-155 mimics由上海吉玛生物科技有限公司设计合成。
1.2方法
1.2.1大鼠分组及处理 将45只大鼠根据随机数字表法分为对照组、肺炎组(肺炎模型)、miRNA-155组(肺炎模型+miRNA-155 minics),每组15只。将大鼠水合氯醛麻醉成功后,消毒颈部皮肤,切开颈部皮肤暴露上段气管,miRNA-155组将40 μg miRNA-155 mimics滴入气管,对照组和肺炎组滴入等量生理盐水,24 h后,肺炎组和miRNA-155组用注射器将0.15 mL菌液滴入气管,对照组大鼠滴入等量生理盐水。给药后将大鼠直立保持30 s,使接种菌液因重力作用进入肺组织,然后缝合伤口,局部消毒。
1.2.2标本采集 给药24 h后,水合氯醛麻醉大鼠,抽取颈静脉血5 mL,分离血清进行血清中白细胞介素(IL)-1β、IL-6、肿瘤坏死因子α(TNF-α)水平测定;颈动脉放血处死大鼠,迅速开胸,取出左肺组织用于苏木精-伊红(HE)染色,右肺组织置于液氮中用于肺组织中miRNA-155、IL-1β、IL-6、TNF-α水平和pp65、p65、p-IκBα、IκBα蛋白水平测定。
1.2.3肺组织中miRNA-155水平测定 取80 mg左右肺组织,按照试剂盒说明书提取肺组织总RNA,根据反转录试剂盒说明书将RNA反转录合成cDNA,采用RT-PCR测定肺组织miRNA-155(上游引物:5′-UUA ALU GGU AAU UGU CAU ACG GGU-3′,下游引物:5′-CCC UAU GAC AAU UAC CAU UAA UU-3′)水平,RT-PCR反应条件为:56 ℃ 2 min,95 ℃ 2 min;95 ℃ 30 s,60 ℃ 30 s,共40个循环;20 ℃ 2 min,以U6为内参基因,miRNA-155相对表达量以2-ΔΔCT表示。
1.2.4肺组织HE染色 将肺组织 在多聚甲醛溶液中固定,固定后取出放入脱水机中脱水,透明、浸蜡过夜,包埋机进行石蜡包埋,将石蜡块切成厚4 μm切片,烤片机中烤片15 min,脱蜡、苏木精染色8 min,放入盐酸乙醇中3 s,放入氨水中5 s,放入伊红中染色2 min,二甲苯透明、中性树胶封片,显微镜下观察HE染色情况。
1.2.5肺组织匀浆中IL-1β、IL-6及TNF-α水平测定 将肺组织于生理盐水中搅碎匀浆化,再将匀浆的肺组织离心收集上清液,采用ELISA法测定肺组织匀浆中IL-1β、IL-6及TNF-α水平。
1.2.6血清中IL-1β、IL-6及TNF-α水平测定 将大鼠颈静脉血5 mL离心取血清,采用ELISA法测定血清中IL-1β、IL-6及TNF-α水平。
1.2.7肺组织pp65、p65、p-IκBα及IκBα蛋白水平测定 取适量肺组织加入裂解液和蛋白酶抑制剂,采用超声破碎成组织匀浆,将匀浆组织置于冰中裂解,提取肺组织总蛋白,测定蛋白水平,采用Western blot测定肺组织pp65、p65、p-IκBα、IκBα蛋白水平:将蛋白上样、凝胶电泳、湿法转膜,加入一抗(兔抗pp65单克隆抗体、兔抗p65单克隆抗体、兔抗p-IκBα单克隆抗体、兔抗IκBα单克隆抗体)过夜孵育,以β-actin为内参,加入二抗孵育2 h,加入ECL曝光液曝光,采用Quantity one软件分析各条带灰度值。


A:对照组;B:模型组;C:miRNA-155组
图1 3组大鼠肺组织HE染色(×400)
2 结 果
2.13组大鼠肺组织中miRNA-155水平比较 3组大鼠肺组织中miRNA-155水平比较,差异有统计学意义(P<0.01)。与对照组(1.00±0.07)比较,肺炎组大鼠肺组织miRNA-155水平(0.36±0.05)明显降低(P<0.05);与肺炎组比较,miRNA-155组大鼠肺组织miRNA-155水平(0.82±0.06)明显升高(P<0.05)。
2.23组大鼠肺组织HE染色比较 对照组大鼠肺小叶结构清晰,支气管黏膜上皮完整,肺泡腔结构完整,间质无炎性细胞浸润;模型组大鼠用药后1 d肺组织结构消失,肺泡萎陷,肺泡腔内有渗出、出血,肺泡间隔断裂、增宽,血管扩张充血,见大量炎性细胞浸润,表明重症肺炎模型建模成功;miRNA-155组大鼠肺泡腔渗出、出血和炎性细胞浸润较肺炎组减轻,见图1。
2.33组大鼠肺组织匀浆中IL-1β、IL-6及TNF-α水平比较 与对照组比较,肺炎组大鼠肺组织匀浆中IL-1β、IL-6、TNF-α水平明显升高(P<0.05);与肺炎组比较,miRNA-155组大鼠肺组织匀浆中IL-1β、IL-6、TNF-α水平明显降低(P<0.05),见表1。
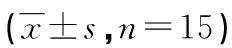
表1 3组大鼠肺组织中IL-1β及IL-6等
a:P<0.05,与对照组比较;b:P<0.05,与肺炎组比较
2.43组大鼠血清中IL-1β、IL-6及TNF-α水平比较 与对照组比较,肺炎组大鼠血清中IL-1β、IL-6、TNF-α水平明显升高(P<0.05);与肺炎组比较,miRNA-155组大鼠血清中IL-1β、IL-6、TNF-α水平明显降低(P<0.05),见表2。
2.53组大鼠肺组织NF-κB信号通路蛋白水平比较 3组大鼠肺组织中p65、IκBα蛋白表达水平比较,差异无统计学意义(P>0.05)。3组大鼠肺组织中pp65、p-IκBα蛋白表达水平比较,差异有统计学意义(P<0.05),与对照组比较,肺炎组大鼠肺组织pp65、p-IκBα蛋白表达水平明显升高(P<0.05);与肺炎组比较,miRNA-155组大鼠肺组织中pp65、p-IκBα蛋白水平明显降低(P<0.05),见表3、图2。
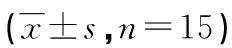
表2 3组大鼠血清中IL-1β及IL-6等
a:P<0.05,与对照组比较;b:P<0.05,与肺炎组比较
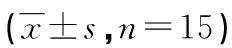
表3 3组大鼠肺组织NF-κB信号通路蛋白相对表达水平比较
a:P<0.05,与对照组比较;b:P<0.05,与肺炎组比较

A:对照组;B:肺炎组;C:miRNA-155组
图2 3组大鼠肺组织中相关蛋白Western blot电泳图
3 讨 论
肺炎克雷伯杆菌是非常常见的一种革兰阴性条件致病菌,当侵入下呼吸道时可引起肺泡毛细血管充血水肿,肺泡内炎性细胞浸润和红细胞渗出[7],本文通过向大鼠气道内滴入克雷伯杆菌建立大鼠重症肺炎模型,发现用药后1 d,大鼠肺组织结构消失,肺泡萎陷,肺泡腔内有渗出、出血,肺泡间隔断裂、增宽,血管扩张充血,见大量炎性细胞浸润,表明重症肺炎模型建模成功。
miRNA是长约22个碱基、非编码、内源性、单链RNA,可与靶向mRNA的3′端非编码区结合使其降解或阻止其翻译,在转录后水平调控相关基因的表达[8-9]。人类大部分基因受miRNA调控,miRNA的功能涉及细胞分化、增殖、凋亡、代谢等多种细胞进程[10]。miRNA-155为miRNAs重要成员之一,参与病毒感染、造血、免疫应答等多种细胞功能调控[11];miRNA-155在T细胞应答和B细胞应答中发挥重要作用,固有免疫中Toll样受体配体可以通过TIR结构域衔接蛋白(TRIF)信号通路或髓样分化因子88(MyD88)上调miRNA-155水平,miRNA-155和转化生长因子激酶1(TAK1)相关结合蛋白2(TAB2)结合抑制Toll样受体信号通路中的NF-κB表达,负反馈调节脂多糖介导的炎症介质的表达;miRNA-155在肺癌、肺结核、肺纤维化、哮喘等肺部疾病的形成中也发挥重要作用,miRNA-155通过介导多种细胞因子表达参与肺部疾病的发生、发展[12-13]。本研究发现重症肺炎大鼠肺组织中miRNA-155水平降低,表明miRNA-155参与重症肺炎的发生、发展。
炎性细胞因子在重症肺炎的发生过程中发挥重要作用,IL-1β为在机体感染时由内皮细胞、单核细胞、成纤维细胞等细胞产生的细胞因子,可刺激血小板生长因子、集落刺激因子等细胞因子的产生,可使T细胞产生IL-2,在组织修复和免疫应答中发挥重要作用;可介导B细胞活化、增殖和分化,在炎性反应中发挥重要作用,在肺炎患者中IL-1β水平升高[14]。IL-6由T淋巴细胞、单核巨噬细胞、B淋巴细胞、上皮细胞及多种肿瘤细胞产生,可诱导B细胞分化、诱导IL-2表达、增强NK细胞活性等;IL-6也是介导机体炎性反应的细胞因子,是炎性反应的重要递质,在肺炎中IL-6水平升高[15]。TNF-α由活化的巨噬细胞和单核细胞产生,生物活性复杂,参与感染、炎症和免疫反应的调控,可促进白细胞聚集到炎症部位并活化,从而加重炎性反应,肺炎中TNF-α水平升高[16]。NF-κB可特异性与增强子κB位点或多种基因启动子位点结合,并促进其转录,NF-κB在细胞最常见的形式为p65和p50形成的二聚体[17],在未受刺激时,二聚体与IκB结合,在机体受到刺激时,IκB被降解并磷酸化,释放p65,使p65从细胞质中转移到细胞核内,从而发挥对炎症相关基因表达的调节[4,18]。NF-κB与IL-1β、IL-6、TNF-α等炎性细胞因子形成复杂的调控网络,调控肺炎的发生过程[19]。
本研究发现,重症肺炎大鼠IL-1β、IL-6、TNF-α水平和pp65、p-IκBα蛋白水平升高;上调肺组织中miRNA-155水平后,IL-1β、IL-6、TNF-α水平和pp65、p-IκBα蛋白水平降低。可见重症肺炎大鼠肺部炎症的发生可能为细菌感染肺组织后激活NF-κB信号通路,NF-κB信号通路的激活调控下游的IL-1β、IL-6、TNF-α细胞因子水平,使肺组织中IL-1β、IL-6、TNF-α细胞因子水平升高,从而引起肺组织的炎性损伤;过表达miRNA-155干预后,可明显降低肺组织炎性反应,其机制可能为过表达miRNA-155干预增加肺组织miRNA-155水平,miRNA-155参与T细胞应答和B细胞应答过程,通过和TAB2结合,抑制Toll样受体信号通路中的pp65、p-IκBα蛋白水平,抑制NF-κB信号通路,NF-κB信号通路的抑制负反馈调节肺炎克雷伯杆菌引起的IL-1β、IL-6、TNF-α等炎症介质的表达,减轻炎性反应对肺组织的损伤,从而发挥对肺组织的保护作用。
综上所述,重症肺炎肺组织中miRNA-155水平降低,过表达miRNA-155可降低重症肺炎肺组织的炎性反应,其机制可能与miRNA-155抑制NF-κB信号通路有关。由此可见,miRNA-155有望成为重症肺炎治疗的潜在靶点。



