应晓媚,刘秀静
(1.浙江省温州市中医院病理科 325000;2.温州医科大学附属第二医院检验科,浙江温州 325000)
胃癌是起源于胃黏膜上皮的恶性肿瘤,位于我国恶性肿瘤发病率的首位,其主要发病年龄为50岁及以上,男女比例为2∶1,具有明显的地域差别[1-3]。由于早期胃癌诊断缺乏有效的特异性临床生物学指标,且大部分早期胃癌患者无明显临床症状,所以临床上发现胃癌多已属中、晚期。有研究表明,胃癌的发生通常受到遗传、环境等多种因素影响。随着现代医疗水平的不断提高,逐渐有研究发现胃癌组织通常会伴随环氧合酶-2(cyclooxygenase-2,COX-2)表达升高,且多数学者研究证实COX-2选择性抑制剂具有良好的抗肿瘤治疗效果[4-7]。肿瘤的发生基础为新生血管是目前临床医师广泛接受的理论,人体肿瘤细胞通过刺激炎性细胞后释放血管新生相关因子,故血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种具有高度特异性的促进血管内皮细胞生长的因子[8-10]。大量临床研究表明,部分肿瘤患者血清成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)水平明显高于身体健康者,因此肿瘤患者的血清FGF2水平可作为临床专科医师进行肿瘤诊断及预后评估的潜在可靠指标[11-14]。微卫星不稳定性是一种遗传性改变,现通常将微卫星不稳定性阳性的胃癌划分为高微卫星不稳定性与低微卫星不稳定性[11,15-16]。既往对于胃癌COX-2、VEGF、FGF2的表达水平及胃癌中微卫星不稳定研究较多,但研究COX-2、VEGF、FGF2与微卫星不稳定性关系的相关性研究较少,故本研究选取确诊为胃癌的67例患者的临床资料进行回顾性研究,分析胃癌中COX-2、VEGF、FGF2的表达及其与微卫星不稳定性的关系,现报道如下。
1 资料与方法
1.1一般资料 选取温州市中医院2014年1月至2018年6月确诊为胃癌的67例患者作为研究对象,其中男44例,女23例,年龄38~75岁,平均(58.12±3.59)岁,胃肠外科手术切除的胃癌及相应癌旁正常组织标本各67例用于研究胃癌中COX-2、VEGF、FGF2的表达及其与微卫星不稳定性的关系,标本切除后立即冻存,每个标本一部分用于DNA抽提,剩余部分由10%甲醛将其固定后石蜡包埋,切片由苏木素-伊红染色,所有标本均由两位经验丰富的病理科医师做出病理诊断,排除具有肿瘤家族史及既往接受过放疗和化疗的患者。
1.2方法
1.2.1免疫组织化学染色法检测COX-2、VEGF、FGF2表达 石蜡包埋标本层厚4 μm进行连续切片后常规脱蜡,切片放置于柠檬酸缓冲液中进行微波加热修复抗原,其一抗为浓度为1∶200的山羊抗人COX-2多克隆抗体,浓度为1∶200的山羊抗人VEGF多克隆抗体,浓度为1∶200的山羊抗人FGF2多克隆抗体,过夜孵育后进行生物素化二抗,其细胞核用苏木素复染中性树脂进行封片;以细胞质或细胞核内出现棕黄色颗粒或棕黄色团块为阳性细胞,COX-2高表达信号位于细胞质中,以主要显色部位为判断标准,低表达为COX-2、VEGF、FGF2基本不着色、着色细胞低于5%或着色细胞占整张切片5%~25%,高表达为着色细胞范围占整张切片超过25%。
1.2.2PCR检测微卫星不稳定性 应用DNA提取试剂盒提取癌组织及癌旁正常组织基因组DNA,紫外分光光度法定量。DNA抽提具体步骤按照试剂盒说明书进行,研究对象的肿瘤组织基因组与正常组织基因组DNA经电泳后确定提取成功,选取5个微卫星位点:BAT-26、BAT-40、D2S123、D17S250、D5S346,采用同一条件进行扩增,反应体系为20 μL,其模板为200 ng,引物各15 pmol,其中dNTPs 0.5 μL,RedTaq DNA聚合酶 1.5 μL。预变性94 ℃ 2.5 min,循环参数为94 ℃ 45 s、55 ℃ 60 s、72 ℃ 90 s,35个循环,72 ℃延伸10 min。产物行非变性聚丙烯酰胺凝胶电泳,溴化乙锭染色后凝胶成像照相保存,将同一患者的肿瘤组织与正常组织标本所显示的条带进行比较。判定标准:肿瘤组织出现DNA条带而正常组织未出现条带则判断为微卫星不稳定性阳性,阳性标本重复1次,患者出现2个或2个以上微卫星位点为高微卫星不稳定性,出现1个微卫星位点为低微卫星不稳定性,无微卫星位点出现为微卫星稳定性,微卫星位点越多,则说明肿瘤发生途径与微卫星不稳定性越相关。其特异性引物合成序列见表1。

表1 微卫星引物序列
1.3统计学处理 采用SPSSP22.0软件进行数据分析,计数资料以频数或百分率表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1COX-2表达与微卫星不稳定性的关系 67例胃癌标本中,微卫星稳定性38例(56.72%),微卫星不稳定性29例(43.28%),高微卫星不稳定性COX-2低表达率明显高于COX-2高表达率,差异有统计学意义(P<0.05)。高微卫星不稳定性COX-2低表达率明显高于微卫星稳定性COX-2低表达率,差异有统计学意义(P<0.05)。比较高、低微卫星不稳定性及微卫星稳定性COX-2表达率的构成,差异有统计学意义(P<0.05),见表2。

表2 COX-2表达与微卫星不稳定性的关系
a:P<0.05,与同状态COX-2高表达比较;b:P<0.05,与微卫星稳定性COX-2低表达比较
2.2VEGF表达与微卫星不稳定性的关系 67例胃癌标本中,高微卫星不稳定性VEGF高表达率明显低于微卫星稳定性及低微卫星不稳定性,差异有统计学意义(P<0.05)。高微卫星不稳定性VEGF高表达率明显低于同状态VEGF低表达率,差异有统计学意义(P<0.05)。比较高微卫星不稳定性、低微卫星不稳定性及微卫星稳定性VEGF表达率的构成,差异有统计学意义(P<0.05),见表3。

表3 VEGF表达与微卫星不稳定性的关系
a:P<0.05,与高微卫星不稳定性VEGF高表达比较;b:P<0.05,与同状态VEGF高表达比较
2.3FGF2表达与微卫星不稳定性的关系 67例胃癌标本中,高微卫星不稳定性FGF2高表达率明显高于微卫星稳定性及低微卫星不稳定性,差异有统计学意义(P<0.05)。高微卫星不稳定性FGF2高表达率明显高于同状态FGF2低表达率,差异有统计学意义(P<0.05)。比较高微卫星不稳定性、低微卫星不稳定性及微卫星稳定性FGF2表达率的构成,差异有统计学意义(P<0.05),见表4。
2.4微卫星不稳定状态PCR检测结果 BAT-26、BAT-40、D2S123、D5S346、D17S250的微卫星不稳定状态电泳图,见图1。
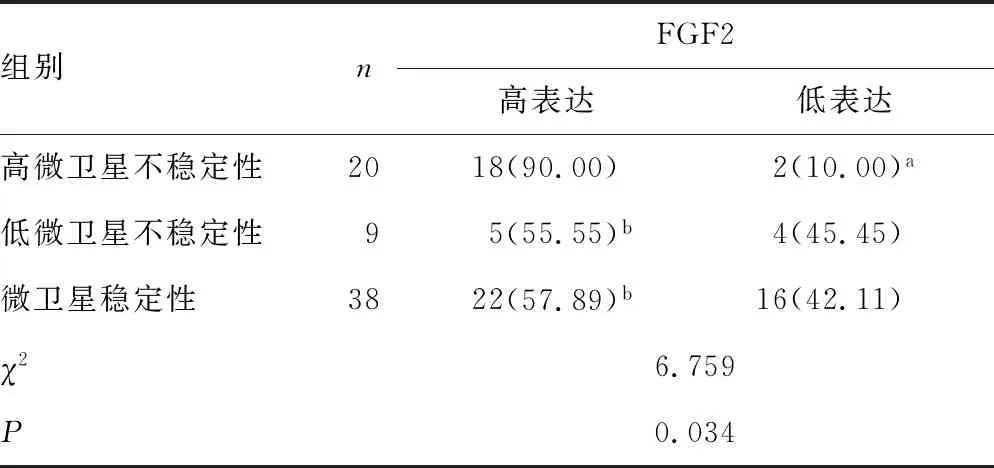
表4 FGF2表达与微卫星不稳定性的关系
a:P<0.05,与同状态FGF2高表达比较;b:P<0.05,与高微卫星不稳定性FGF2高表达比较
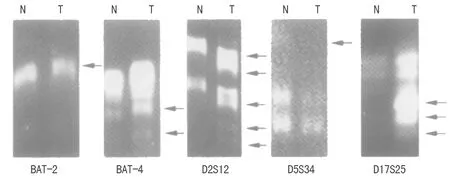
N:癌旁正常组织;T:胃癌组织
图1 5个位点的微卫星不稳定状态PCR结果
3 讨论
微卫星是基因组中的核苷酸简单重复序列,通常为碱基重复,可用于遗传标记、遗传连锁图的构建及基因的定位,其微卫星不稳定性则是因复制错误引起的简单重复序列的变化,进而引起肿瘤的发生与转移[17-19]。在目前的医疗研究水平下,学界认为人类大多数疾病发生的主要原因是人体遗传物质的突变。
胃癌微卫星不稳定性在既往研究中的检出率可达34%,说明微卫星不稳定性能够作为胃癌发展过程中的诊断指标之一。本研究中高微卫星不稳定性COX-2低表达率明显高于COX-2高表达率,高微卫星不稳定性COX-2低表达率明显高于微卫星稳定性COX-2低表达率。COX-2是在患者体内细胞受到刺激时迅速合成的限速酶,主要调控细胞增殖与抑制细胞凋亡、促进患者体内血管生成及肿瘤转移。有研究表明,COX-2在胃癌、乳腺癌及卵巢癌等肿瘤组织中表达水平明显降低,本研究结果表明微卫星不稳定性途径发生的肿瘤通常会伴随COX-2的低表达,与既往研究结果一致。
VEGF作为一种能够增强微血管渗透性浸润的强效内皮细胞有丝分裂元,与肿瘤的发展、转移具有密切关系。VEGF作为肿瘤血管新生最主要的刺激因子之一,能够解释本研究中微卫星不稳定性胃癌存在的侵袭性及转移性,也有部分原因可能是依赖于肿瘤活跃的微血管渗透性。本研究中胃癌VEGF高表达,占55.22%(37/67),67例肿瘤标本中,高微卫星不稳定性VEGF高表达率明显低于微卫星稳定性及低微卫星不稳定性,高微卫星不稳定性VEGF高表达率明显低于同状态VEGF低表达率,本研究在一定程度上能够说明不同新生血管形成的途径会造成患者VEGF的表达不同,预后较好可能与VEGF低表达相关。
FGF2存在于人体多个器官组织和细胞中,FGF2在恶性肿瘤组织中的表达会明显升高,与本研究基本一致。本研究胃癌FGF2高表达45例,占67.16%;67例肿瘤标本中,高微卫星不稳定性FGF2高表达率明显高于微卫星稳定性及低微卫星不稳定性,高微卫星不稳定性FGF2高表达率明显高于同状态FGF2低表达率,FGF2与细胞膜上相应受体结合后会导致患者体内肿瘤细胞分裂与增殖,促进肿瘤组织新生血管的形成,导致患者肿瘤的发生与发展。且既往研究表明,乳腺癌、肺癌患者血清FGF2表达会明显高于健康人,进而证实了血清FGF2与肿瘤的相关性。
综上所述,胃癌发生过程中可能存在微卫星不稳定性状态,且可能伴随COX-2表达降低,微卫星不稳定性胃癌存在不同的新生血管形成的途径,其VEGF表达较低,FGF2表达偏高。



