冯云霞,张介眉,谢沛霖,郝建军,朱 旭
(武汉市中西医结合医院 430000)
血脂异常与心脑血管疾病密切相关,是冠心病和缺血性脑卒中独立危险因素,血脂异常已成为影响我国人群健康的重要公共卫生问题[1]。本课题组历时十余年开发研制的葱白提取物[2-4],将“通阳”药物葱白冷冻干燥后,通过超临界二氧化碳萃取技术制备而成。该制剂(博心通软胶囊)于2009年获得湖北省药监局院内制剂批号(鄂药制字Z20093124Z)。在本院临床广泛应用,在调节血脂方面疗效显着,本文拟利用基因芯片技术探讨葱白提取物调节血脂的可能机制。
1 材料与方法
1.1材料
1.1.1实验动物及分组 16只雄性SPF级SD大鼠(180±20)g,购自湖北省动物实验研究中心,合格证号:42000600000069,许可证号:SCXK(鄂)2008-0005。随机分为模型组、葱白提取物组,每组8只。
1.1.2建立高脂血症模型 采用邱服斌等[5]的方法用高脂饲料连续喂养6周,确认形成高脂血症模型后再检测其他相关指标。高脂饲料配方:82.3%基础饲料添加10%的猪油,2%胆固醇,5%蔗糖,0.5%脱氧胆酸钠,0.2%甲硫氧嘧啶。由北京华阜康生物科技股份有限公司生产提供。
1.1.3药物及给药 葱白提取物由武汉市中西医结合医院制剂中心提供。根据人动物换算剂量,葱白提取物组给予42 mg/kg葱白提取物灌胃,模型组大鼠给予同体积生理盐水灌胃,每天1次,均连续给药6周。
1.1.4观察指标 利用基因芯片技术研究葱白提取物对血脂的调控基因。
1.1.5仪器与试剂 OneArray®大鼠表达谱芯片(台湾华联生物科技,226-2013070101);GCOS(数据处理软件);RNeasy Mini Kit(Qiagen 74104);TRIzol Reagent(Invitrogen,5596-018);RNAlater(Qiagen,76106);One-Cycle cDNA Synthesis Kit(Affymetrix,900454);GeneChip Eukaryotic(Affymetrix,900454);β-Mercaptoethanol(Calbiochem,444203)
1.2方法
1.2.1提取纯化总RNA及cDNA、标记、杂交 用TRIzol按照试剂盒说明抽提总RNA并进行浓度测定。纯化采用QIAGEN RNeasy@Kit,纯化后做进一步的RNA质量检测。取2 μL Poly-A RNA Control Stock,稀释,加入T7-(d7)24 primer 50 μmol/L,2 μL、 5×First strand cDNA buffer、SuperScript Ⅱ温浴,离心,加 2 μL 10 U/μL T4 DNA 聚合酶,0.5 mol/L乙二胺四乙酸(EDTA)终止反应。在合成的双链 cDNA产物中加入 600 μL cDNA Binding Buffer,QIAGEN RNeasy Total RNA Isolation kit 纯化生物素标记的cRNA。cRNA质控用分光光度计分析。片断化 cRNA,芯片使用前需平衡至室温。确定芯片的类型(Standard Array)。在新的1.5 mL RNase-free离心管中配制杂交液。杂交液先99 ℃,5 min,然后45 ℃,5 min。在进行上述步骤的同时通过加样孔加入适量体积1×杂交缓冲液湿润芯片。杂交炉中45 ℃,60 rpm预杂交芯片10 min。从芯片中取出杂交缓冲液,加等体积处理好的杂交液。杂交炉中 45 ℃,60 rpm杂交芯片16 h。
1.2.2洗脱、染色、扫描芯片 洗脱、染色、扫描芯片之前都必须先定义一个Experiment。基因芯片洗涤工作站450用来洗脱和染色探针阵列。洗脱和染色、扫描。关闭洗涤工作站。
1.2.3质控标准 同一样品杂交同一种类两张芯片时,两张芯片上除控制点以外,所有信号点的强度经normalize以后的相关性大于95%。阵列图像:阵列上没有人为的痕迹,没有大于芯片面积2.5%的刮痕。平均杂交背景信号值不大于100。B2寡核苷酸探针的特性描述如下:(1)在杂交矩阵的边缘处亮度为交替出现型;(2)每个拐角处图案为棋盘形图案;(3)阵列的名称位于阵列左上方
杂交控制:杂交信号中,BioB作为代表,其检出率应该至少有50%;BioC,BioD和cre的信号值应比BioB的信号强。内控制基因:rpt文件中所列的芯片上的看家基因(House keeping controls),其中至少一个基因3′端的探针集合的杂交信号不能超过其5′端的探针集合的杂交信号的3倍(两轮放大的除外)。
1.2.4实时荧光定量PCR技术验证相关基因 Trizol提取组织RNA,逆转录成cDNA。反应体系:GAPDH:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 25 s;30个循环,72 ℃ 4 min,4 ℃ 4 min。Fgf21:第1个循环 :50 ℃ 2 min 95 ℃ 10 min,40个循环95 ℃ 30 s 60 ℃ 30 s,Scap:第1个循环50 ℃ 2 min 95 ℃ 10 min,40个循环95 ℃ 30 s 60 ℃ 30 s,荧光检测,并绘制熔解曲线和扩增曲线。验证基因及引物序列见表1。
1.3数据处理 首先对原始数据进行预处理和均一化处理。没有重复的数据采用倍数法和Z值法相结合的方法来进行差异基因的筛选,再对其他基因进行差异表达筛选和聚类分析。用Gene Ontology(GO)功能分类标准对差异基因进行功能分类分析。用Pathway分析对差异表达基因进行生物信号通路分析。
2 结 果
2.1RNA质量监控 见表2。
2.2差异基因的筛选分析
2.2.1差异表达基因的聚类分析 模型组和葱白提取物组基因芯片检测数据标化后,根据差异倍数(fold change)筛选差异表达基因,选择标准如下:(1)LOG2|差异倍数|≥1和P<0.05(2)LOG2比率=“NA”和样品强度两者之间的差异≥1 000;列出的葱白提取物与模型组差异表达基因以≥Ratio值2倍标准筛选。筛选出表达上调2倍以上并有统计学意义的差异基因59个,其中表达上调的基因16个,表达下调的基因43个。
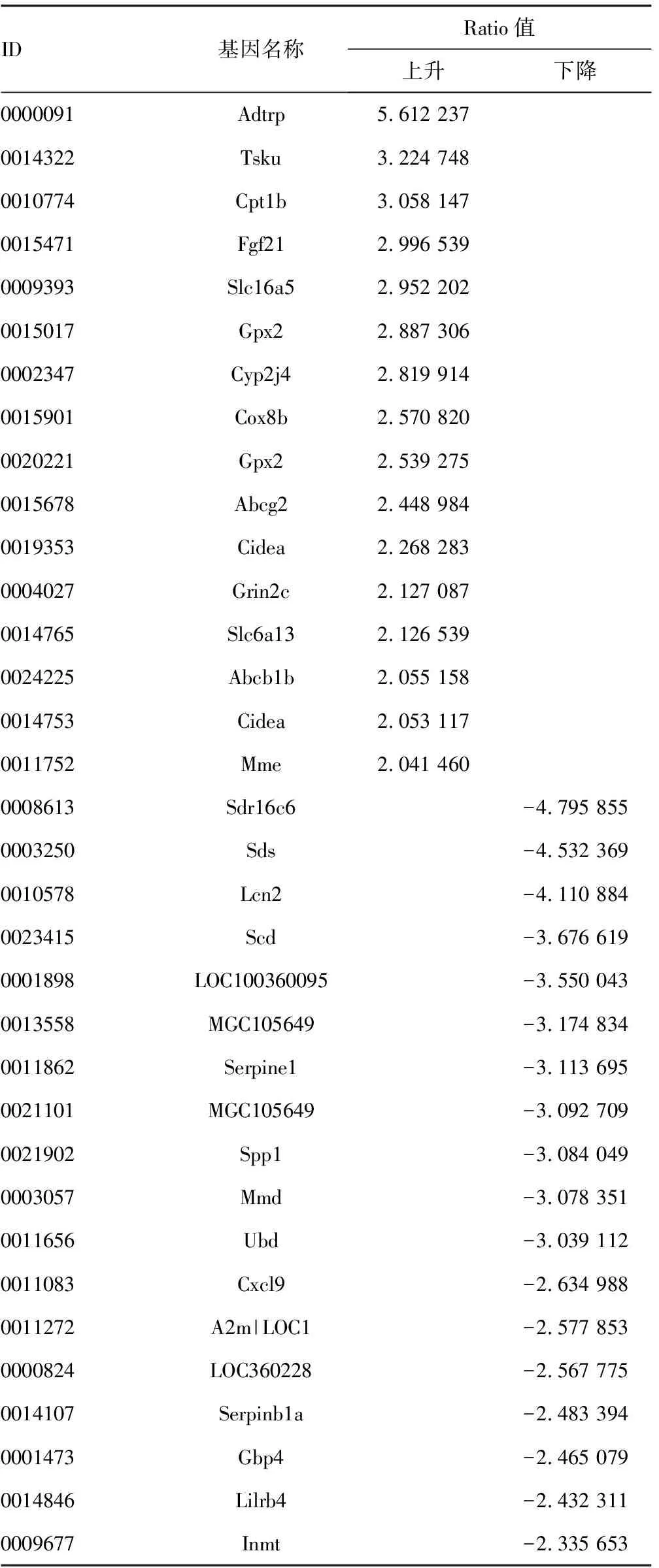
表3 模型组和葱白提取物组差异表达基因列表
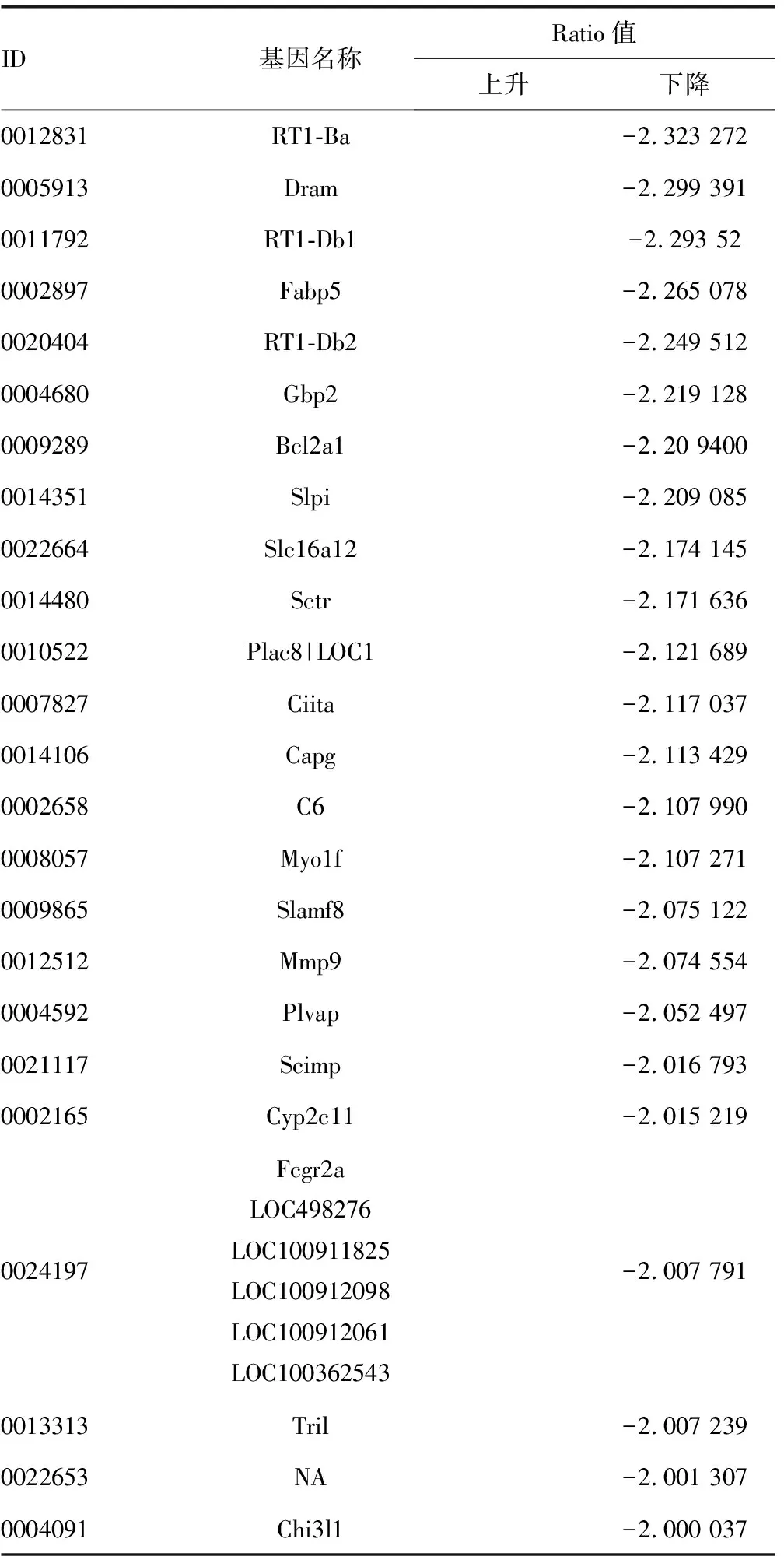
续表3 模型组和葱白提取物组差异表达基因列表
2.2.2差异表达基因的GO分析和Pathway分析 根据KEGG数据库,利用DAVID数据库的注释功能对差异性的表达基因进行注释及GO分析,对靶基因整合后进行显着性Pathway分析,结果显示肉碱棕榈酰转移酶1B(carnitine palmitoyltransferase 1b,muscle,Cpt1b)、诱导细胞死亡DNA片断化因子a样效应因子A(cell death-inducing DFFA-like effector a,Cidea)、载脂蛋白2(lipocalin 2,Lcn2)、硬脂酰辅酶A去饱和酶(stearoyl-coenzyme Adesaturase,Scd)、成纤维细胞生长因子21(fibroblast growth factor 21,Fgf21)等可能在葱白提取物调节血脂异常方面发挥了重要作用,葱白调节血脂异常的导致差异表达的基因集中在能量代谢方面。而其他基因在血脂异常及其调节的研究方面罕见报道,也提示深入研究它们在血脂异常中的作用具有一定的空间。
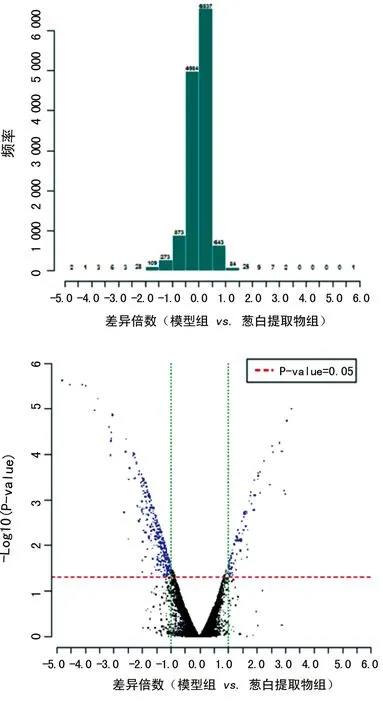
图1 各组探针表达差异倍数统计图
2.3实时荧光定量PCR验证结果 挑选相关基因Fgf21和非相关基因Scap去做RT-PCR验证,结果表明和芯片结果一致。
2.3.1各组大鼠肝组织Fgf21的表达 葱白提取物调节血脂的机制可能与上调Fgf21的表达有关。
1:葱白提取物组;2:模型组;3:内参
图2各组GAPDHRNA凝胶电泳图
与模型组相比,葱白提取物可以明显上调Fgf21的表达(0.44±0.01vs. 0.65±0.01,P<0.05),与基因芯片结果一致。
2.3.2各组大鼠肝组织Scap的表达 与模型组相比,葱白提取物虽然可以减少Scap的表达,但差异无统计学意义(1.70±0.15vs. 1.41±0.13)。基因芯片结果显示葱白提取物对Scap的表达影响不大,二者结果一致。葱白提取物调节血脂的机制可能与减少Scap的表达关系不大。
1:葱白提取物组;2:模型组;3:内参
图3各组Fgf21RNA凝胶电泳图
1:葱白提取物组;2:模型组;3:内参
图4各组ScapRNA凝胶电泳图
与模型组相比,葱白提取物虽然可以减少Scap的表达,但没有统计学意义(1.70±0.15vs. 1.41±0.13)。基因芯片结果显示葱白提取物对Scap的表达影响不大,二者结果一致。葱白提取物调节血脂的机制可能与减少Scap的表达关系不大。
3 讨 论
葱白提取物与高脂血症基因间存在着一定的关系,基因芯片为高通量筛选技术,可以将葱白提取物和基因有效地结合起来,从而为探讨葱白提取物通过何种途径发挥辛温通阳调节血脂代谢作用机制提供可能。
血脂是血清中的胆固醇、TG 和类脂(如磷脂)等的总称,TG主要存在于人体的脂肪组织中,食物摄取的外源性TG经胰脂肪酶水解后由肠道吸收,肝脏中内源性TG的合成由底物供给(游离脂肪酸的可用性)、能量平衡(肝糖原的储存水平)和激素状态(胰岛素与胰高血糖素之间的平衡)所调节。本研究结果显示葱白提取物调节TG主要通过以下几个方面:一方面通过调节相关信号通路影响脂肪酸转运降低TG,如Cpt1b是长链脂肪酸进入线粒体进行β氧化的限速酶,Scd是催化饱和脂肪酸第9位碳链形成n-9系单不饱和脂肪酸的关键酶。Scd上升,抑制Cpt1b的活性,影响脂肪酸转运进入线粒体,使已进入细胞的脂肪酸及其活化产物脂酰辅酶A沉积在胞质内,在线粒体的外膜外难以顺畅地进入线粒体基质中进行β氧化以实现最终的能量生成,从而加剧大量脂质堆积。而葱白提取物可以减少Scd的表达的同时,使Cpt1b的表达上调,促进脂肪酸转运及其活化产物脂酰辅酶A进入线粒体基质中进行β氧化,生成能量,减轻脂质的沉积[6]。
另一方面通过影响脂肪转化降低TG。Fgf21主要来源于肝脏,其过表达可促进游离脂肪酸(free fatty acids,FFA)转化为酮体,三酰甘油水平下降[7]。脂肪组织按形态和功能分为两种形式:白色脂肪组织(WAT)和棕色脂肪组织(BAT)。WAT储存能量,BAT则可加快体内代谢,促进能量消耗。Cidea 在棕色脂肪组织的线粒体中呈高表达,肥胖者脂肪组织中Cidea基因的mRNA表达水平降低,在体重减轻后可以恢复正常[8-9]。而在白色脂肪组织中Lcn2表达显着增加,在前脂肪细胞分化成熟为脂肪细胞时Lcn2表达急剧增加[10-12]。而葱白提取物调节血脂的机制可能与上调Fgf21、Cidea的表达,增加脂肪的利用、消耗及转运,同时下调Lcn2的表达减少前脂肪细胞分化为脂肪细胞,使脂肪贮存量下降,循环中的游离脂肪酸及甘油三酯减少[13]。
另外,本课题组前期数据挖掘[14-15]发现,葱白提取物具有良好的辛温通阳作用和降低TG作用,而高脂血症动物模型中,笔者发现能量代谢相关基因表达出现明显变化,如Fgf21、Cpt1b、Cidea、Lcn2、Scd等基因的表达异常,而辛温通阳中药葱白提取物可以调节这种表达异常,说明辛温通阳的分子机制可能与能量代谢相关。
本研究采用高通量芯片技术对葱白提取物辛温通阳作用及调血脂作用进行评价。考虑到数据有可能存在假阳性,本课题组在后期进行了特征基因的RT-PCR验证,结果具有一致性,证明本研究结果可靠。研究结果不仅揭示葱白提取物调节血脂的作用机制可能与上调Fgf21、Cpt1b、Cidea,下调Lcn2、Scd基因的表达有关。而且提示了葱白提取物辛温通阳作用与能量代谢之间的关系。这为后续探讨葱白提取物辛温通阳作用的分子机制提供了思路。



