夏丽芳,何 倩,王 鑫,宋茜茜,张月娥,李志红△
(1.河北省保定市第一中心医院内分泌二科 017000;2.河北省蠡县医院内三科 071400;3.河北省保定市第一中心医院内分泌科 017000;4.河北省保定市第一中心医院康复二科 017000)
高尿酸血症(hyperuricemina,HUA)是嘌呤代谢障碍引起的代谢性疾病。调查显示,我国不同地区HUA患病率为5.0%~23.5%,预计在未来10~20年,HUA将成为仅次于糖尿病的第二大内分泌代谢性疾病,因此对HUA进行深入研究意义重大[1]。亚甲基四氢叶酸还原酶(methylenetetrahydrofolatereductase,MTHFR)定位于人类第1染色体短臂,是叶酸代谢中一个重要的酶,MTHFR C667T基因位点突变可降低叶酸代谢关键酶的活性[2]。赵欣等[3]报道,叶酸可通过上调过氧化物酶体增殖物激活受体γ的表达,促进人脂肪间充质干细胞成脂分化,影响肥胖的发生。且一项大型研究[4]发现,肥胖患者发生HUA的概率较高。故推测MTHFR C667T基因多态性可能与肥胖患者发生HUA有关,但目前关于三者间关系的报道较少。本研究选取136例HUA患者,研究MTHFR C667T基因多态性对肥胖患者HUA发生风险的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年8月保定市第一中心医院收治的136例HUA患者(HUA组)及体检中心150例健康人群(对照组)作为研究对象。HUA组均符合HUA的诊断标准[5]:连续2次空腹血尿酸水平检测,男性大于420 μmol/L,女性大于360 μmol/L,且均为汉族人群,相互间不存在血缘关系。排除合并造血系统疾病者,由药物、肿瘤、银屑病、肾脏疾病、肝脏疾病及饮食等因素导致的继发性HUA患者,妊娠期患者,合并精神疾病者,近期曾服用降尿酸药物者。本研究获得保定市第一中心医院伦理委员会审核批准,所有患者对本研究均知情同意,并签署知情同意书。
1.2 方法
1.2.1资料收集
收集研究对象性别、年龄、体质量指数(BMI)、空腹血糖(GLU)、总胆固醇(TC)、三酰甘油(TG)、血尿素氮(BUN)、血肌酐(Cr)等资料。
1.2.2MTHFR C667T基因型检测
使用PCR-芯片杂交法MTHFRC667T基因检测试剂盒,按杭州开泰生物技术有限公司血液基因组DNA提取试剂盒说明书,提取和纯化DNA。PCR扩增,PCR反应条件:94 ℃ 5 min,94 ℃ 25 s,56 ℃ 25 s,72 ℃ 25 s,共35个循环,最后72 ℃后延伸5 min,杂交显色。反应结束后取出芯片,放入生物芯片识读仪(上海百傲科技有限公司,BE-3.0)中,用Baio Array Doctor V2.0软件进行图像扫描与数据分析,输出MTHFR 3种基因型:667CC、667CT、667TT。
1.3 观察指标
(1)比较两组年龄、性别、舒张压、饮酒史、吸烟史等一般资料;(2)比较两组MTHFR C667T基因型频率及等位基因频率分布;(3)分析影响HUA发生的因素;(4)比较两组不同BMI患者分布;(5)分析MTHFR C667T基因型与肥胖对HUA发生风险的交互作用。
1.4 统计学处理
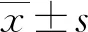
2 结 果
2.1 两组一般资料比较
两组年龄、性别、舒张压、饮酒史、吸烟史、GLU、TC、TG、BUN、Cr、合并糖尿病、心脏病、高血压比较,差异无统计学意义(P>0.05);HUA组BMI、收缩压、高脂血症患者占比较对照组高(P<0.05),见表1。

表1两组一般资料比较

续表1两组一般资料比较
2.2 两组MTHFR C667T基因型频率及等位基因频率分布比较
对照组MTHFR C667T位点基因型分布符合Hardy-Weinberg遗传平衡定律检验(P=0.80)。HUA组TT基因型频率、T等位基因频率均较对照组高(P<0.05),见表2。

表2 比较两组MTHFR C667T基因型频率 及等位基因频率分布[n(%)]
2.3 HUA发生的影响因素分析
以是否发生HUA为因变量,以BMI、收缩压、高脂血症等为自变量进行多因素分析发现,高BMI、高收缩压、高脂血症、基因型TT、等位基因T是HUA发生的危险因素(P<0.05),见表3。

表3 HUA发生影响因素的logistic多元回归分析
2.4 两组不同BMI患者分布比较
根据《中国成人超重和肥胖症预防控制指南》[7]中BMI≥28 kg/m2为肥胖,HUA组BMI≥28 kg/m2患者占比高于对照组(P<0.05),见表4。

表4 比较两组不同体质量指数患者分布[n(%)]
2.5 MTHFR C667T基因型与肥胖对HUA发生风险的交互作用
BMI≥28 kg/m2时,TT型基因在组间分布比较,差异具有统计学意义(P<0.05);交互作用分析显示,S=4.464,RERI=3.040,AP=0.406,见表5。

表5 MTHFR C667T基因型与肥胖对HUA发生 风险的交互作用
3 讨 论
随着我国人民生活水平的不断提高,HUA发病率逐渐递增,并表现出年轻化趋势。流行病学调查显示,90%的原发性高血压患者合并HUA,血尿酸水平每增高59.5 μmol/L,高血压发病相对危险增高25%,且HUA亦可增加脑卒中、冠心病等发病与死亡的风险[8]。但HUA发病机制尚未完全明了,陈晓波等[9]、林曦阳等[10]研究指出,HUA与高血压、高血脂有关。本研究结果显示,除高收缩压、高脂血症外,高BMI、TT基因型、T等位基因亦是HUA发生的危险因素,提示肥胖及MTHFR C667T TT基因型、T等位基因可影响HUA的发生。
3.1 肥胖与HUA的关系
超重、肥胖是当今社会常见的一种现象,可引起代谢综合征。胡梦妍等[11]报道,与健康人群相比,肥胖患者HUA发生率较高。本研究结果显示,HUA组BMI较对照组高(P<0.05),提示肥胖可能与HUA的发生有关。朱冰坡等[12]研究共纳入1 363例老年体检人群,进行单因素与二元logistic回归分析发现在校正年龄后,高脂血症、肥胖是HUA的独立危险因素,与本研究结论一致。尿酸在细胞外的水平取决于尿酸生成的速度和经肾脏排出之间的平衡关系,排泄减少和(或)生成增加,或生成大于排泄,均可出现HUA。从这个角度讲,肥胖导致HUA的机制可能为:(1)引起胰岛素抵抗,增加肾小管近曲小管对尿酸/Na+的重吸收;(2)可通过激活肾素-血管紧张素系统,导致肾髓质缺血,乳酸增加,竞争性抑制尿酸的排泄;(3)降低近端小管泌氨功能,造成尿液酸化,影响尿酸的排泄;(4)可促进黄嘌呤氧化酶的生成,增加尿酸合成量[13-14]。
3.2 MTHFR C667T基因多态性与HUA的关系
MTHFR是一种重要的一碳单位代谢酶,至今已发现近65个多态性位点,其中C667T是最为常见的突变位点之一[15-16]。KIMI 等[17]研究发现,血清尿酸水平较高者TT基因型检出率较高,CC、TT、CT基因型患者血清尿酸水平具有明显差异,MTHFR C667T基因多态性可能与HUA有关。日本的一项研究纳入了793例49岁以上人群,发现血尿酸水平大于或等于7 mg/dL者TT基因型检出率高于尿酸水平低于7 mg/dL者,并得出HUA与MTHFR 677T等位基因携带者之间存在显着相关性的结论[18]。一项Meta分析[19]共纳入1 470例患者,进行异质性测试后发现,MTHFR C677T多态性是HUA的独立危险因素,支持本研究结论。MTHFR基因第4外显子667位点上存在C等位基因和T等位基因多态现象,分为野生型(CC型)、杂合型突变(CT型)和纯合型突变(TT型)3种,C与T对应氨基酸残基分别为丙氨酸和缬氨酸,缬氨酸取代丙氨酸后使MTHFR稳定性下降,直接影响MTHFR的活性和耐热性,其中CT型、TT型人群的酶活性分别降低为CC型的65%和30%,导致由S-腺苷-同型半胱氨酸产生的腺苷优先渗入尿酸前体池,使同型半胱氨酸和尿酸的合成相关联,增加了尿酸的来源,且TT型个体常出现全身血管病变、肾血管动脉粥样硬化等并发症,降低了肾脏对尿酸的清除能力,从而诱发HUA[20-21]。
3.3 MTHFR C667T基因多态性对肥胖患者高尿酸血症发生风险的影响
MAHESH 等[22]研究显示,MTHFR C667T基因多态性与较低的高密度脂蛋白(HDL)水平有关,而HDL主要作用是促进体内胆固醇逆化转运,防止外周组织中过多脂质堆积。可见MTHFR C667T基因多态性与肥胖有关,结合上述分析,推测MTHFR C667T基因多态性与肥胖对HUA的发生可能存在交互作用。本研究通过分层分析发现,BMI≥28 kg/m2时,TT型基因在组间分布比较,差异具有统计学意义(P<0.05),交互作用分析显示,RERI=3.040,AP=0.406,S=4.464,直接证实两种因素在HUA的发生中存在正向交互作用,且在HUA发病总效应中占比为40.60%。但本研究受客观情况限制,纳入样本量较小,可能造成数据的偏倚,且由于本地区汉族人群较多,故纳入汉族人群作为研究对象,而研究结果是否适用于其他民族的人群,仍需后续研究进一步完善、验证。
综上所述,MTHFR C667T基因TT型纯合子突变携带增加HUA的风险,MTHFR C667T基因多态性、肥胖在HUA的发生中存在正向交互作用。



