薛奋龙,简锴陶
(1.天津市第一中心医院心血管外科 300192;2.天津市胸科医院心血管外科 300051;3.上海德达医院心血管外科 200336)
目前,缺血性心脏病(IHD)仍然是全世界病死率最高的疾病。对于IHD导致的慢性心力衰竭的治疗已经有了长足的进步,包括β-受体抑制剂、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体抑制剂等的药物治疗,以及再同步化疗[1]。终末期慢性心力衰竭患者也可以进行左心室辅助装置和心脏移植治疗。虽然这些治疗方法对于IHD所导致的慢性心力衰竭发挥了重要的作用,但是药物治疗非常有限,预后不佳,左心室辅助装置受设备和医疗水平限制,无法广泛的开展,同时心脏移植受供体和受体条件所限,受益人群有限。因此,对于IHD慢性心力衰竭的治疗方法仍需要不断的发展和探索。应用干细胞治疗IHD是过去20年间逐步发展的新策略,自体干细胞移植治疗IHD的临床研究已经开展并时有报道[2-3]。可以选择的干细胞移植种类虽然很多,但无论应用何种干细胞,移植的方式在干细胞治疗方案中发挥着至关重要的作用。目前临床中应用的移植方式主要是在外科手术时心肌内注射或者通过导管冠状动脉内注射。但通过这些途径移植的治疗效果有限,原因可能与心肌内注射后干细胞只作用在局部区域和注射部位心肌损伤造成移植干细胞生存条件更加恶化有关,导管内冠状动脉注射干细胞后干细胞随血流到达损伤部位的干细胞数量有限,治疗作用不理想。因此,有学者选择应用干细胞膜片进行移植,干细胞膜片具有不破坏细胞连接结构,具有更加强大的旁分泌效应[4-5]。干细胞膜片的种类很多,包括心肌干细胞、骨骼肌干细胞、基质干细胞、脂肪干细胞等,但制备和应用内皮祖细胞(EPCs)膜片治疗IHD的动物和临床实验鲜有报道。本实验研究大鼠EPCs的制备方法并探讨EPCs膜片的生物学功能,以为EPCs膜片移植治疗IHD提供参考依据及实验基础。
1 材料与方法
1.1 材料
(1)实验动物。清洁级同种系成年雄性Wistar大鼠15只,8周龄,体重200~250 g,购自军事医学科学院动物中心。(2)主要试剂及仪器。内皮细胞基础培养基及生长因子套装(EBM-2 Basal Medium)购自美国Lonza公司;淋巴细胞分离液(Histopaque 1083)、大鼠血浆来源玻连蛋白、异硫氰酸荧光素(FITC)标记的荆豆凝集素1(FITC-UEA-1)均购自美国Sigma公司;羊抗大鼠CD34流式抗体购自美国Santa Cruz公司;兔抗大鼠CD133流式抗体购自美国Bioss公司;VE-cadherin 抗体购自北京博奥森生物技术有限公司;KDR抗体购自武汉三鹰生物技术有限公司;Dil 标记的乙酰化低密度脂蛋白(Dil-acLDL)购自美国Molecular probes公司;Matrigel基质胶购自美国BD公司;4,6-二氨基-2-苯基吲哚(DAPI)购自瑞士Roche公司;大鼠基质细胞衍生因子1α(SDF-1α)酶联免疫吸附试验(ELISA)试剂盒、大鼠血管内皮生长因子(VEGF)ELISA试剂盒及大鼠表皮细胞生长因子(EGF)ELISA试剂盒均购自泉州市科诺迪生物科技有限公司。CO2孵育箱购自美国Thermo公司,Nunc UpCell Surface培养皿购自美国Thermo Scientific公司,荧光倒置显微镜(IX71)购自日本Olympus公司,流式细胞仪购自美国BD FACS Calibur公司。
1.2 方法
1.2.1建立大鼠骨髓来源EPCs(BM-EPCs)培养体系
大鼠BM-EPCs培养体系建立同前期试验所述[6],断头处死雄性大鼠1只,75%乙醇浸泡2遍,分离股骨和胫骨,用注射器吸取适量的匀浆冲洗液冲洗髓腔至无色,收集悬液到合适离心管中,反复吹打成单细胞悬液,70 μm细胞筛过滤,2 500 r/min离心10 min,弃上清液,加细胞稀释液重悬细胞,调整细胞浓度至2×108~2×109/mL备用,15 mL离心管加入与骨髓单细胞悬液等量的淋巴细胞分离液Histopaque 1083,缓慢加入细胞悬液,2 100 r/min离心30 min,离心后分四层,取第二层棕黄色单核细胞于15 mL离心管,加入10 mL磷酸盐缓冲液(PBS)混匀清洗,1 400 r/min离心10 min,EBM-2培养基重悬细胞,接种至纤维连接蛋白包被的培养皿中。在37 ℃、5% CO2的细胞培养箱中培养。4 d后首次全量换液,弃去未贴壁细胞,以后每3天更换新鲜培养液,所有细胞均培养至第14天。
1.2.2大鼠BM-EPCs表面抗原流式细胞术鉴定
弃去培养液,PBS洗涤细胞,0.25%胰酶消化培养至14 d贴壁细胞,1 000 r/min离心3 min,PBS重悬,1 000 r/min离心3 min,细胞计数,PBS调整细胞浓度至1×106个/mL,取200 μL单细胞悬液。设空白对照管、CD34、CD133、KDR、VE-cadherin管,分别加入PBS、CD34、CD133、KDR、VE-cadherin一抗,室温孵育2 h,流式洗液洗涤1次,加入二抗Alexa Flour488,室温避光孵育1 h,流式洗液洗涤后行流式细胞仪检测。
1.2.3EPCs吞噬功能鉴定
将培养至14 d的细胞中加入1 mL完全培养基稀释的10 mg/L的Dil-acLDL,37 ℃温箱孵化4 h后,PBS洗涤3次,2%甲醛室温下固定20 min,再加入1 mL浓度为10 mg/L FITC-UEA-1室温孵育1 h,PBS洗涤3次,最后加入1 mL完全培养基稀释的10 mg/L 的DAPI于37 ℃温箱孵育15 min,荧光显微镜下观察Dil-acLDL和FITC-UEA-1双阳性细胞。
1.2.4EPCs膜片建立
取培养至7 d的1.5×106个BM-EPCs接种至包被有玻连蛋白的Nunc UpCell Surface培养皿中,37 ℃温箱继续培养7 d后,迅速放置于25 ℃恒温箱中避光孵育30 min,获得大鼠BM-EPCs膜片。
1.2.5细胞膜片厚度测定
弃掉培养至7 d的Nunc UpCell Surface 培养皿中的培养液,加入20 mL 预冷至-20 ℃的甲醇液,4 ℃孵育10 min,1×PBS洗1次,含10% 羊血清的PBS室温下封闭40 min,PBS-T稀释一抗ColⅠ共3 mL,室温孵育4 h,PBS-T洗3次,每次5 min,PBS-T稀释 Alexa Fluor 488二抗共3 mL,室温避光孵育1 h,PBS-T稀释DAPI共3 mL,室温避光孵育3 min,PBS-T洗3次,每次5 min。荧光显微镜下观察细胞膜片,计算膜片厚度。
1.2.6CCK8法检测细胞膜片中细胞代谢
分别制备培养至14 d的BM-EPCs单细胞及BM-EPC膜片1×105个/mL细胞悬液,分别设为EPC单细胞组及EPC膜片组。5×103个/孔接种于96孔板中,每组细胞至少接种6个孔,放入培养箱中继续培养,分别在12、24、48、72 h时用CCK8法检测细胞活性,每孔加入10 μL CCK8检测液,在细胞培养箱中孵育4 h后,用酶标仪测定每孔细胞在450 nm处的吸光度(A)。分别绘出EPCs单细胞及EPC膜片的生长曲线。
1.2.7细胞膜片内皮分化功能检测
4 ℃过夜融化Matrigel,用M199基础无添加培养基按1∶1稀释Matrigel,于96孔板中每孔均匀铺置50 μL Matrigel后,37 ℃温箱孵育30 min使其凝固。分别重悬BM-EPCs单细胞及细胞膜片,制作成2×105个/mL的细胞悬浮液。分别加100 μL单细胞悬液于Matrigel表面上,37 ℃孵育4 h,显微镜下观察各组细胞形成血管网状结构,应用Wimasis image analysis软件分析总的血管环数。
1.2.8ELISA法检测细胞膜片旁分泌SDF-1α、VEGF、EGF水平
分别取BM-EPCs单细胞及细胞膜片培养上清液,1 000 r/min,离心10 min去除颗粒物及漂浮细胞。按照ELISA检测试剂盒操作说明设置标准品孔和样本孔,标准品孔各加不同浓度的标准品 50 μL;样本孔分别加入两组培养上清液50 μL;立即加入50 μL的生物素标记的抗体。盖上膜板,轻轻振荡混匀,37 ℃温育1 h。甩去孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干。重复此操作3次。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL, 用封板膜封住反应孔,37 ℃水浴锅孵育 60 min,弃去液体,吸水纸上拍干,每孔加满1×洗涤液,静置 1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板 5 次。每孔加入底物 A、B各50 μL,37 ℃避光孵育15 min。每孔加入终止液 50 μL,15 min内,在450 nm 波长处测定各孔的A值。
1.3 统计学处理
2 结 果
2.1 大鼠BM-EPCs培养体系建立
培养14 d的BM-EPCs在显微镜下呈鹅卵石样排列,局部可见细胞岛状排列,细胞以锤状、梭形细胞为主,中央区多见多边形细胞;个别细胞呈线性排列,细胞呈典型纺锤状,见图1。
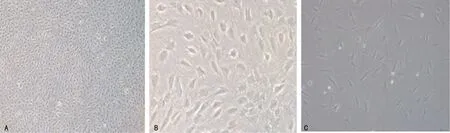
A:鹅卵石样排列(×100);B:局部细胞岛状排列(×200);C:梭形排列(×200)。
2.2 大鼠BM-EPCs鉴定
流式细胞术检测细胞表面抗原,结果显示分离培养的BM-EPCs CD34、CD133、KDR、VE-cadherin阳性率分别为85.43%、59.30%、51.83%、38.78%,见图2。BM-EPCs吞噬功能鉴定显示,BM-EPCs结合Dil-acLDL后呈红色,结合了FITC-UEA-1的细胞呈绿色,结合了DAPI的细胞核呈蓝色,双阳性细胞呈黄色,表明其具有EPCs增殖特性,见图3。

图2 BM-EPCs细胞表面抗原流式细胞术鉴定
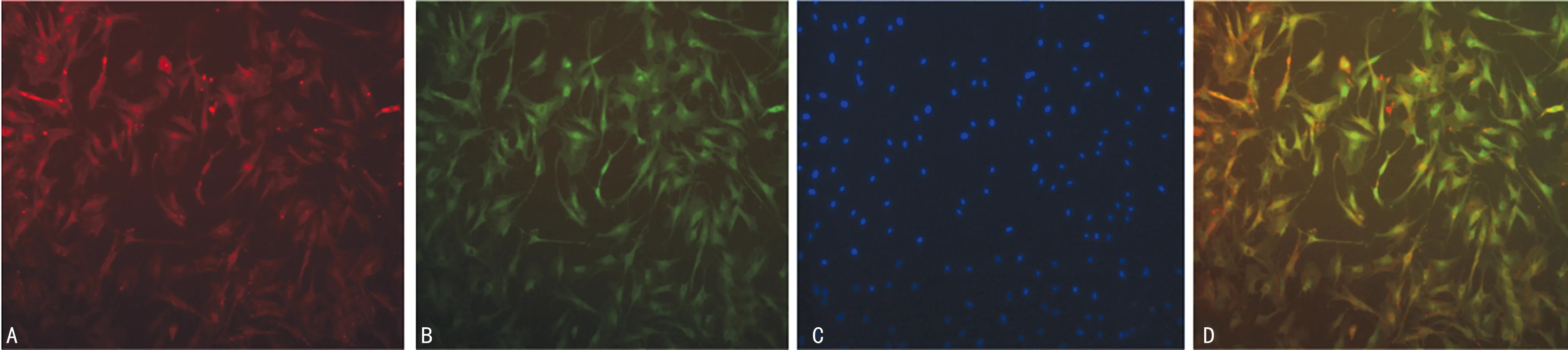
A:吞噬Dil-acLDL的EPCs;B:吞噬FITC-UEA-1的EPCs;C:结合了DAPI的EPCs核;D:吞噬Dil-acLDL和FITC-UEA-1的双阳性EPCs。
2.3 BM-EPCs膜片建立及膜片厚度测定
单层BM-EPCs膜片的厚度约15 μm,3~4层膜片的厚度约60 μm,见图4。
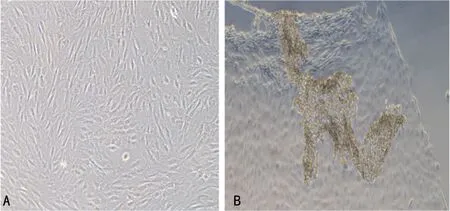
A:细胞连接更加紧密的膜片镜下结构(×200);B:细胞膜片形态(×100)。
2.4 CCK8法检测细胞膜片中细胞代谢
24 h之内,与EPC单细胞组比较,EPC膜片组中细胞增殖更快(1.59±0.17vs.3.65±0.25,P<0.01);24 h以后,由于EPC膜片组中细胞长满96孔板,生长停滞继而开始凋亡,见图5。
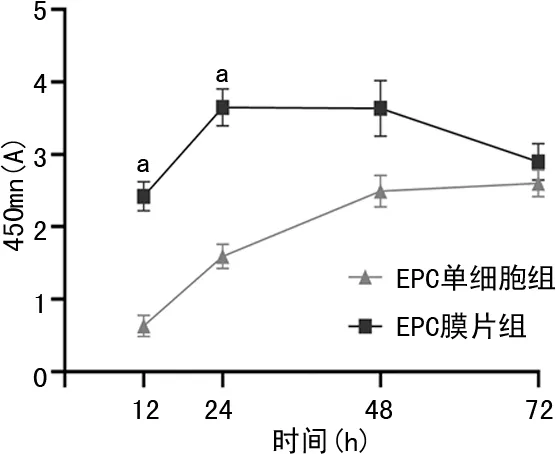
a:P<0.01,与EPCs比较。
2.5 内皮分化功能检测
体外血管形成实验结果显示,与EPC单细胞组比较,EPC膜片组血管形成能力更强,差异有统计学意义(P<0.05),见图6。

A:EPC单细胞组(×100);B:EPC膜片组(×100);C:两组细胞血管环数比较(n=6);a:P<0.01,与EPC膜片组比较。
2.6 ELISA法检测细胞膜片旁分泌因子SDF-1α、VEGF、EGF水平
与EPC单细胞组比较,EPC膜片组细胞旁分泌SDF-1α 和VEGF的能力更强(P<0.05),而两组细胞旁分泌EGF的能力比较差异无统计学意义(P>0.05),见表1。
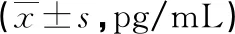
表1 两组细胞旁分泌因子水平比较
3 讨 论
血管EPCs主要存在于骨髓及外周血中,不同来源EPCs生物学特征不同。骨髓中含有丰富的EPCs,正常生理条件下BM-EPCs 逐步分化为成熟EPCs到外周血中,通过内皮化和新生血管化参与机体血管损伤修复和维持体内EPCs的内平衡[2]。当内皮细胞发生损伤时,BM-EPCs被动员释放入外周循环,在不同细胞因子介导趋化下聚集到损伤部位,进行血管再生从而达到修补损伤的作用。自然条件下通过动员自身骨髓,迁移至损伤部位的EPCs数量有限,因此,通过不同的移植方式,增加局部EPCs是促进局部组织修补的有效方法。目前动物实验和临床中应用的移植方式主要是在外科手术时心肌内注射或者通过导管冠状动脉内注射,移植效果欠理想。因此,应用EPCs进行缺血心肌治疗时,移植方式起到关键性作用,所以,寻求一种有效的干细胞移植方式至关重要[5,7-8]。有研究表明,EPCs在修复组织损伤过程中,可以通过旁分泌机制分泌一些抗炎、促血管生成的因子发挥重要作用,如SDF-1α,VEGF,EGF等[9-10]。由干细胞形成的干细胞膜片具有完整的细胞桥接结构,具有更强的旁分泌机制。目前应用最广泛的制备干细胞膜片的技术为温度感应细胞培养板,利用细胞培养皿表面特殊的温度反应材料在温差明显的条件下形成完整片状结构[4]。多项体外实验研究表明,间充质干细胞等细胞膜片在皮肤损伤,骨损伤修复及心肌梗死修复表现出理想的结果[11-12]。为达到更佳的治疗效果,通过组织工程学方法建立的细胞或干细胞膜片研究逐渐成为临床研究热点。
本实验通过组织工程学方法,获得EPCs膜片,比较EPCs膜片与EPCs生物学功能的不同。研究结果显示,EPCs膜片在24 h内,细胞增殖速度比EPCs快,EPCs膜片比EPCs血管生成能力强。局部心肌梗死发生后,细胞坏死并发生炎性反应,释放大量SDF-1α,BM-EPCs通过SDF-1α/CXCR4体系轴,具有向SDF-1α定向迁移的功能[13]。干细胞在发挥细胞生物学作用时,除了细胞自身发挥作用外,细胞之间的相互作用也非常重要,旁分泌信号通路是细胞间相互联系最基本也是最重要的组成部分[14-15]。在EPCs膜片中,细胞相互间通过旁分泌细胞因子刺激,增强了细胞生物学功能,与大鼠BM-EPCs单细胞相比,EPCs膜片中细胞旁分泌SDF-1α,VEGF等重要因子的作用更强,这些关键因子进一步激活下游信号通路介导并强化相应细胞学生物功能。本研究初步确定了EPCs膜片生物学功能优势,可为进一步的研究提供了参考。但本研究还存在一些不足,今后将对更多的旁分泌的关键因子及其发挥作用的关键信号通路进行深入研究。



