朱明君,陆晓媛,方月兰
(1.徐州医科大学附属宿迁医院妇产科,江苏宿迁 223800;2.徐州医科大学附属医院妇产科,江苏徐州 221004)
宫颈癌是女性癌症相关死亡的主要原因[1]。降低宫颈癌病死率、改善预后是临床妇科工作重点。尽管已经提出了多种与宫颈癌进展有关的病理学机制,但仍需要进一步的研究来揭示宫颈癌的发生机制[2]。据报道,组氨酸磷酸酶(LHPP)是一种肿瘤抑制因子[3]。组氨酸磷酸化在多种生物学过程中发挥重要作用,目前LHPP表达在肿瘤发生、发展中作用成为研究热点。既往研究发现人宫颈癌组织中的LHPP表达水平低于正常组织标本[4],但LHPP表达与宫颈癌预后及临床特征间关系报道较少。本研究探讨LHPP蛋白在宫颈癌中表达情况,以及其临床意义及对患者预后的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2012年1月至2014年12月徐州医科大学附属宿迁医院存档的石蜡组织标本,包括90例宫颈癌标本(A组),90例宫颈鳞状上皮内病变标本(B组,其中低级别鳞状上皮内病变40例,高级别鳞状上皮内病变50例)和90例慢性宫颈炎标本(C组)。纳入标准:(1)均存在明确的病理诊断,均由两名以上经验丰富的病理医师进行阅片确诊;(2)宫颈癌病例按国际妇产科联盟2018年的临床分期标准进行分期,组织病理分级按国际妇产科联合会(FIGO)分级方法评定为ⅠA~ⅡA期[5],所收集的宫颈癌标本患者术前均未接受过放疗、化疗或免疫治疗,宫颈癌患者均可获得术后随访资料;(3)宫颈鳞状上皮内病变患者标本来自电子阴道镜下多点活检标本和(或)宫颈锥切术后标本或全子宫切除标本;(4)慢性宫颈炎组织标本均来自同期因子宫肌瘤或其他非宫颈性病变行子宫全切术的病例;(5)患者未合并其他肿瘤。排除标准:(1)来源于其他肿瘤的转移癌;(2)术前进行化疗、放疗或药物治疗;(3)合并免疫系统疾病。本研究取得徐州医科大学附属宿迁医院伦理委员会批准,标本采集取得患者本人或家属知情同意。
1.2 方法
1.2.1主要试剂及仪器
兔抗人LHPP抗体(美国Abcam公司,货号ab254788-100 μL),即用型高效免疫组织化学二抗试剂盒(上海爱必信生物科技有限公司,货号abs957-5 mL),石蜡组织切片机(Leica RM2015),病理组织漂烘仪(PHY-Ⅲ),电热恒温干燥箱(GZX-DH-400-BS)。
1.2.2LHPP检测方法
采用免疫组织化学第二代聚合酶标两步法(PV法)检测LHPP在各宫颈组织中表达水平[3]。具体步骤:石蜡包埋的宫颈组织常规切片;切片烘干、脱蜡、水化;柠檬酸钠缓冲液中高压修复抗原15 min;加入过氧化氢孵育10 min;磷酸缓冲盐溶液(PBS)洗2~3次各5 min;加入超级封闭液孵育5 min以减少非特异性染色;加一抗,室温孵育20 min;PBS洗2~3次各5 min;加入一抗放大剂孵育10 min;PBS洗2~3次各5 min;加入酶标二抗聚合物孵育10 min;PBS洗2~3次各5 min;DAB显色;苏木素复染;常规脱水,透明,封片,阅片。
1.2.3免疫组织化学结果评定
(1)免疫组织化学结果请病理科主任医师双盲法阅片。免疫组织化学阳性表达为境界清晰,突出于背景的中黄或棕褐色颗粒,存在于细胞质或细胞核内为阳性细胞。(2)免疫组织化学判读方法[3]:①根据着色强度:0分为无色,1分为浅黄色,2分为中黄色,3分为棕黄色;②根据阳性细胞比例:<25%为1分,25%~<50%为2分,50%~<75%为3分,≥75%为4分;③两种积分相乘总分:≤3分为阴性,>3分为阳性。
1.2.4治疗方法
所有患者均接受腹腔镜手术,同步放化疗:术后放疗2 Gy/次,共40~60 Gy,共20~23次,顺铂40 mg/m2,每周1次,共4~5次。化疗:紫杉醇135~175 mg/m2加顺铂75 mg/m2,每周3次,共4个疗程。本研究中共19例术后接受单纯辅助化疗,71例接受同步放化疗。
1.2.5随访方法
手术时间为随访开始时间,随访截至2020年1月。总体生存(overall survival,OS)期定义为随访开始时间至随访截止时间或死亡时间。通过电话随访,每半年进行1次随访,随访终点为宫颈癌相关死亡。
1.3 统计学处理
采用SPSS26.0软件进行数据分析,计数资料以频数或百分率表示,比较采用χ2检验分析,用Kaplan-Meier法和Log-rank法行生存分析并绘制生存曲线,使用单、多因素Cox分析进行预后分析,以P<0.05为差异有统计学意义
2 结 果
2.1 不同宫颈标本LHPP表达情况
A组25例(27.8%)LHPP表达阳性,B组41例(45.6%)LHPP表达阳性,其中低级别鳞状上皮内病变24例(26.7%)LHPP表达阳性,高级别鳞状上皮内病变17例(18.9%)LHPP表达阳性,C组69例(76.7%)LHPP表达阳性,3组LHPP表达阳性率比较,差异有统计学意义(χ2=44.089,P<0.001)。高级别鳞状上皮内病变LHPP表达阳性率低于低级别鳞状上皮内病变(χ2=6.057,P=0.014),见图1。
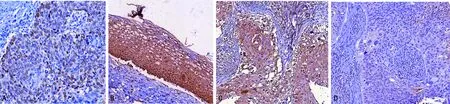
A:宫颈鳞状上皮内病变LHPP阳性表达;B:慢性宫颈炎LHPP阳性表达;C:宫颈癌组织LHPP阳性表达;D:宫颈癌组织LHPP阴性表达。
2.2 不同LHPP表达情况比较
LHPP表达阳性患者肿瘤分期ⅡA比例和淋巴血管侵犯率低于LHPP表达阴性患者,差异有统计学意义(P<0.05),见表1。
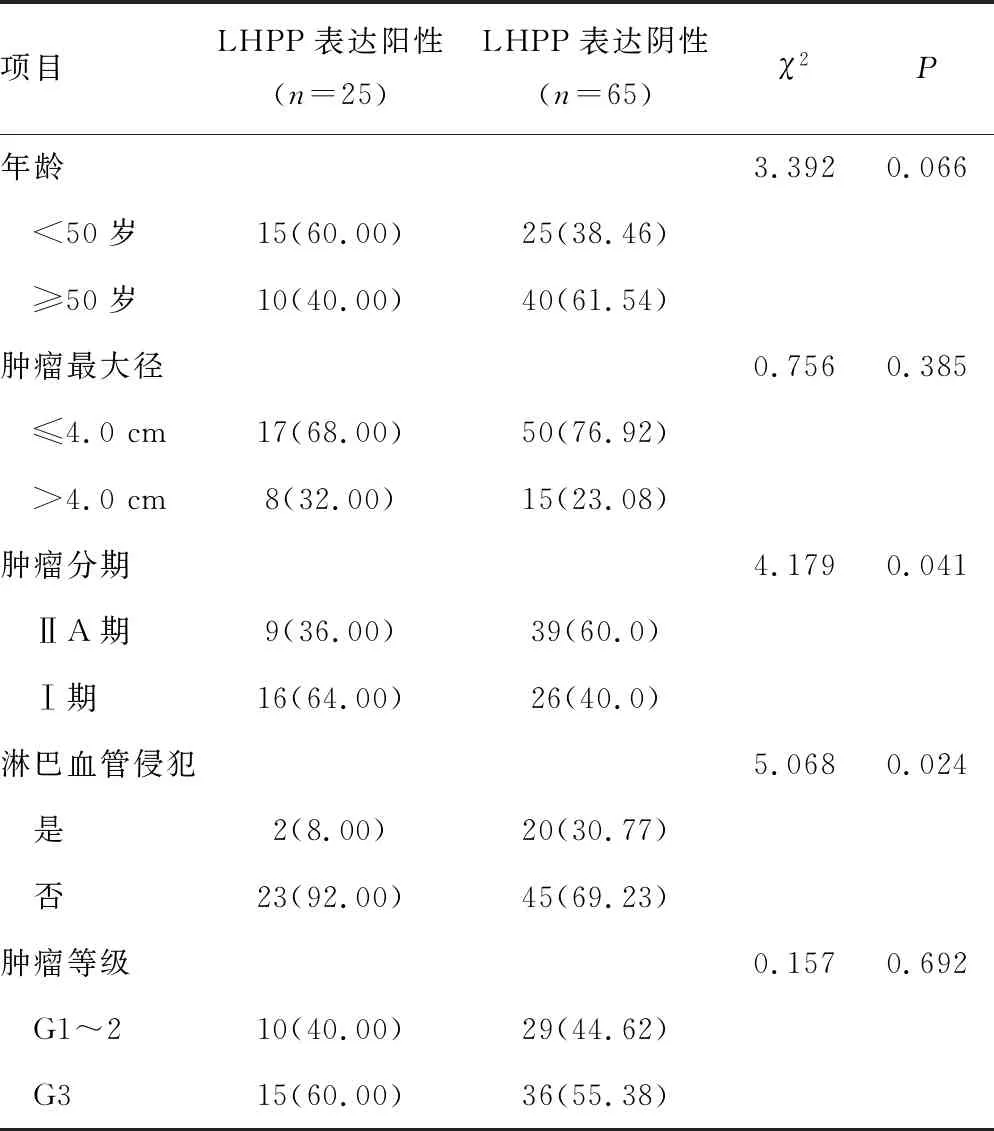
表1 不同LHPP表达情况比较[n(%)]
2.3 不同LHPP表达情况的宫颈癌生存曲线
随访时间48~75个月,平均(58.9±7.8)个月,共19例患者死亡,其中5年内死亡14例,5年OS率为84.4%。Kaplan-Meier法并Log-rank检验显示,LHPP表达阳性患者累积生存率高于LHPP表达阴性患者(Log-rankχ2=4.025,P=0.040),见图2。LHPP表达阳性患者3年OS率为96.0%,高于对照组的78.2%(χ2=4.010,P=0.045)。
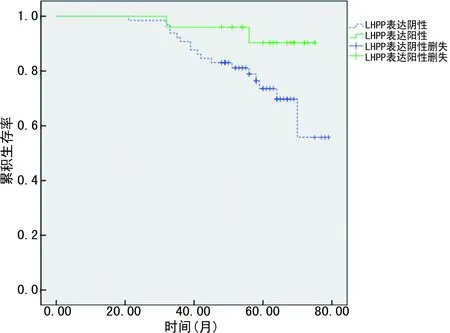
图2 不同LHPP表达情况的宫颈癌患者生存曲线
2.4 宫颈癌OS的影响因素分析
Cox单因素分析结果显示,肿瘤分期、淋巴血管侵犯、肿瘤等级、LHPP表达是宫颈癌患者OS的影响因素(P<0.05)。将年龄、肿瘤最大径、肿瘤分期、淋巴血管侵犯、辅助化疗、同步放化疗、肿瘤等级、LHPP表达作为自变量,将OS作为因变量进行Cox多因素分析,结果显示肿瘤分期、肿瘤等级、LHPP表达是宫颈癌患者OS的独立影响因素(P<0.05),见表2、3。
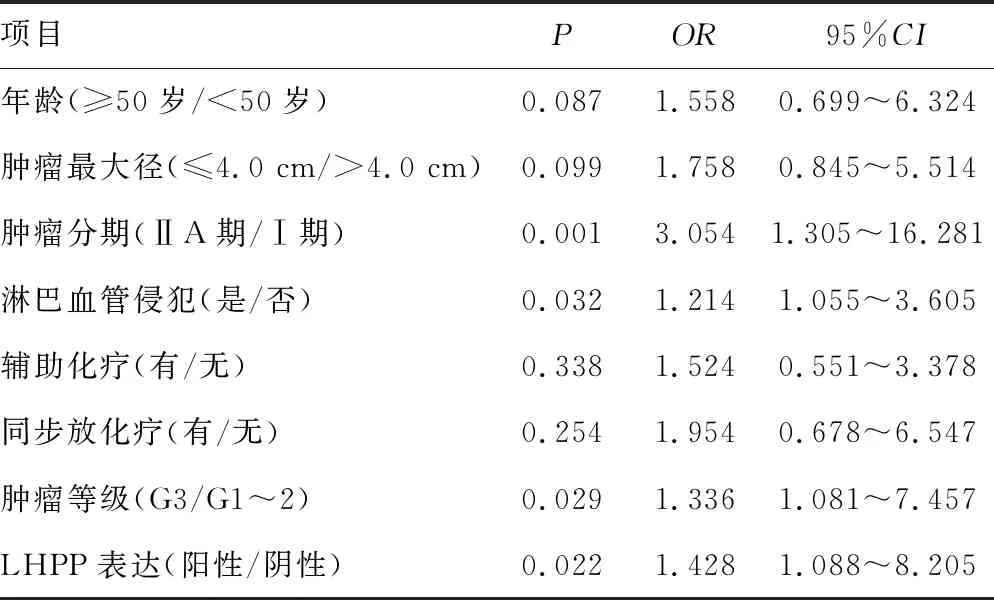
表2 宫颈癌OS的单因素分析
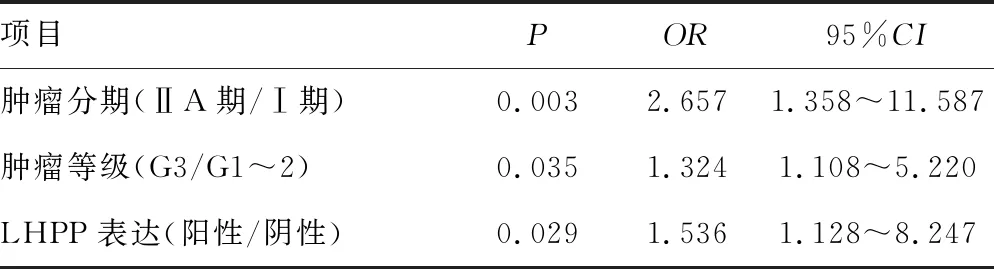
表3 宫颈癌OS的多因素分析
3 讨 论
在癌症中广泛观察到激酶或磷酸酶失调,如LHPP、蛋白激酶B(AKT)、蛋白酪氨酸磷酸酶基因(PTEN)等。LHPP从蠕虫到人均具有28%的同一性,最初在猪的脑组织中被发现。最近,LHPP通过靶向作用于磷脂酰肌醇三激酶(PI3K)/AKT信号通路,被鉴定为肝细胞癌等多种肿瘤的抑癌基因[6]。它在肝癌标本中低表达,其低表达与肝癌患者的不良生存相关[6]。在另一项研究中,LHPP在胰腺癌中下调,而LHPP沉默可促进胰腺癌的进展[7]。人胃腺癌组织中,LHPP表达也下调,且与胃癌的分化程度密切相关[8]。
LHPP在宫颈癌中的研究报道较少,ZHENG等[9]研究报道,LHPP在宫颈癌中低表达,下调的LHPP通过调节AKT,在宫颈癌中影响细胞增殖、转移和细胞凋亡。本研究观察了LHPP蛋白在宫颈癌组织中的表达情况,证实LHPP在宫颈癌组织中的表达下调,该结果与既往研究相符[9]。本研究显示,随着宫颈病变程度的加重,LHPP阳性表达率随之降低,说明LHPP表达与宫颈病变程度密切相关,LHPP随宫颈病变进展表达递减。在宫颈癌患者中,LHPP表达阳性患者ⅡA期比例及淋巴血管侵犯率明显低于LHPP表达阴性患者,提示LHPP表达下调可增加较高肿瘤分期及淋巴血管侵犯的风险。既往研究在其他肿瘤中观察到LHPP表达下调增加肿瘤淋巴转移和进展风险,如胃癌、胰腺癌、结直肠癌等[7-8,10]。
本研究证实LHPP表达阳性患者累积生存率高于LHPP表达阴性患者,且LHPP表达情况是宫颈癌患者OS的独立影响因素,LHPP表达下调的患者死亡风险增高,预后更差,LHPP表达可能成为宫颈癌预后标志物。
LHPP基因位于10号染色体,在人脑、肾、肝和膀胱组织中普遍表达,其与肿瘤发生密切相关,被认为是抑癌基因[11-13]。目前,LHPP表达与宫颈癌进展的关系仍不明确。多数研究支持LHPP阳性表达抑制了肿瘤生长和转移,是宫颈癌的抑制因子,过表达减少了细胞增殖、迁移和侵袭。ZHENG等[9]研究显示,过表达的LHPP通过促进裂解的半胱氨酸蛋白酶-3和PARP诱导人宫颈癌细胞凋亡,LHPP可阻止宫颈癌细胞增殖和转移,并触发细胞凋亡。且ZHENG等[9]在体内通过抑制细胞增殖和转移、诱导凋亡证实了LHPP的抗宫颈癌作用。PTEN/PI3K/AKT信号通路直接或间接参与癌症发展,对该途径任何成分的调节异常都会导致细胞增殖失控,细胞凋亡受到抑制,细胞代谢改变和肿瘤发生[14]。而LHPP在PTEN/PI3K/AKT信号通路的调节中具有重要作用[15]。目前LHPP在宫颈癌中发挥抑癌作用的机制尚不清楚,是否通过PTEN/PI3K/AKT信号通路发挥抗肿瘤作用仍待体外研究证实。本研究患者5年OS率为84.4%,与余淼等[16]报道的ⅠB~ⅡA2期早期宫颈癌5年OS率(84.1%)相差不大。大样本量调查显示,Ⅰ~Ⅱ期早期宫颈癌5年疾病特异性OS率为73.7%~97.8%,5年OS率为40.6%~84.5%[17]。由于病例数不足,本研究的OS率符合既往研究。不同研究中OS率不同可能与病理选择、治疗、分化程度、淋巴血管侵犯、年龄等有关,本研究结论仍待大样本量研究证实。
综上所述,LHPP表达与宫颈癌预后及病理相关,随着阳性率降低,死亡风险及淋巴血管侵犯风险增高。



