鲁淑婷,姚金红,李少阳,李玉龙
(1.河南省郑州市第一人民医院检验科 450004;2.河南省人民医院血液病研究所,郑州 450003)
位于11号染色体长臂的磷脂酰肌醇结合网格蛋白装配蛋白淋髓白血病基因(phosphatidylinositol-binding clathrin assembly lymphoid myeloid leukemia,PICALM)和10号染色体短臂的混合系列白血病基因易位至10号染色体基因(mixed-lineage leukemia;translocated to,10,MLLT10),由于t(10;11)(p13;q14)易位所产生的PICALM-MLLT10(P/M)融合基因,是一种少见的重现性遗传学异常,可见于7%~10%的T 淋巴细胞白血病(T-ALL)患者[1],伴P/M的急性非淋巴细胞白血病(acute nonlymphoblastic leukemia,ANLL)更为罕见。为对该类疾病有更深入了解,笔者回顾性分析本院确诊的2例P/M+ANLL患者的临床及实验室特征,并复习相关文献。
1 资料与方法
1.1 一般资料
河南省人民医院2012年3月至2020年3月间,共发现3例伴t(10;11)(p13;q14)的ANLL患者。第1例因发现时间较早,未能证实是否为P/M+ANLL。后2例均证实P/M融合基因的存在。患者1,男,47岁,因“颈部异物感1个月”于2019年10月11日于河南省人民医院就诊。查体:头颈及颜面部水肿,皮温增高,球结膜水肿。双侧颈静脉怒张,口唇紫绀,前胸可见胸壁静脉,双上肢肿胀,考虑上腔静脉综合征。CT示:上纵隔异常密度影。心电图示:频发房性早搏。查血常规,白细胞计数(WBC) 85.35×109/L,红细胞计数(RBC) 4.22×1012/L,血红蛋白(HGB) 120.0 g/L,血小板计数(PLT) 102×109/L。患者2,男,32岁,因1个月前无明显诱因出现乏力,头晕,气短,半月前出现发热,咳嗽,间断鼻出血于2019年11月28日于河南省人民医院就诊。 查血常规:WBC 7.97×109/L,HGB 55 g/L,PLT 8×109/L。给予输悬浮红细胞,血小板。CT示:前纵隔异常密度影。2例患者经骨髓穿刺涂片均考虑急性白血病,进一步行免疫分型,细胞遗传学、分子生物学检测。
1.2 方法
1.2.1骨髓细胞形态学分析
从患者髂后上棘穿刺,抽取骨髓,常规推片,瑞姬氏染色,光学显微镜下进行分类计数,并行过氧化物酶(myeloperoxidase,MPO)和非特异性酯酶(nonspecific esterase,NAE)等免疫组织化学染色。
1.2.2免疫表型检测
取抗凝骨髓样本,常规四色免疫荧光抗体(FITC、PE、PerCP、APC)标记,采 用 流 式 细 胞 仪(美 国 BD 公 司 FACSCalibur、FACSCanto Ⅱ)进行检测。检测抗原包括CD34、HLA-DR、CD10、CD19、CD20、CD7、CD38、CD117、CD13、CD33、CD11b、CD14、CD64、CD3、CD4、CD8、CD5、CD56、cMPO、cCD79a、cCD3等。异常细胞膜抗原表达大于20%,细胞质抗原表达大于10%为阳性。
1.2.3染色体核型分析
取肝素抗凝骨髓样本,用含20%胎牛血清的RPMI-1640培养基常规培养24 h,R显带,光学显微镜下分析至少20个中期分裂相。结果根据《人类细胞遗传学国际命名体制 (ISCN 2016)》进行描述。
1.2.4白血病相关融合基因检测
取EDTA抗凝骨髓样本,TRIzol法抽提总RNA后按照试剂盒(上海源奇生物医药科技有限公司)说明书,采用实时荧光定量PCR仪(美国ABI 7500)进行检测。PCR产物送上海生物工程技术有限公司进行序列测定。
2 结 果
2.1 骨髓细胞形态学
患者1外周血涂片发现原幼细胞93%。骨髓细胞形态学显示:原始细胞90%,核圆形,可见扭曲凹陷,染色质粗颗粒状。该类细胞过氧化物酶(MPO)呈阴性,部分原幼细胞非特异酯酶(NAE)呈阳性,且不被氟化钠抑制。患者2外周血涂片发现幼稚细胞占79%,骨髓细胞形态学显示:原幼细胞82%,MPO呈阴性,少部分原幼细胞NAE呈弱阳性,不被氟化钠抑制。
2.2 流式细胞学检测
患者1流式细胞学检测,异常细胞占85.5%,表达CD34、CD117、CD33、CD56、CD71,部分表达CD123、CD7,不表达CD11b、CD15、CD13、CD64、CD14、CD300e、CD38、CDHLA-DR、CD10、CD19、CD20、CD3、CD8、CD4、CD2、cCD79a、CD22、CDTdT、cCD3、MPO、CD5、CD235a、CD36、CD61、CD41、CD42b、CD94、CD161,为异常髓系幼稚细胞伴CD56、CD7阳性。结合形态学,诊断急性髓系白血病微分化型(minimally differentiated acute myeloid leukemia,AML-M0)。患者2流式细胞学检测,异常细胞占77.77%,表达CD34、CD38、CD33、CD19、CD71,部分表达DR、CD13、CD123、CD7、TDT,不表达CD117、CD11b、CD15、CD64、CD14、CD300e、CD10、CD20、CD3、CD8、CD4、CD2、CD56、cCD3、MPO、cCD79a、CD22、CD5、CD235a、CD36、CD61、CD41、CD42。符合急性未分化细胞白血病(acute undifferentiated leukemia,AUL)表型特征。
2.3 细胞遗传学检测
患者1细胞遗传学检测显示46,XY,t(10;11)(p13;q14),del(18)(q11)[20]。患者2细胞遗传学检测结果47,XY,t(10;11)(p13;q14),add(16)(p13),+17[14]/48,idem,+18[5]/46,XY[1],见图1。

箭头所指分别为易位后的10号、11号染色体、add(16)和+17。
2.4 分子生物学检测
2例患者56种白血病融合基因筛查均显示P/M阳性。均经一代测序验证,证实PICALM 19号外显子与MLLT10 4号外显子融合(图2)。患者1白血病突变基因筛查未发现AML相关基因突变。患者2发现SH2B3、PHF6、NRAS、IDH1、NOTCH1突变。
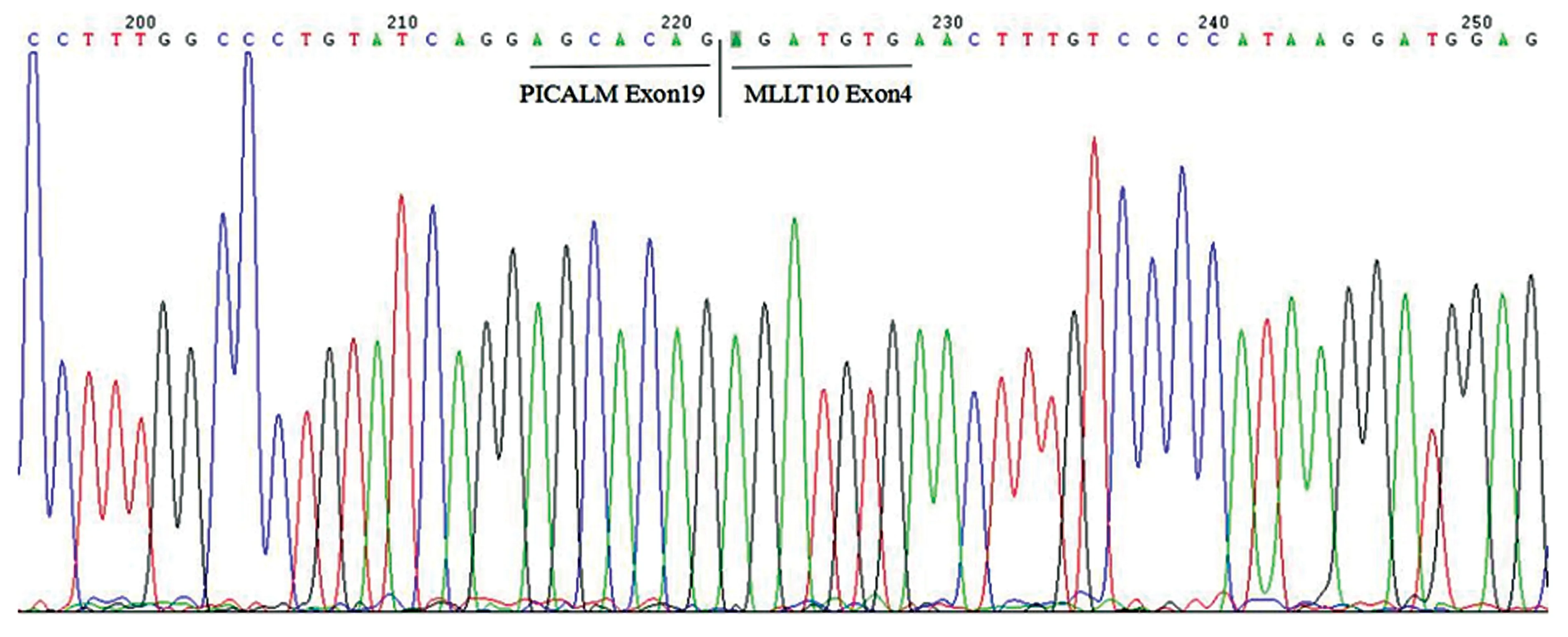
图2 2例患者 PICALM/MLLT10融合基因PCR产物测序结果
2.5 治疗及随访
患者1结合形态及免疫分型结果,诊断AML-M0。2019年10月15日给予“阿糖胞苷+地塞米松+伊达比星+氨磷汀”。2019年10月21日复查,外周血原幼细胞28%,骨髓原幼细胞34%。CT示前上纵隔病变范围变化不明显。2019年10月24日,患者开始发热,查血常规显示WBC 0.16×109/L,PLT 5×109/L,给予血小板输注及“替考拉宁+亚胺培南”抗感染。2019年11月2日患者突发窄QRS心动过速,235次/分,胺碘酮转复,测血压82/55 mm Hg。患者拒绝继续治疗,要求出院。1个月后死亡。
患者2依据骨髓细胞形态特征及免疫分型诊断AUL。2019年12月4日,给予“去甲氧柔红霉素+阿糖胞苷+依托泊苷”,2019年12月28日,复查骨髓原幼细胞79.2%,外周血原幼细胞20%。2020年1月7日给予“伊达比星+氟达拉滨+阿糖胞苷+粒细胞集落刺激因子”,2020年2月1日查骨髓原幼细胞80%。分别于2020年2月15日、4月3日行“维奈克拉+高三尖杉酯碱”方案化疗,复查骨髓原幼细胞占8.4%。2020年5月18日、7月28日行“维奈克拉+高三尖杉酯碱+阿扎胞苷”方案化疗。复查骨髓原幼细胞占67.2%。2020年10月14日患者因多脏器衰竭,感染性休克于ICU抢救24 h后,要求出院,2 d后死亡。
2.6 文献复习
连同本文的2例患者,目前共报道42例P/M+ANLL[2-10]。16例明确白血病亚型的病例中,M0 5例,M1 3例,AUL、M5 各2例,M2、M4、粒细胞肉瘤(granulocytic sarcoma,GS)、急性双表型白血病各1例。但据部分文献提供的免疫表型资料,随着诊断标准的更新,有3例M0型患者符合AUL[5-6,10]。所以,在16例P/M+ANLL患者中占比最高的是AUL,占31.25%。笔者总结了包括本文在内的13例有详细临床资料的病例(表1),其中AUL 3例,M1 3例,M0、M5 各2例,M4、GS、未提供亚型AML(根据免疫表型,非M0)各 1例。4例接受造血干细胞移植(HSCT),100%获得CR,3例于报道之时分别生存1、5、180个月,仍都处于CR状态,1例已死亡,生存期31个月。 9例化疗患者,2例(22.2%)获得CR,最长生存期18个月。这13例患者中共3例AUL,2例初诊时遗传学检测为复杂核型,另有1例于复发时呈现复杂核型;2例经HSCT获得CR,1例化疗患者未获CR。余10例其他亚型AML患者,4例为复杂核型。行HSCT的2例患者均获得CR,其中就有1例为复杂核型,其余8例中2例化疗获得CR,均为非复杂核型患者。
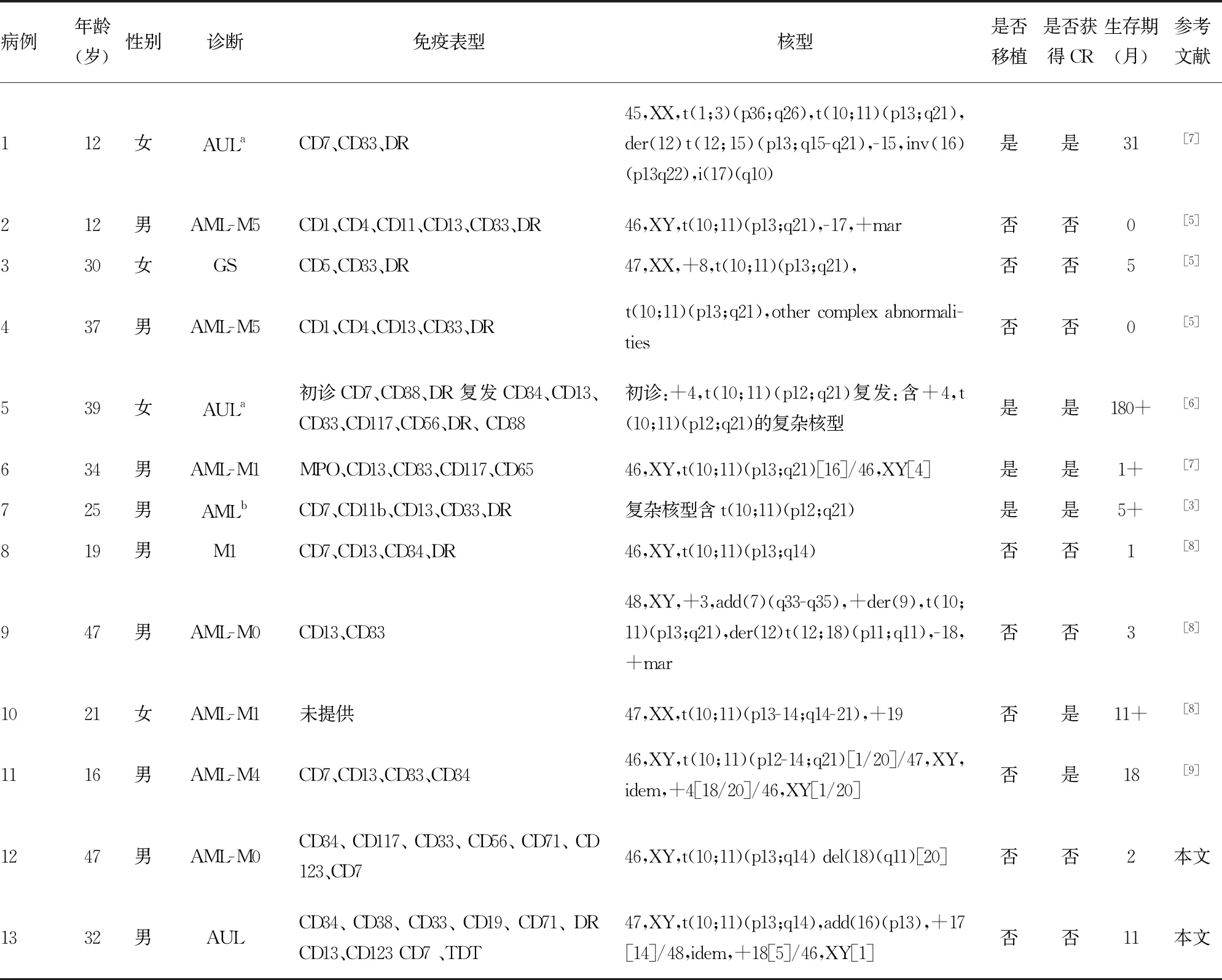
表1 13例P/M+ ANLL患者临床资料
3 讨 论
PICALM基因编码蛋白质的前289个氨基酸,与鼠、牛的网格蛋白装配蛋白3(clathrin assembly protein,AP3)具有80%的同源性,可将网格蛋白连接到负责胞吞的转运囊泡表面的小凹上,从而参与胞吞作用[11]。其与10号染色体短臂的MLLT10基因形成的P/M融合基因是一种少见的重现性遗传学异常,且在淋巴细胞系与髓系白血病中均有发现。目前共有7种不同的P/M转录本被报道,但不同的断裂点对最终融合基因的影响很小,且PICALM 1926/MLLT10 883、 PICALM 2091/MLLT10 589、PICALM 2091/ MLLT10 979在 AML 和 ALL中都有报道[12]。所以目前认为不同的P/M转录本类型与白血病类型无关。
P/M是T-ALL最常见的融合基因,占T-ALL患者的7%~10%[4],目前为止全世界共报道86例P/M+T-ALL[1-2,13-16,1],国内亦有报道[17]。P/M+ANLL的发生率低于P/M+T-ALL,其中AUL超过30%,这可能与P/M和Ikaros基因相互作用,引起系别发育紊乱有关。Ikaros 是一种参与多能干细胞向淋巴细胞系特异性分化的转录因子。P/M通过MLLT10上的亮氨酸拉链结构域与Ikaros相互作用,抑制其同源二聚体的形成,阻止其对其靶基因的招募,阻断细胞的正常淋巴细胞系分化[18]。P/M+AML小鼠原始细胞表面常可检测到淋巴细胞系标志B220的表达及免疫球蛋白重链D区(IGH,D),J区的克隆性重排,都提示恶性转化发生在多能造血干细胞阶段[19]。
除表型异常之外,P/M+白血病还具有发病年龄较轻,多伴纵隔肿块的特征[3],提示其髓外浸润倾向。大部分报道认为,P/M+白血病预后较差,但其结论大多来自零星的病例报道,针对P/M+ANLL的报道则更少。目前为止病例数量最大的报道是BOREL等[4]报道的18例P/M+ANLL,结果显示其总生存期、2年无病生存率、2年总生存率与P/M-ANLL患者无明显差别(12.3个月vs.19.9个月,P=0.56;39%vs.46%,P=0.60;36%vs.47%,P=0.56)。但是该18例患者中7例接受了造血干细胞移植 (human stem cell transplantation,HSCT),而且BOREL没有列出每个患者的具体分型,笔者无法确定免疫分型和移植对预后的影响。
由于病例数较少及随访时间短等因素,无法比较P/M+AUL患者与P/M+AML患者预后是否有差异。但P/M+AUL患者遗传学复杂程度可能较P/M+AML 患者更甚。除上述复杂核型比例较高外,如本文报道的患者1为AML-M0,白血病突变基因检测为阴性。而患者2为AUL,检测到SH2B3、PHF6、NRAS、IDH1、NOTCH1的突变。复杂的细胞和分子遗传学背景有可能导致该类白血病预后较差。
综上所述,P/M+ANLL是一种罕见的临床疾病类型,其中AUL的比例最高,且该类患者遗传学异常较P/M+AML更复杂。P/M+ANLL对化疗的反应整体较差,HSCT可使其获得较高的CR率。但是能否改善该类患者的生存,尚需更多病例和更长时间的随访。



