童富云,徐美玲,张 超,孙荣华,阚庆辉,黄 波,石勇胜
(重庆市涪陵中心医院乳腺甲状腺外科 408000)
三阴性乳腺癌(triple negative breast cancer,TNBC)是乳腺癌的一种特殊病理类型,具有较高的临床异质性,早期恶性侵袭和转移力强,患者预后多不理想[1]。临床诊断时多缺乏早期手术根治机会,以新辅助放、化疗降低肿瘤负荷,争取手术机会为主[2]。TNBC以中青年女性为患病主体,对生育和乳腺外观的要求较高,因此,保乳根治术的应用也较多[3]。也有研究表明,保乳根治术的累积生存率不差于乳腺切除根治术,肿瘤复发率也无明显增加,患者总体预后较满意[4]。影响保乳根治术的临床疗效的主要预测因素是肿瘤根治性切除和切缘阴性,术前准确的影像学检查和乳房切除范围对手术成败具有重要意义[5]。超声检查是乳腺癌筛查、肿瘤临床分期、指导手术切除范围、评估临床疗效及随访检查的主要工具,具有操作简便、易重复、图像清晰、结果准确、费用低廉等优点[6];但超声体表定位法易受患者肥胖体型、体位变动、肿瘤位置及大小、检查者经验水平等因素影响,与术中探查结果往往有一定出入,影响了肿瘤切除范围和切缘阴性率[7]。高分辨率磁共振检查已成为乳腺癌诊断和术前评估的重要方式,对TNBC具有较好的灵敏度,能较准确地区分肿瘤与周围正常组织,有利于指导术前确定肿瘤切除范围[8]。并且磁共振成像(MRI)可通过多种序列成像及后处理技术精确勾勒肿瘤病灶,确定切除范围,尽可能保留乳房正常组织,有利于术后乳房外形的重建[9]。基于此,本研究比较了MRI多序列成像与超声体表定位在患者接受新辅助化疗后保乳手术中的应用效果,旨在为临床提供更准确的手术方案。
1 资料与方法
1.1 一般资料
采用临床前瞻性对照方法,选取2018年10月至2020年10月本院确诊的TNBC患者124例,均接受新辅助化疗(多西他赛联合卡铂)。采用随机数字法分为对照组和观察组,每组62例。两组患者年龄、临床分期等一般临床资料比较,差异均无统计学意义(P>0.05) ,具有可比性,见表1。
1.2 纳入标准
(1)符合TNBC病理诊断标准;(2)能接受至少4个疗程的新辅助化疗,达到应用保乳手术的指征;(3)取得知情同意权,临床资料完整。
1.3 排除标准
(1)非TNBC,乳腺癌伴远处脏器转移;(2)严重肝、肾功能障碍;(3)妊娠或哺乳期女性。
1.4 方法
1.4.1治疗方法
两组患者入院后均完善相关检查,评估疾病严重程度和身体状况,选择恰当的化疗方案,参照相关指南进行。以多西他赛联合卡铂为主,21 d为1个疗程,连续治疗4~6个疗程。定期检查血液指标评估化疗风险和不良反应,对出现严重化疗不良反应患者立即停止化疗。保乳根治术由本院经验丰富的手术和护理团队进行。
表1 两组患者一般资料比较
1.4.2确定手术切除范围
1.4.2.1对照组
采用超声体表定位法,具体方法:采用意大利Esaote MyLab ClassC型彩色多普勒超声诊断仪及配套LA523型高频线阵探头,频率4~9 MHz,显像模式选择“Breast”。患者取仰卧位,双侧手臂尽量上抬外展,充分暴露乳房及腋下,探头直接放在乳房表面,对乳腺及周围组织进行全面常规二维超声检查,以乳头为中心行放射性检查,然后对病灶区域进行重点检查。确定病灶钟点方位,测量距乳头和皮肤的距离,在对应皮肤表面做标记。
1.4.2.2观察组
采用MRI多序列成像(T1WI、T2WI、DWI、T2WI/SPAIR、DCE等)确定保乳手术切除范围。具体方法:采用美国Philips 3.0 T MRI仪及乳腺表面相控阵线圈。患者取仰卧位头先进,自由呼吸连续扫描,扫描范围包括双侧乳腺组织和腋窝软组织。横轴位T1WI扫描参数为重复时间(repetition time,TR):569 ms,回波时间(echo time,TE):8 ms,视野(view,FOV):280 mm×341 mm×160 mm,矩阵:512×512,层厚:4 mm,间距:0 mm;横轴位T2WI扫描参数为TR:3 655 ms,TE:120 ms,FOV:280 mm×341 mm×160 mm,矩阵:432×432,层厚:4 mm,间距:0 mm;矢状位T2WI/SPAIR扫描参数为TR:2 951 ms,TE:60 ms,FOV:180 mm×262 mm×120 mm,矩阵:512×512,层厚:4 mm,间距:0 mm;增强扫描DCE扫描参数为TR:4.5 ms,TE:2.2 ms,FOV:280 mm×340 mm×150 mm,矩阵:480×480,层厚:3.33 mm,间距:0.67 mm。对比剂采用钆喷酸葡胺注射液0.2 mmol/kg,2.0 mL/s,注射后追加20 mL生理盐水迅速冲管。注射15 s后开始扫描,连续4~5个动态。原始图像传输至后处理工作站,采用系统自动软件结合手动勾勒肿瘤感兴趣区,避开坏死、囊变区域,重复测量3次取平均值,以肿瘤感兴趣区外放0.5~1.0 mm作为手术切除范围。
1.5 观察指标
比较两组患者肿瘤切除指标(包括术前评估肿瘤最大径、肿瘤/乳房体积比、与实际手术切除肿瘤体积吻合率、切缘阴性率等)、手术平均时间和并发症发生率。吻合程度[10]分为完全吻合、基本吻合和不吻合3种,完全吻合为体积误差小于10%,基本吻合为体积误差10%~30%,不吻合为体积误差大于30%。吻合率=(完全吻合例数+基本吻合例数)/总例数×100%。
1.6 统计学处理
2 结 果
2.1 两组患者肿瘤切除指标比较
与对照组比较,观察组患者术前评估肿瘤最大径、肿瘤/乳房体积比均缩小,与实际手术切除肿瘤体积吻合率、切缘阴性率均提高,差异均有统计学意义(P<0.05),见表2。
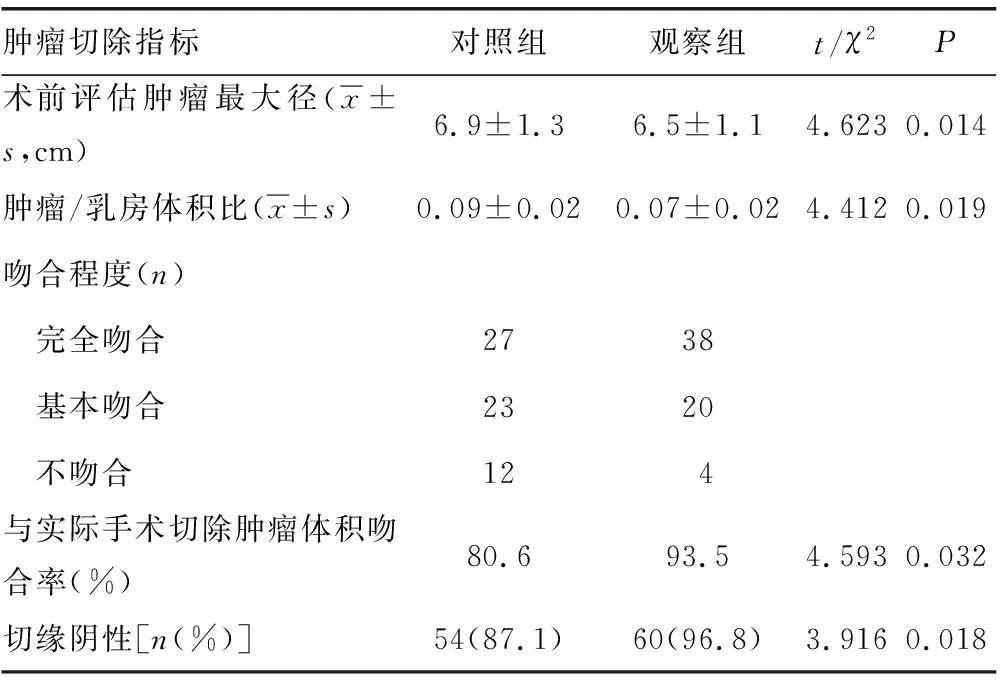
表2 两组患者肿瘤切除指标比较(n=62)
2.2 两组患者手术时间、并发症发生情况比较
观察组患者手术时间[(49.7±9.3)min]与对照组[(45.6±8.9)min]比较,差异无统计学意义(t=0.963,P=0.114);两组患者并发症发生率比较,差异也无统计学意义(P>0.05),见表3。
表3 两组患者并发症发生情况比较[n(%)]
3 讨 论
新辅助放化疗已成为初诊不能直接手术根治乳腺癌患者的首选治疗方案,尤其在TNBC患者中表现更加突出,30.0%~50.0%的患者能重新获得手术切除,对有保乳意愿的患者获益更大[10]。精确的术前评估切除范围及恰当的术后乳房重建是保乳术的重要内容,既可保证肿瘤根治,同时也能最大限度地保留乳房正常组织,便于乳房重建,恢复女性正常生理结构,对术后提升患者的社交信心具有十分重要的意义[11]。
本研究结果显示,与对照组比较,观察组患者术前评估肿瘤最大径、肿瘤/乳房体积比均缩小,与实际手术切除肿瘤体积吻合率、切缘阴性率均提高,差异均有统计学意义(P<0.05)。提示术前通过MRI多序列成像较超声体表定位能提供更精确的肿瘤切除范围,并且与实际手术切除肿瘤体积吻合率更高,减少了乳房切除程度,在不降低肿瘤根治的情况下能保证组织切缘为阴性,不增加术后肿瘤早期复发的风险,具有较好的应用价值。尽管超声二维、彩色、三维,以及弹性成像、造影技术等多种成像手段在乳腺癌诊治中应用越来越多[12-13],但仍存在一定局限性,受患者体型、肿瘤位置及大小、检查者经验程度等因素的影响,在精确制订手术切除方案方面表现欠佳。而MRI对乳腺肿瘤和正常组织鉴定的灵敏度较好,是其在乳腺癌诊断、术前分期和确定切除范围方面应用的主要条件[14-15]。王明瑶等[16]研究表明,MRI多序列成像特征可替代常规穿刺活检病理检查结果,作为乳腺肿块良、恶性质鉴别的依据,并且引导乳腺定位活检能提高穿刺精确度,减少手术创伤。朱龙飞等[17]指出,MRI测量肿瘤/乳腺体积比对评估乳腺癌手术方式具有较好的相关性,能避免扩大手术的应用,保证切缘阴性。杨阳等[18]通过对236例保乳手术患者的临床资料进行回顾性分析发现,术前MRI特征是预测切缘阳性的重要危险因素。MRI常规序列T1WI、T2WI、DWI能确定肿瘤病灶范围,结合T2WI/SPAIR和增强序列DCE能进一步区分肿瘤边界和亚边界(肿瘤与正常组织的浸润区域),从而制订精确的手术切除范围[19]。根据MRI多序列成像特征确定的手术切除范围与实际术中切除范围具有较高的吻合度,既减少了正常乳腺组织的切除范围,也保证了切缘阴性[20]。
此外,本研究两组患者手术时间、并发症发生率比较,差异均无统计学意义(P>0.05),提示术前MRI或超声定位均能为保乳手术提供安全性保障。MRI可实时保存,便于交流和比较,客观性较好,降低了超声对检查者经验的依赖度。并且MRI确定的手术切除范围减少了乳房的创伤程度,更有利于术后乳房重建,恢复女性正常的身体结构,对提高患者生活质量和社交信心具有十分重要的意义。
综上所述,TNBC患者新辅助化疗后保乳手术前应用MRI多序列成像较超声体表定位能提供更准确地切除范围,降低手术创伤程度,有较好的推广应用价值。当然,本研究也具有一定的局限性,如样本量有限、观察时间较短等,尚需更大样本多中心临床随机对照试验进行验证。



