李 晖,李海冰,刘欣哲,张 华
(1.河北省邢台市第三医院骨科 054099;2.河北医科大学第二医院骨科,石家庄 050000)
早在1960年,临床医生就观察到伴有颅脑损伤的肢体骨折患者骨折处骨痂形成更快、体积更大,且后续众多基础研究和临床研究均证实颅脑损伤对肢体骨折愈合具有加速作用,这可能与颅脑损伤后血清和脑脊液中释放的多种激素、细胞因子或相关神经因子对骨代谢的调节有关[1-3]。颅脑损伤可能会激活某些原本在胚胎时期调控骨发生的关键元件,诱导组织分化,促进骨形成。骨折愈合主要依靠骨形成作用,而骨形成是由多种因素调节的复杂而有序的过程。目前已经发现了多条与骨代谢密切相关的信号通路,但颅脑损伤后骨折愈合的具体机制尚不明确。Hedgehog信号通路不仅参与胚胎发育,还与成骨细胞的增殖和分化密切相关,近年来众多研究表明其参与骨形成的调控作用[4-6],但是目前研究多为体外研究和动物实验,临床研究鲜有报道。神经生长因子(nerve growth factor,NGF)是中枢神经系统中最具有代表性的神经营养因子,在大脑中分布广泛和高度表达,在颅脑损伤后,NGF可被释放至外周,可能参与颅脑损伤后骨折愈合[7]。前列腺素(prostaglandins,PGS)是花生四烯酸的环氧产物,可以由体内多种细胞通过自分泌和旁分泌方式释放,其表达水平受中枢神经系统调控和机体应激反应影响,且参与骨代谢[8]。颅脑损伤会激活机体的应激反应,影响中枢神经相关调控,颅内神经营养因子外泄入外周血液循环系统,NGF和PGS可能参与颅脑损伤后骨折愈合。而骨钙素(bone gla protein,BGLAP)是骨形成标志物,是反映骨折愈合的最直接标志物。本研究拟通过临床研究,观察颅脑损伤后骨折加速愈合过程中NGF、PGS、BGLAP及Hedgehog信号通路蛋白的表达,并探讨之间是否存在联系,以期为颅脑损伤后加速骨折愈合的机制研究提供参考。
1 资料与方法
1.1 一般资料
选择2017年1月至2020年1月在河北省邢台市第三医院就诊的138例因车祸导致的新鲜闭合性股骨干骨折患者为研究对象,其中男84例,女54例,年龄20~72岁,平均(32.66±5.35)岁。纳入标准:(1)年龄≥18岁;(2)新鲜闭合性股骨干骨折;(3)临床资料完整;(4)研究组通过磁共振成像(MRI)确定为创伤性脑损伤;(5)与家属谈话,已获得知情同意书。排除标准:(1)特重型颅脑损伤[格拉斯哥昏迷(GCS)评分<6分];(2)合并神经系统疾病;(3)合并糖尿病;(4)合并自身免疫性疾病;(5)合并恶性肿瘤。根据是否合并颅脑损伤分为研究组(60例)和对照组(78例)。研究组为颅脑损伤合并股骨干骨折患者,男35例,女25例;年龄20~70岁,平均(33.47±6.68)岁;骨折分型A1 18例,A2 27例,A3 15例;颅脑损伤轻度19例,中度33例,重度8例。对照组为单纯股骨干骨折患者,男49例,女29例;年龄22~72岁,平均(31.68±7.12)岁;骨折分型A1 25例,A2 44例,A3 19例。两组性别、年龄、骨折分型等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,本研究已获得河北省邢台市第三医院伦理委员会批准。
1.2 方法
1.2.1治疗方法
研究组患者先行开颅血肿清除,然后根据具体情况进行额、颞极切除或去骨瓣减压术,在颅脑情况稳定后转入河北省邢台市第三医院骨科进行骨折治疗。两组患者均根据具体情况进行切开复位内固定手术或带锁髓内固定手术,术后进行常规康复训练。
1.2.2观察指标
术后4、8、12周进行X线片检查,观察骨折愈合情况并测量骨痂面积,骨痂面积=2π×(R2-r2)×L,其中R代表骨痂半径,r代表股骨干半径,L代表骨痂长度,记录并比较两组愈合时间。分别于术后1 d及术后1、4、8、12周抽取患者外周静脉血5 mL于促凝管中,室温放置30 min,3 500 r/min离心取上清液,采用ELISA检测血清NGF、BGALP、PGS、印度豪猪蛋白(Indian hedgehog,Ihh)和锌指转录因子1(Gli family zinc finger protein 1,Gli1)水平,试剂盒由上海江莱生物科技有限公司提供,所有操作严格参照说明书进行。
1.3 统计学处理
2 结 果
2.1 骨痂和愈合时间比较
研究组愈合时间为(11.69±1.47)周,对照组愈合时间为(14.02±1.83)周,两组愈合时间比较,差异有统计学意义(P<0.05)。两组术后4、8、12周骨痂面积比较,研究组均大于对照组,经组间、时间点和组间·时间点交互效应比较,差异均有统计学意义(P<0.05),见表1。
表1 两组术后不同时间骨痂面积比较
2.2 Hedgehog通路相关蛋白比较
术后1 d至术后12周研究组Ihh、Gli1表达水平均高于对照组,组间、时间点和组间·时间点交互效应比较,差异均有统计学意义(P<0.05),见表2、3。
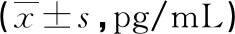
表2 两组术后不同时间血清Ihh水平比较
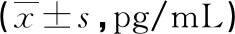
表3 两组术后不同时间血清Gli1水平比较
2.3 NGF、PGS、BGLAP水平比较
术后1 d至术后12周研究组血清NGF、PGS、BGLAP水平均高于对照组,组间、时间点和组间·时间点交互效应比较,差异均有统计学意义(P<0.05),见表4~6。
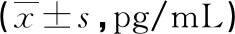
表4 两组术后不同时间血清NGF水平比较
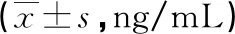
表5 两组术后不同时间血清PGS水平比较
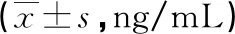
表6 两组术后不同时间血清BGLAP水平比较
2.4 相关性分析
Pearson相关性分析表明,血清NGF、BGLAP、PGS水平与骨痂面积均呈正相关(P<0.05);血清Ihh、Gli1水平与血清NGF、BGLAP、PGS水平及骨痂面积也均呈正相关(P<0.05),见表7。

表7 血清NGF、PGS、BGLAP水平与骨痂面积、Ihh、Gli1水平的相关性分析(n=138)
3 讨 论
目前,临床仍有不少比例的复杂骨折或粉碎性骨折患者因高能量创伤、感染或治疗不当等多种原因导致长骨骨缺损、骨不连或骨不愈合,对于这类患者临床尚无特效治疗方法,主要以手术治疗为主。但手术治疗不仅给患者带来巨大的痛苦和经济负担,而且常常仍难以达到理想效果,这仍然是临床骨科的难题之一。颅脑损伤与骨折愈合之间的联系被报道已久,临床已经证实颅脑损伤患者的长骨骨折表现出更快的愈合速度,这为难愈性骨折和骨缺损的治疗带来了新思路。许多动物实验也发现,颅脑损伤后肢体骨折出现异常增生可能与其体内的颅脑损伤后多条通路途径激活和相关因子调节有关[9],已有体外实验和动物实验聚焦于探究颅脑损伤后骨折加速愈合的机制,但目前尚不完全清楚。Hedgehog信号通路是近年来新提出的骨折愈合通路,本研究拟通过临床研究探讨Hedgehog信号通路是否与颅脑损伤后骨折加速愈合相关,并分析相关促愈合因子的相关性。
Hedgehog信号通路参与包括骨代谢和骨形成在内的人体多种代谢调控。Hedgehog基因于1980年在果蝇中被发现,因该基因突变会导致果蝇呈刺猬状而被命名,包括音速豪猪蛋白(sonic hedgehog,Shh)、沙漠豪猪蛋白(desert hedgehog,Dhh)和Ihh 3种亚型。在人体中,这3种蛋白分别在发育的不同时期被分泌,Shh主要在胚胎时期参与中枢神经系统发育,Dhh主要负责调控外周神经系统发育,Ihh主要负责骨代谢。Ihh通过与其特异性受体跨膜蛋白受体(patched,PTC)结合来激活G-蛋白偶联受体(GPCR),进一步发生级联放大反应,激活下游转录因子锌指蛋白(Gli)的转录,发挥促进软骨细胞和成骨细胞分化的功能[10-11]。本研究中术后4周开始,研究组骨痂面积明显大于对照组,这种差距随着时间的推移愈加明显,且研究组愈合时间较对照组明显缩短,说明颅脑损伤会加速股骨干骨折愈合。同时跟踪Ihh和Gli1两种蛋白,发现研究组术后蛋白水平均明显高于对照组,且研究组在术后4周Ihh和Gli1均已经达到峰值并一直保持在较高水平,而对照组在术后8周Ihh才到达峰值,且Ihh和Gli1一直保持在较低水平。这提示颅脑损伤后Hedgehog信号通路呈现高表达状态,这可能是其加速骨折愈合的原因。
颅脑损伤后脑脊液泄露到外周循环,目前普遍认为外泄的脑源性因子具有骨诱导性,可能参与骨形成作用。NGF是大脑中代表性的神经营养因子,在兔创伤性脑损伤合并胫骨骨折模型中被发现能刺激骨形成[12],在骨折大鼠中同样发现注射外源性NGF能加速骨折愈合[13],体外细胞实验发现NGF培养能刺激成骨细胞分化[14]。王斌等[15]在大鼠骨折模型中采用NGF联合血小板衍生因子进行治疗,发现NGF能通过促进血管内皮生长因子(VEGF)表达来促进血管生成从而达到促进骨折愈合的作用。本研究中研究组血清NGF水平均明显高于对照组,同时检测骨形成标志物BGLAP发现,研究组血清BGLAP水平也明显高于对照组,且其变化趋势与NGF一致,这表明研究组骨形成速度高于对照组,提示颅脑损伤导致的NGF水平提高可能是促进骨折愈合的关键。这可能是因为颅脑损伤后NGF可以透过血脑屏障进入血液循环到达骨折处,促进成骨细胞分化,加速骨形成作用。
除了NGF,PGS近年来也被发现能加速骨形成和骨改建。研究发现,颅脑损伤后血清花生四烯酸水平明显提高,花生四烯酸是PGS的前体,可通过生成PGS来上调BGLAP表达来,促进骨细胞增殖,加速骨矿化,被认为是脑损伤和骨折愈合之间的桥梁[16]。PGS具有刺激骨形成作用,细胞实验表明其能促进成骨细胞增殖[17];体内试验也表明PGS能增加骨基质形成,提高骨组织钙化,促进成骨细胞的增殖和分化,提高骨愈合速度[18]。本研究中,研究组术后血清PGS水平明显高于对照组,这可能是由于颅脑损伤后机体中枢神经上调PGS表达,也可能是颅脑损伤引起的应激反应导致PGS升高。虽然其具体机制尚不清楚,但作者发现PGS的变化趋势与Ihh、Gli1、NGF和BGLAP基本一致,研究组不仅表现出更高的表达水平,并在更早的时间达到峰值,提示这可能与其促进骨愈合相关。本研究进一步进行了相关性分析,发现血清NGF、BGLAP、PGS水平与骨痂面积呈正相关(P<0.05),血清Ihh、Gli1水平与血清NGF、BGLAP、PGS水平及骨痂面积也呈正相关(P<0.05)。
综上所述,本研究经过临床研究发现颅脑损伤后两种促进骨形成的因子NGF和PGS,骨形成标志物BGLAP,Hedgehog通路相关蛋白Ihh和Gli1表达水平均升高,且其相互之间均存在正相关关系,提示Hedgehog通路上调可能会通过级联放大影响下游NGF和PGS水平,进一步促进骨形成,加速骨愈合,但其具体的调控机制还需要进一步研究。



