周龙妹,李 萍,尚育焕,王艳玲,尹春英,李 丹,何培元
(承德医学院附属医院消化内科,河北承德 067000)
结直肠腺癌(colorectal cancer,CRC)患者约占全球所有新发癌症病例的10%,健康人群患CRC的风险为4%~5%[1],是癌症相关死亡的常见原因之一。结直肠癌不仅侵及中老年人群,很多青少年也深受其害[2]。近年来,筛查CRC的方法有结肠镜、粪便隐血试验(FOBT)[3]、CT扫描[4]、粪便免疫化学物表达水平[5-6]、肿瘤标记物[甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原(CA199)][7]表达水平等,但都有其局限性,难以准确进行早期诊断和大规模筛查。因此,寻找一种针对CRC灵敏度高、特异度强的筛查方法是目前该领域关注的重点。丝氨酸蛋白酶抑制剂Kazal-type 4(SPINK4)又称PEC60,最初从猪肠道[8]中分离得到,主要表达于胃肠道和免疫系统[9]。作为一种蛋白酶抑制剂,SPINK4被认为参与了对黏膜和上皮组织蛋白降解的防御。SPINK家族有多个成员,目前已经明确包括SPINK1~SPINK12[10]。近年来,越来越多的文献报道相关成员的作用及其机制,其中SPINK1、SPINK2、SPINK5、SPINK6、SPINK7、SPINK8 被发现与肿瘤的发生、发展存在密切的联系。但是很少有人报道SPINK4与CRC、进展期腺瘤(advanced adenoma,AA)之间的关系。本研究旨在分析血浆SPINK4表达与CRC和AA患者诊断的相关性,以期为临床诊治提供理论依据。
1 资料与方法
1.1 一般资料
收集2020年6月至2021年12月在本院就诊并经结肠镜及病理检查确诊为CRC的患者62例,其中男29例,女33例,年龄(61.90±11.38)岁;突变型p53阴性者20例,突变型p53阳性者42例。经结肠镜及病理检查确诊为AA的患者15例,其中男8例,女7例,年龄(61.13±9.46)岁。纳入标准:(1)经结肠镜及病理检查确诊为CRC或AA;(2)首次确诊;(3)年龄30~80岁。排除标准:(1)合并胆囊炎;(2)合并其他恶性肿瘤;(3)资料不全。选择同期来院体检的健康志愿者22例为HC组,其中男8例,女14例,年龄(51.50±8.04)岁。肿瘤分期按照2016年国际抗癌联盟(UICC)|美国癌症联合委员会(AJCC)TNM分期标准(第八版)进行TMN分期。 本研究经医院伦理委员会批准(2021013),患者及家属已签署知情同意书。
1.2 方法
研究对象空腹采集多管前臂静脉血5 mL,标本在抽血后2 h内进行以下操作:4 ℃下以3 484 r/min离心10 min,吸取上清液至EP管,-80 ℃保存备用,ELISA试剂盒(上海语纯生物有限公司)检测血浆SPINK4表达;其余标本30 min内送检,电化学发光法检测CEA表达(经过校正CEA≥5 μg/L为阳性),全自动化学发光免疫分析仪(cobas 8000 e801)购自北京凯捷有限公司。将获得的CRC组织标本立即置于10%甲醇中固定,进行免疫组织化学检测。操作步骤如下:恒温烤片机烤片,脱蜡;乙醇梯度脱水,乙二胺四乙酸(EDTA)抗原修复,依次孵育一抗和二抗,DAB显色,苏木素染色,封片。
免疫组织化学检测结果判定:每张切片选择染色良好的区域,连续观察5个高倍镜(10×) 视野,每个视野内细胞数>50 个。细胞核或细胞质出现棕黄色或黄褐色颗粒为p53表达阳性。根据细胞染色深浅评分:未显色为0分,浅黄色为1分,棕黄色为2分,黄褐色为3分;按显色细胞的比例评分:无着色细胞或着色细胞≤10%为0分,>10%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。二者乘积数0 分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++) 。
1.3 统计学处理

2 结 果
2.1 各组血浆SPINK4及CEA表达比较
CRC组及AA组血浆SPINK4表达均低于HC组(Z=3.72、-0.41,P<0.05),CRC组CEA表达高于HC组(Z=-3.63,P<0.05),见表1。
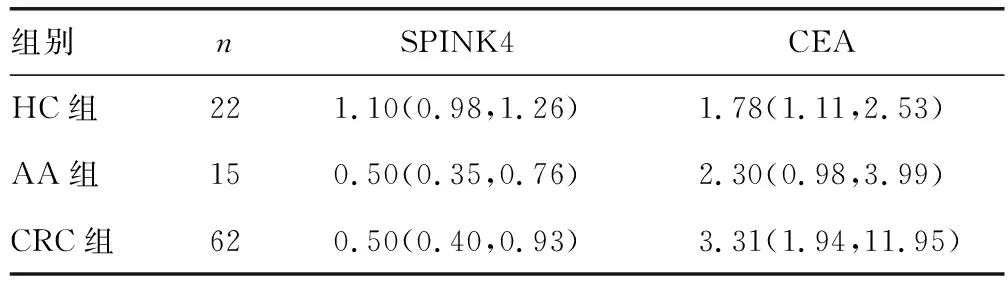
表1 不同人群血浆SPINK4及CEA表达比较[M(Q1,Q3),μg/L]
2.2 SPINK4、CEA单独及联合诊断CRC及AA的临床价值
SPINK4联合CEA诊断CRC及AA的曲线下面积(AUC)、灵敏度、特异度均高于SPINK4、CEA单独诊断,见表2。
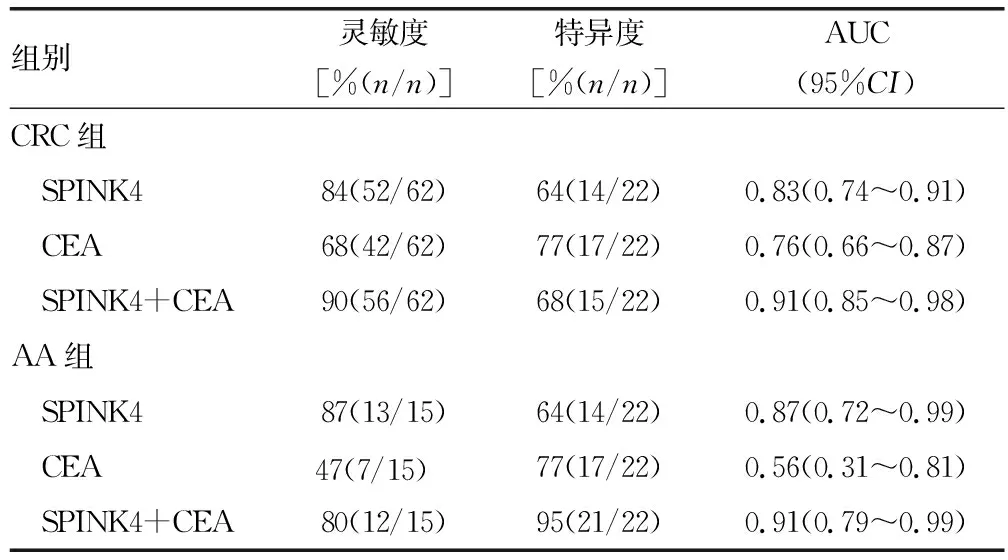
表2 SPINK4、CEA单独及联合诊断CRC及AA的临床应用价值
在诊断CRC时,SPINK4联合CEA的准确度及阴性预测值均高于单独检测;在诊断AA时,SPINK4联合CEA的准确度及阳性预测值均高于单独检测,见表3。

表3 SPINK4、CEA单独及联合诊断CRC及AA的准确度、阳性预测值、阴性预测值
2.3 CRC患者不同临床病理特征血浆SPINK4表达比较
有淋巴结转移CRC患者SPINK4表达低于无淋巴结转移者,Ⅲ、Ⅳ期血浆SPINK4表达低于Ⅰ、Ⅱ期,差异有统计学意义(P<0.05),见表4。

表4 CRC患者不同临床病理特征血浆SPINK4表达比较[M(Q1,Q3),μg/L]
2.4 CRC患者不同临床病理特征与血浆SPINK4表达的相关性分析
CRC患者血浆SPINK4表达与淋巴结转移呈负相关(r=-0.528,P<0.05)。
2.5 p53在CRC组织中表达情况
SPINK4、CEA单独诊断CRC的截断值分别为1.09 μg/L、2.57 μg/L,根据截断值将SPINK4、CEA分为高表达组及低表达组,见图1。SPINK4低表达组和CEA高表达组中突变型p53阳性表达率明显增加(P<0.05),见表5、图2。
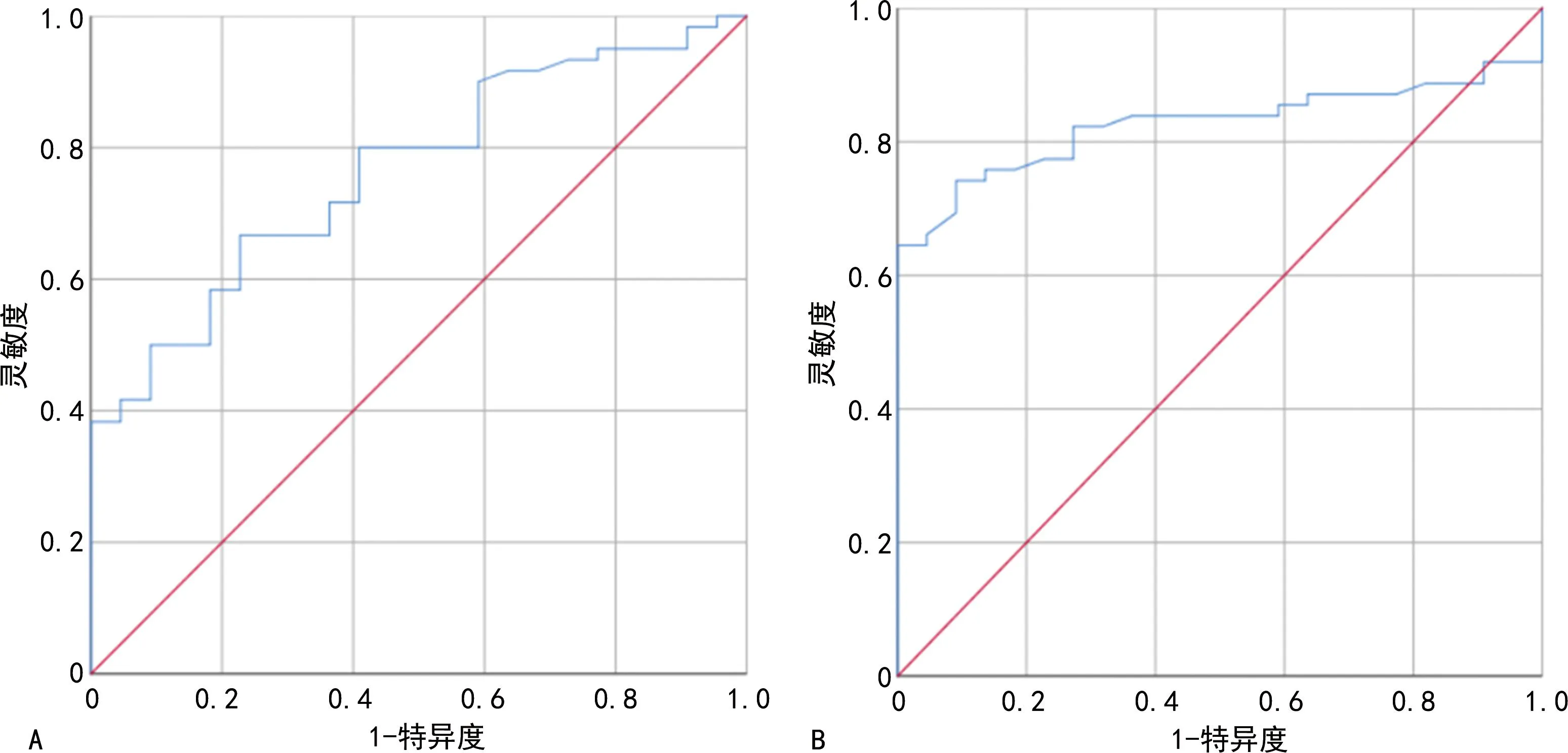
A:CEA;B:SPINK4。

A:SPINK4低表达;B:SPINK4高表达;C:CEA高表达;D:CEA低表达。
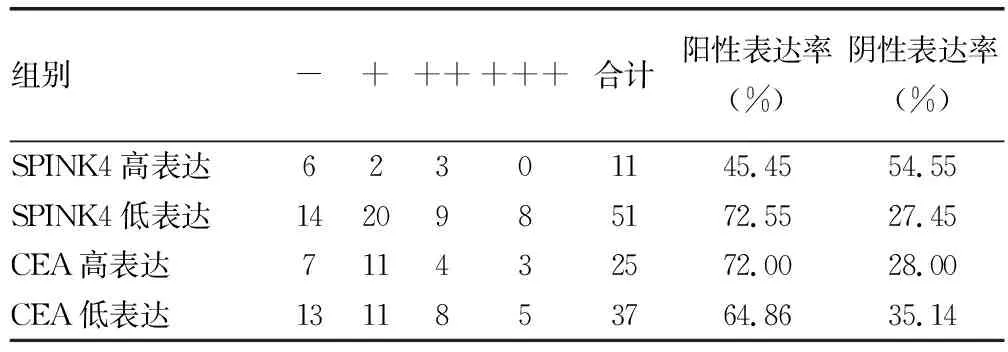
表5 突变型p53在CRC组织中的表达情况
3 讨 论
2020年CRC成为全球第三大常见恶性肿瘤,同时也是恶性肿瘤死亡的第二大原因[11]。50~74岁的中老年人群成为全球CRC新发病例主要人群[12-14],且>50岁人群在全球早发性CRC中的发病率仍呈上升趋势[15-17]。大部分CRC患者在早期无明显临床症状,确诊时已经出现了淋巴结或远处转移[18],而发生远处转移的CRC患者5年生存率仅为12%,如何在早期对CRC患者有效地进行筛查是目前亟待解决的问题。大多数CRC是由腺瘤经过一段漫长的时间发展而来,一般需要10~20年。有研究表明,非AA发展成CRC 的年转化率约为1.2%,而AA发展为CRC的年转化率是前者的2~3倍[19]。AA是指满足以下1项及以上标准的腺瘤:直径>10 mm,含有绒毛成分,有重度异型增生或高级别上皮内瘤变[20]。因此及时发现并切除AA是降低CRC发病率的有效措施。目前结肠镜是诊断CRC和AA 的“金”标准,因为其不但可发现病变,还能在镜下直接活检完善病理学检查。但是由于我国人口基数大,结肠镜设备及内镜医师的数量有限,很难对50岁以上及有结直肠癌家族史的40岁以上人群做大规模筛查。因此找到一种能筛出最需要接受结肠镜检查的高危患者的方法极为重要。
近年的研究发现,SPINK4与CRC的发生、发展有关。WANG等[21]研究发现结直肠癌肿瘤标本中SPINK4表达降低,并与较差的生存率相关,这与本课题组前期的研究结果相同。本研究显示,CRC组及AA组血浆SPINK4表达明显低于HC组,CRC患者SPINK4表达与淋巴结转移呈负相关,说明其在CRC中具有抑癌作用,并且抑制癌细胞的转移,SPINK4表达降低可能与CRC患者的不良预后及较差的治疗效果有关。SPINK4联合CEA诊断CRC及AA的AUC、准确度均高于SPINK4、CEA单独诊断,表明二者联合诊断具有较高的临床价值。既往研究发现,肿瘤标记物CEA、CA199、CA242、CA724对CRC诊断的特异度和灵敏度分别为66.39%、48.29%,62.18%、35.01%,66.37%、39.98%,59.41%、25.06%[22]。本研究结果表明,血浆SPINK4联合CEA诊断CRC的灵敏度和特异度分别为90%、68%,均优于以往的肿瘤标记物。p53 是正常细胞增殖的重要调控因子,野生型p53基因是一种抑癌基因,能够修复损伤的DNA,促进癌细胞凋亡[23];但突变型p53基因是一种癌基因,抑制细胞凋亡,促进癌细胞增殖[24]。本研究免疫组织化学检测结果显示,CRC患者SPINK4低表达组及CEA高表达组突变型p53阳性表达率明显增加(P<0.05)。SUPPIAH等[25]证明突变型p53 预示着恶性程度较高的CRC,并且伴随着较差的预后,这进一步说明低表达SPINK4和高表达CEA及突变型p53均促进了CRC的发生。
本研究虽然表明血浆SPINK4表达在CRC和AA中具有一定的临床诊断价值,但仍有一定的局限性。(1)样本量较小,结果的可靠性仍需进一步验证;(2)未分析SPINK4表达与生活习惯、方式的关系,有研究表明吸烟[26]、过量饮酒[27]、超重或肥胖[28]、肠道菌群失调[29]、大量食用红肉和加工肉类[30]都可能影响CRC的发生,在后续的研究中作者也会加入相关因素进行探讨;(3)由于CRC组患者尚未达到生存访问时间,从而无法得知预后情况。在后续研究中,将进一步扩大样本量,分析SPINK4如何影响结直肠细胞的增殖、侵袭和迁移,寻找靶点,以期更加准确地对CRC及AA患者进行靶向治疗。



