刘 菲,钟 黄,魏 尉,黄 忠
(自贡市第一人民医院消化科,四川自贡 643000)
代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD) 是一类代谢功能障碍所致的肝脏疾病,目前是全球最常见的慢性肝病,已成为肝硬化及肝癌发生的主要病因。研究表明,MAFLD与冠心病、结肠癌、乳腺癌、慢性肾脏病、糖尿病、高脂血症和代谢综合征等的发生密切相关[1-2],与MAFLD相关的肝硬化及肝细胞癌(hepatocellular carcinoma,HCC)患病率也在迅速上升[3],极大危害人类健康。
MAFLD相关肝硬化会导致严重的并发症,包括消化道出血、腹水、门静脉血栓(portal vein thrombosis,PVT)、感染、HCC等,严重影响患者预后[4-5]。PVT是指门静脉主干和(或)主干分支内血栓形成,可延伸至脾、肠系膜上静脉,从局部无症状的血管阻塞到门静脉血流完全阻断。急性血栓形成可导致门静脉压力骤增,并发静脉曲张破裂出血、急性肠缺血坏死;慢性PVT可逐渐导致门静脉闭塞或门静脉海绵样变性,进一步增加门静脉压力,影响预后[6]。有研究发现,MAFLD相关肝硬化发生PVT的风险较其余病因的肝硬化明显增加,MAFLD是肝硬化PVT形成的独立危险因素[7]。这可能与MAFLD的发病机制有关,MAFLD的特征性表现为代谢异常,体内脂肪组织巨噬细胞产生众多促炎细胞因子,导致肝细胞氧化应激损伤、肝细胞凋亡,从而使肝脏内存在持续慢性炎症,同时胰岛素抵抗、血小板功能的增加及多种凝血因子的异常活化导致体内呈高凝状态[8-10]。此外,多项研究证实MAFLD与心脑血管疾病密切相关[7],这与内皮功能障碍存在一定关系,而这有可能也会加重门静脉血管内皮损伤。研究MAFLD相关肝硬化PVT形成的临床特征及危险因素,有利于早期对于MAFLD进行干预及管理,减少并发症的发生,改善生存率。但目前国内外鲜有对MAFLD相关肝硬化发生PVT的相关危险因素的报道[11-12]。本研究探讨MAFLD相关肝硬化PVT形成的临床特征及危险因素,对临床诊疗评估、早期治疗PVT及高危患者的随访管理有重要的临床意义。
1 资料与方法
1.1 一般资料
选取2016年6月至2023年6月本院收治的120例MAFLD相关肝硬化患者为研究对象。纳入标准:(1)饮酒折合乙醇量男性<30 g/d,女性<20 g/d;(2)年龄>18岁;(3)肝硬化患者均经腹部超声、CT或MRI诊断,PVT或非PVT患者均经腹部超声、CT或MRI、门静脉血管造影诊断。排除标准:(1)病毒性肝炎、自身免疫性肝病、肝豆状核变性、药物(糖皮质激素、甲氨蝶呤等)、炎症性肠病、酒精性肝病、全胃肠外营养、乳糜泻、库欣综合征等导致的肝硬化;(2)目前活跃或疑似HCC,既往肝脏手术或肝移植,以及妊娠;(3)临床资料不齐全;(4)有服用抗凝药物、抗血小板及止血药物史;(5)血液系统疾病;(6)恶性肿瘤。将患者分为PVT组(n=33)和非PVT组(n=87)。本研究经医院伦理委员会审核(伦理[研]2020年第16号),患者及家属签署知情同意书。
1.2 方法
收集患者临床资料。(1)人口学资料:性别、年龄、吸烟及饮酒史等;(2)既往史、合并症、并发症:糖尿病、高血压、冠心病、脾切除史等;(3)实验室指标:生化指标[血清ALT、AST、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰胺转肽酶(γ-glutamyl transpeptidase,GGT)、总胆红素(total bilirubin,TBil)、白蛋白(albumin,ALB)、胆汁酸(total bile acids,TBA)、尿酸(uric acid,UA)]、血脂指标[总胆固醇(serum total cholesterol,TC)和甘油三酯(triglyceride,TG)]、血常规指标[WBC、血红蛋白(hemoglobin,Hb)、PLT]、血凝常规指标[凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)]、纤维蛋白原(fibrinogen,Fib),计算Child-Pugh评分[13];(4)影像学指标:门静脉主干内径宽度。
1.3 统计学处理
2 结 果
2.1 基本情况
两组年龄,性别、吸烟史、饮酒史,合并高血压、糖尿病,并发腹水、肝性脑病、自发性腹膜炎,内镜下治疗史、Child-Pugh 分级比例比较差异均无统计学意义(P>0.05);而合并冠心病、有脾切除史,并发食管胃底静脉曲张、消化道出血及脾功能亢进比例比较差异有统计学意义(P<0.05),见表1。
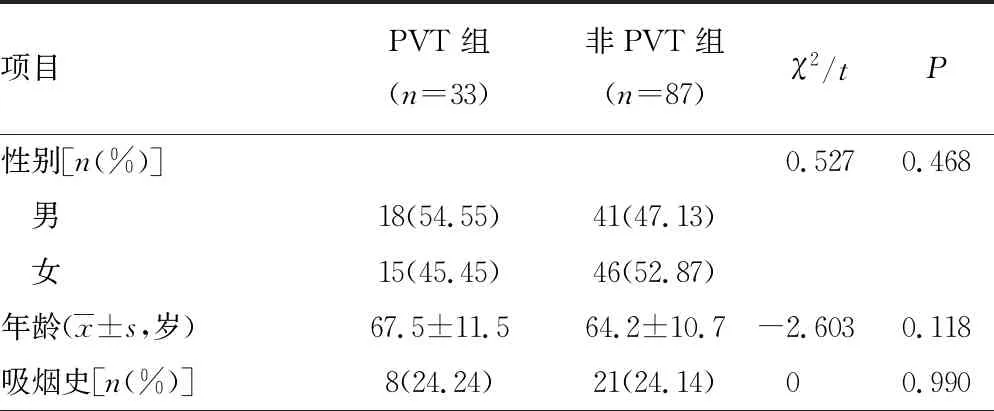
表1 两组一般资料比较
2.2 血清学及影像学结果比较
PVT组ALT、AST、GGT、TBil、ALB、PT、APTT低于非PVT组(P<0.01),ALP、TBA、UA、TG、WBC、PLT、门静脉主干内径宽度高于非PVT组(P<0.01),但TC、Hb、TT、Fib比较差异无统计学意义(P>0.05),见表2。
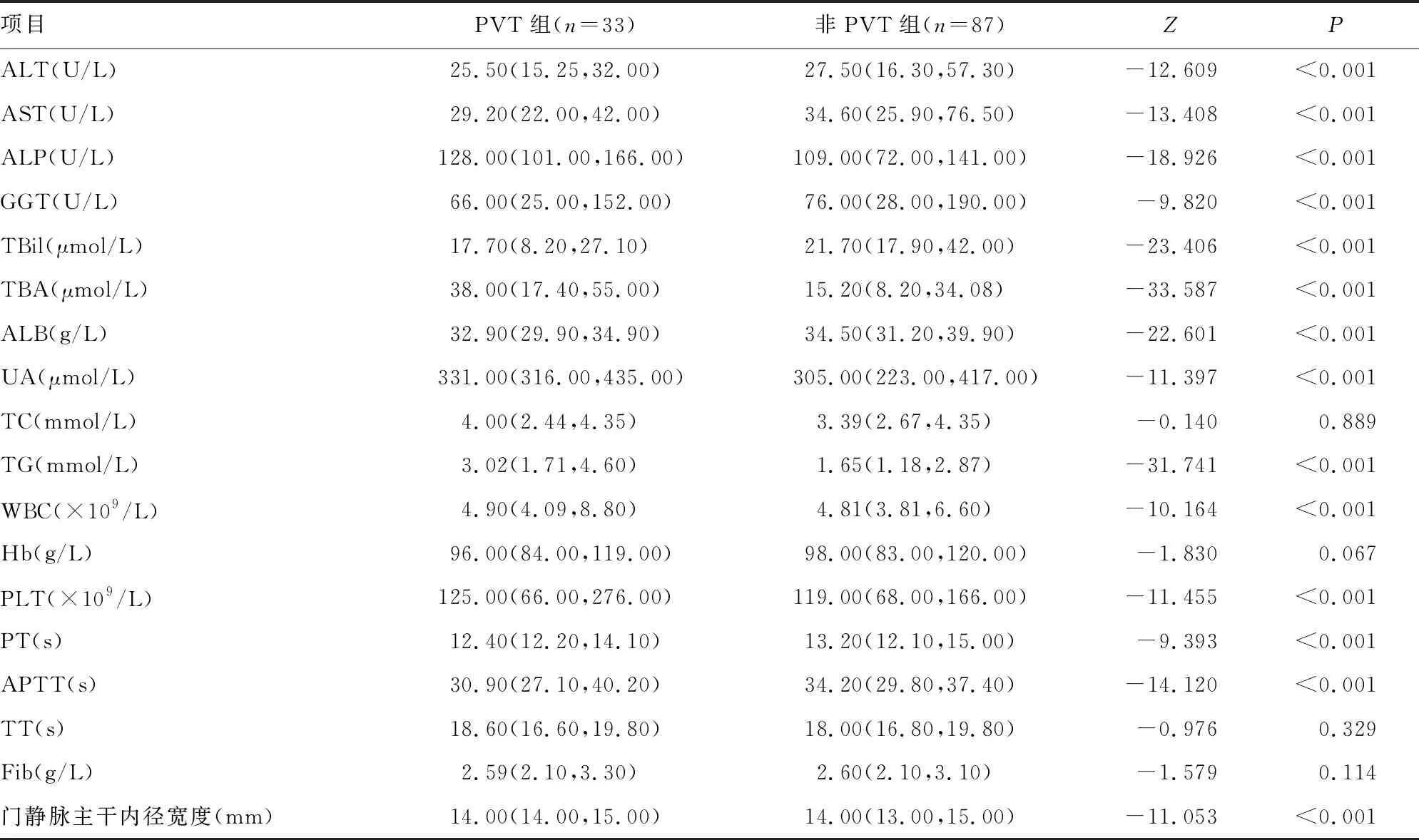
表2 两组血清学及影像学结果比较[M(Q1,Q3)]
2.3 MAFLD相关肝硬化PVT形成的相关危险因素分析
进一步将ALT、AST、ALP、GGT、TBil、TBA、ALB、UA、TG、WBC、PLT、PT、APTT、门静脉主干内径宽度、脾切除史,是否并发脾功能亢进、食管胃底静脉曲张、消化道出血带入多因素logistic回归分析,结果显示高水平的TG,并发脾功能亢进和食管胃底静脉曲张,有脾切除史是MAFLD相关肝硬化PVT形成的独立危险因素(P<0.05),见表3。

表3 多因素logistic 回归分析
3 讨 论
PVT形成是肝硬化患者常见的严重并发症之一,与门静脉压力及肝功能损害严重程度相关,且影响肝硬化患者预后[6]。血流缓慢、局部血管损伤、高凝状态是静脉血栓形成的三要素。门静脉高压伴血流速度减低是肝硬化PVT形成的关键因素[14],而食管胃底静脉曲张、脾功能亢进是门静脉高压的重要临床表现。本研究发现,PVT组并发食管胃底静脉曲张及脾功能亢进比例远高于对照(OR=2.704、1.717,P<0.001),可见门静脉高压在MAFLD相关肝硬化PVT的形成中发挥重要作用。
脾切除史能缓解脾功能亢进所致的外周血一系或多系的减少,一定程度上降低门静脉压力,但同时也会增加PVT形成的风险[15]。本研究显示,予以脾切除术后MAFLD相关肝硬化发生PVT是对照的5.257倍(P<0.05)。这可能是因为MAFLD体内纤溶酶原激活物抑制物1和第Ⅷ因子的促凝水平是升高的[14],说明脂质代谢紊乱导致的慢性炎症的持续存在、胰岛素抵抗、凝血功能障碍使MAFLD体内处于高凝状态[16]。而脾切除局部血管损伤及脾切除后PLT增加,促使MAFLD相关肝硬化的PVT形成率急剧升高。脾功能亢进后PLT减少,这似乎是PVT形成的保护性因素。但同时脾脏也是一个巨大的免疫器官,有研究发现脾功能亢进后巨噬细胞的吞噬功能及淋巴细胞的增殖功能增强,这可能加重体内的炎症反应,同时脾功能亢进所致WBC减少,免疫力低下,易继发各种感染,促进体内血栓形成,但具体作用机制需进一步研究证实。因此,对于代谢相关肝硬化患者脾功能亢进问题,在关注PLT减少增加出血风险的同时,也需警惕PVT的形成,同时对于脾切除的评估应更为谨慎。
在门静脉高压所致血流减慢的基础上,MAFLD体内的高凝状态进一步加重PVT的形成。高TG被认为是代谢综合征中的首要因素,在MAFLD进程中也发挥着重要作用[17]。本研究显示,高水平的TG是MAFLD相关肝硬化PVT形成的独立危险因素(OR=1.547)。过高的TG会通过上调内皮细胞中的促炎基因、增加白细胞活化标志物的表达等引起体内急慢性炎症;而高TG增加血液黏稠度,使血流变缓,促进PVT形成。同时,MAFLD的高凝状态使肝内易形成微血栓,而肝内微血栓的形成会促进肝纤维化的进展,增加门静脉压力,减少血管内血流速度[17],进一步加重PVT的形成。因此,对于MAFLD需动态监测血清TG水平,及时调整生活方式及予以药物干预,避免PVT的形成,减缓肝硬化进展。
综上所述,MAFLD相关肝硬化患者的高TG,并发食管胃底静脉曲张、脾功能亢进,有脾切除史是PVT形成的独立危险因素。因此,对于MAFLD相关肝硬化,应密切随访TG,及时予以干预,同时对于食管胃底静脉曲张及脾功能亢进的患者,应关注其门静脉情况。



