罗 洁,戚 月,李 晶,敖广宇,陈亭宇,陈 民
(成都市中西医结合医院肾脏内科,成都 610041)
免疫球蛋白A(IgA)肾病是世界范围内最常见的原发性肾小球肾炎,最早于1968年被提出,临床表现为肾功能逐渐下降,肾病理活检显示为系膜IgA沉积,这是导致此病高发病率与高致死率的重要原因[1]。在世界范围内,IgA肾病发病率因不同民族/种族群体的变化导致差异很大,东亚地区的发病率最高,我国IgA肾病患者约占原发性肾小球疾病的45.3%,日本为40.0%,其他亚洲国家为40.0%~50.0%,美国为12.0%,欧洲为25.0%,非洲为5.0%[2-3]。性别之间的分布因地区而异,北美和欧洲地区的男女比例约为2∶1,但东亚地区约为1∶1[4]。除了性别,蛋白尿也是IgA肾病的特征之一,肾小球滤过率的下降速率会随蛋白尿量而变化,IgA肾病具有广泛的临床表现和病程,这导致患者间临床严重程度出现不同表现,不利于开展治疗[5]。因此有必要寻找与IgA肾病发展有关的因素。
自噬是一种进化上保守的自我消化系统,双膜液泡选择性或非选择性地吞噬细胞质物质,并与溶酶体融合,降解所含物质[6]。这是一个高度动态的自降解过程,能促进溶酶体依赖的酶消化细胞质成分[7]。转录因子EB(transcription factor EB,TFEB)是多种哺乳动物细胞自噬信号的主控制器,能调节自噬相关基因(autophagy-related gene,ATG)和Beclin1、微管相关蛋白1轻链3(MAP1LC3B,简称LC3)、p62等自噬通路上的关键蛋白,在自噬体、自噬溶酶体形成,以及加快自噬底物降解等方面有促进作用[8-9]。尽管有证据表明自噬发生在肾间质纤维化过程中[10],但自噬活化在IgA肾病中的作用及自噬如何影响IgA肾病进程仍处于研究空白。因此,本研究探讨IgA肾病患者中TFEB自噬通路与IgA肾病疾病分型的相关性,阐明其可能存在的调控关系,为开发以TFEB自噬通路为靶点的药物与治疗手段提供实验基础。
1 资料与方法
1.1 一般资料
选取2021年12月至2022年12月本院诊断并收治的IgA肾病患者24例。纳入标准:(1)年龄18~60岁;(2)住院经肾脏病理活检证实为IgA肾病;(3)首次行肾穿刺活检患者;(4)肾组织病理切片肾小球数量>5个。排除标准:(1)过敏性紫癜肾炎、狼疮性肾炎、乙型肝炎病毒相关性肾炎、类风湿性关节炎肾损伤等继发性肾脏病患者;(2)有高血压、糖尿病、自身免疫性疾病、肾功能不全、肾小球源性血尿及蛋白尿等病史;(3)拒绝执行肾穿刺者。本研究通过医院伦理委员会批准(审批号:2023年KT第18号),所有患者均签署相关知情同意书。以Katafuchi积分标准[11]作为IgA肾病患者分级标准,0级为无明显病变,Ⅰ级为病变面积<30%,Ⅱ级为病变面积30%~70%,Ⅲ级为病变面积>70%。纳入研究的24例患者,Katafuchi 0~Ⅲ级每个分级各6例。
1.2 方法
1.2.1一般资料与实验室资料收集
记录患者年龄与性别,在空腹状态下采集静脉血5 mL,收集24 h尿液,冷藏待测。采用全自动活检肾穿针(美国巴德公司),16G或18G一次性活检针在B超定位引导下行经皮肾穿刺活检术,麻醉方式为局部麻醉,取材部位统一为肾下极,每例患者收集2份肾活检组织供后续检测。
1.2.2指标检测
生化分析仪(深圳迈瑞生物医疗电子股份有限公司)检测患者外周血中血肌酐(Scr)、尿素(UREA)和24 h尿蛋白水平。免疫组织化学染色法检测肾穿组织中TFEB、LC3B、p62和肾病蛋白(nephrin)表达水平,肾穿组织病理切片经脱蜡至水、抗原修复、阻断内源性过氧化物酶、血清封闭、一抗孵育、二抗孵育、DAB显色、细胞核复染、脱水固封后,显微镜下观察并使用图像分析系统计算每张图像阳性面积占比(%DAB)。抗体信息:TFEB(英国Abcam公司,1∶100)、nephrin(江苏亲科生物研究中心有限公司,1∶100)、LC3B(武汉三鹰生物技术有限公司,1∶100)、p62(武汉爱博泰克生物科技有限公司,1∶100)、兔二抗(武汉赛维尔生物科技有限公司,1∶100)。采用苏木精-伊红(HE)对肾穿组织病理切片进行染色,显微镜下观察肾脏及肾小球病变情况。
1.3 统计学处理
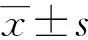
2 结 果
2.1 各分级IgA患者一般资料
各分级IgA患者年龄与性别差异无统计学意义(P>0.05),见表1。
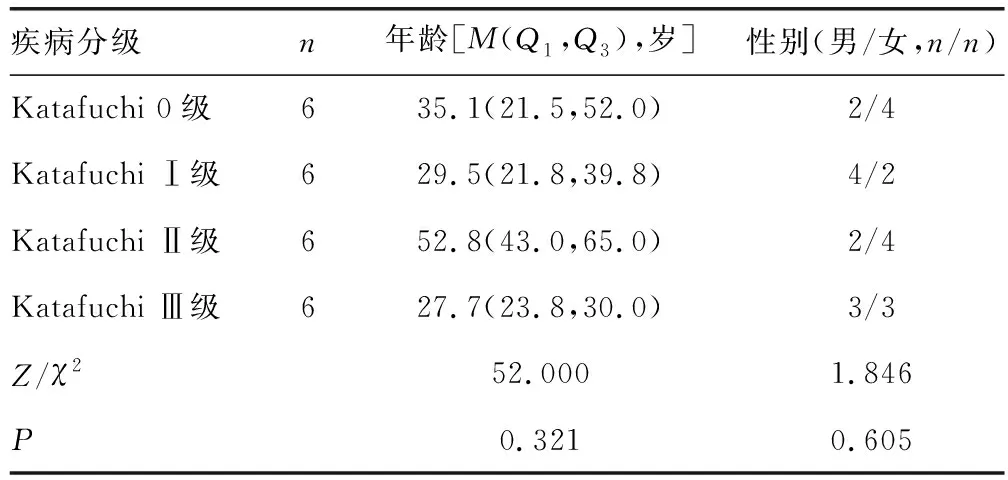
表1 各组患者年龄与性别分布情况
2.2 各分级IgA肾病患者肾功能指标检测结果
各分级患者24 h尿蛋白与血清中尿素水平比较,差异无统计学意义(P>0.05);Scr水平随IgA肾病分级增大而升高(P<0.05),见表2。
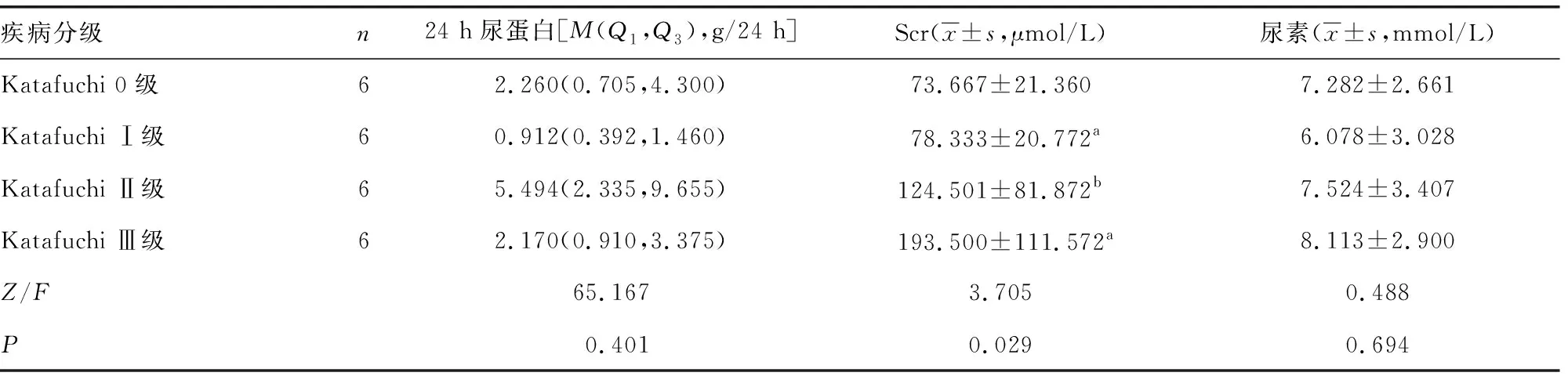
表2 各组患者肾功能指标检测情况
2.3 各分级IgA肾病患者肾穿组织病理学结果
结果显示,Katafuchi 0级患者肾脏组织被膜较为完整,皮质与髓质分界较为清晰,皮质区肾小体结构完整清晰,肾小囊腔清晰可见,血管球未见毛细血管基底膜或系膜增生,无变性、坏死及纤维化;肾小管结构较为完整,上皮细胞未见明显变性坏死,近曲小管刷状缘丰富,管腔内无细胞管型或蛋白管型。Katafuchi Ⅰ级患者肾脏组织结构较为正常,肾小球局部轻度或轻微系膜增宽,部分区域系膜细胞增生,肾小管结构较为正常,偶见少量纤维组织增生。Katafuchi Ⅱ级患者肾脏组织结构被破坏,肾小球系膜弥漫性增厚、增宽,系膜细胞增多明显,偶见硬化,周围局部肾小管轻度萎缩半纤维组织增生及少量炎症细胞浸润。Katafuchi Ⅲ级患者肾脏组织肾小球结构被破坏,弥漫性系膜增殖和增宽、小球硬化明显,偶见新月体、球囊粘连,肾小管萎缩明显,间质可见大量纤维组织增生及炎症细胞浸润,以淋巴细胞为主,见图1。
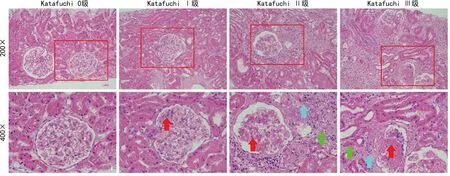
红色箭头:肾小球系膜增厚;绿色箭头:肾小管萎缩;蓝色箭头:组织纤维增生。
2.4 各分级IgA肾病患者TEFB、nephrin、LC3B和p62蛋白表达水平比较
免疫组织化学检测结果显示,与Katafuchi 0级患者比较,Katafuchi Ⅰ级患者LC3B蛋白表达水平升高,nephrin蛋白表达水平降低,Katafuchi Ⅱ、Ⅲ级患者TEFB与LC3B蛋白表达水平升高,nephrin和p62蛋白表达水平降低(P<0.05),见表3、图2。
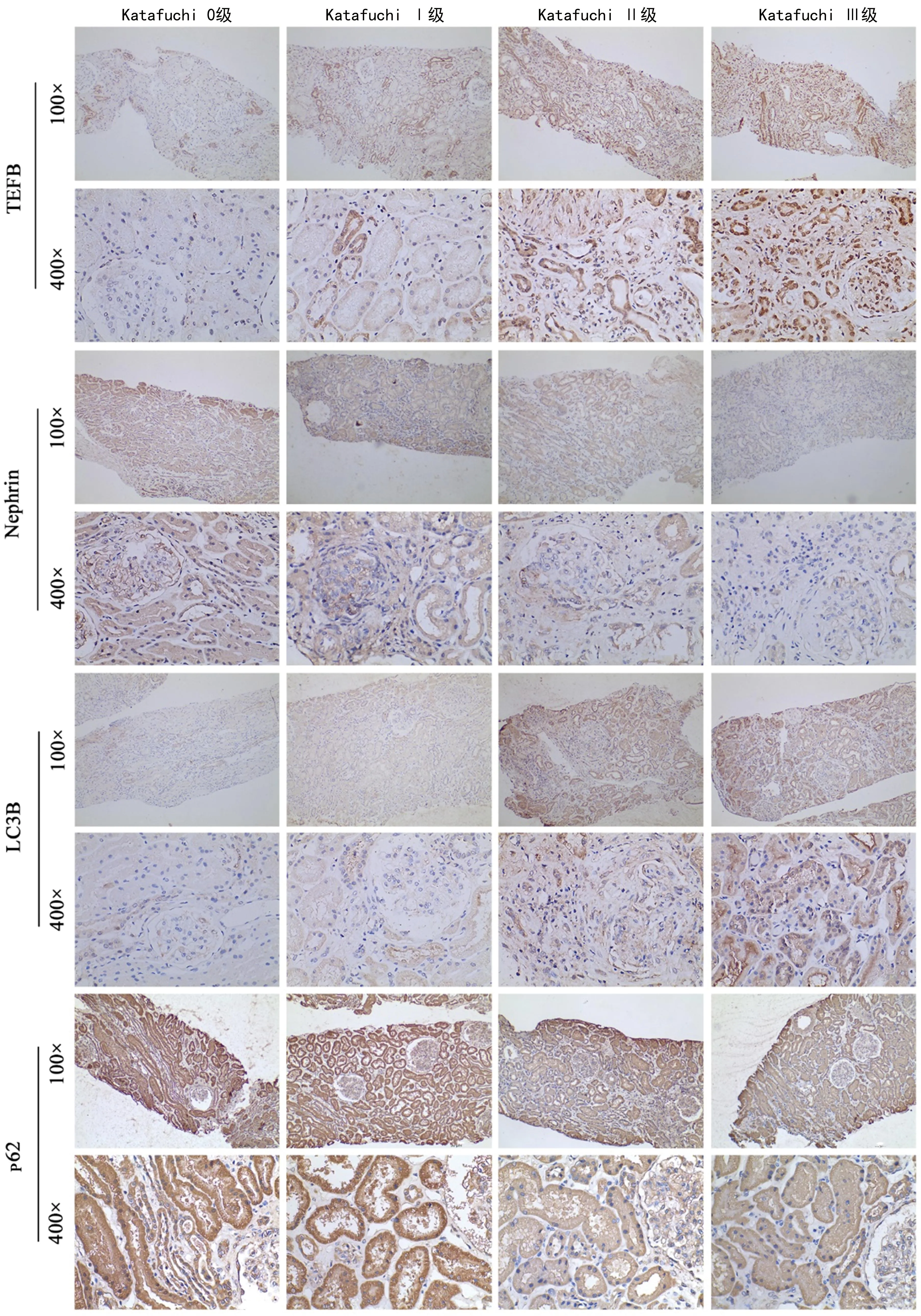
图2 各分级IgA肾病患者TEFB、nephrin、LC3B和p62蛋白表达情况(DAB染色)
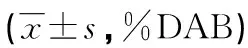
表3 各分级IgA肾病患者TEFB、nephrin、LC3B蛋白和p62表达水平比较
2.5 影响IgA肾病分级的因素分析结果
IgA肾病分级与患者性别、年龄、24 h尿蛋白、尿素无相关性(P>0.05);与患者Scr和TEFB、LC3B蛋白表达水平呈正相关(P<0.05),与p62和nephrin蛋白表达水平呈负相关(P<0.05),见表4。
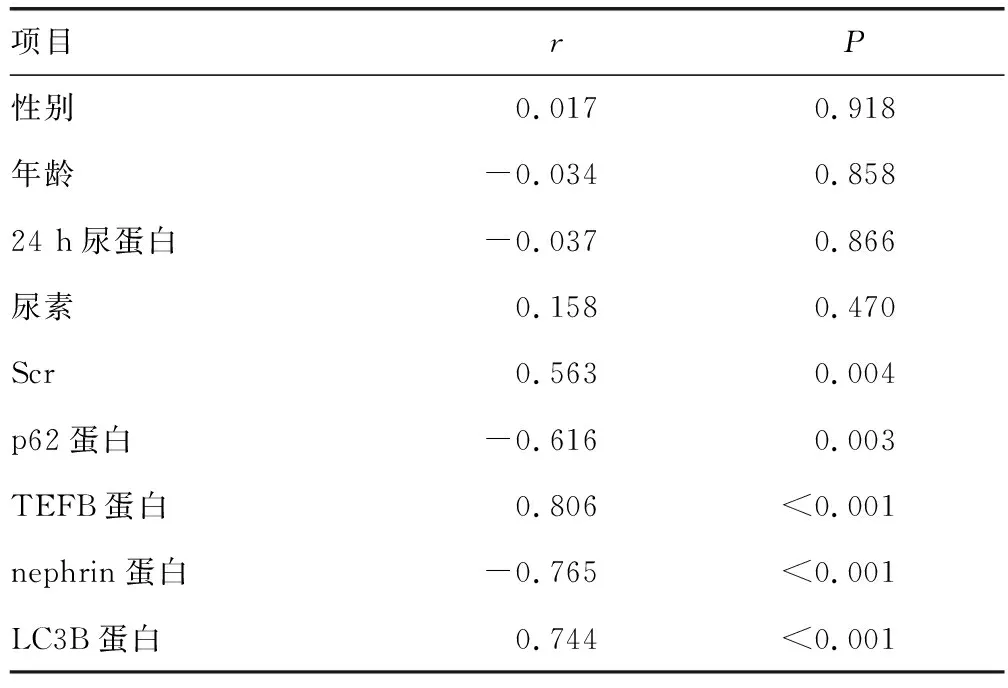
表4 IgA肾病分级与患者各指标的相关性分析
2.6 IgA肾病分级单因素回归分析
以IgA肾病分级为因变量,在相关性分析中差异有统计学意义的指标为自变量,进行单因素回归分析。结果显示:Scr和p62、TEFB、nephrin和LC3B蛋白为IgA肾病分级的影响因素(P<0.05),见表5。
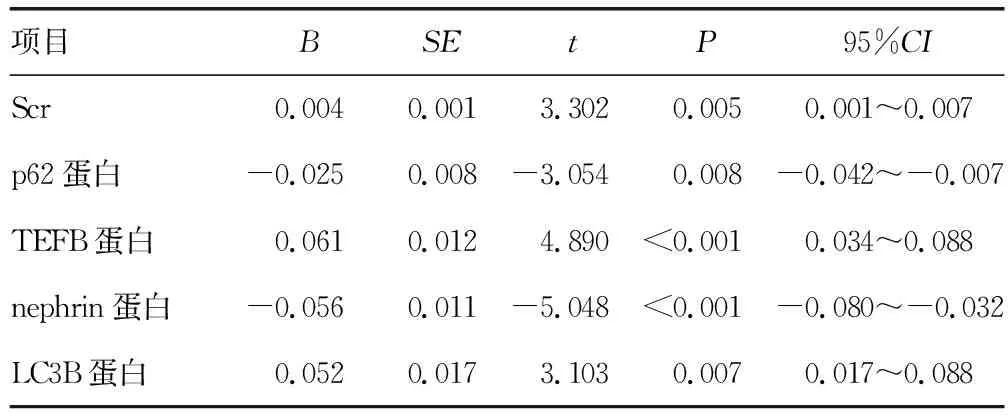
表5 IgA肾病分级单因素回归分析
3 讨 论
尿液蛋白质分析是一种比活检更安全的选择。尿液中蛋白质的主要来源是肾脏,尿液中的蛋白质生物标志物水平高于血液,尿液样本在20 ℃下较为稳定,即使存储多年也可以用于蛋白质分析[12]。目前临床已发表了约40种尿蛋白标志物,其中20种能特异性标记IgA肾病;在低蛋白尿和肾功能稳定的IgA肾病中,30种尿蛋白和4种潜在标志物水平会发生改变[13]。一项大规模多中心研究结果显示,尿中的胶原蛋白碎片数量减少可能对进展性IgA肾病最有意义,因为肾脏纤维化中胶原蛋白降解和胶原酶抑制减少[14]。蛋白尿是肾功能丧失最重要预测因子,肾小球滤过率的下降速率随着蛋白尿量的增加而增加[15],表明蛋白尿可能与IgA肾病进展之间存在密切关系。本研究病理结果显示,随着IgA肾病分级的不断提高,患者肾脏组织中肾脏及肾小球增生明显,肾小球结构破坏程度也逐渐增加。IgA肾病患者虽然出现不同程度的蛋白尿,但是尿蛋白高低与IgA肾病分级却没有明显相关性。相关检测发现,只有Scr与IgA肾病分级具有正相关,这可能是因为IgA肾病具有广泛的临床表现和病程,临床严重程度因个体差异而明显不同。不同患者之间蛋白尿与肾功能差别较大,少数病例(约5%)可自发缓解,少数病例肾功能由快速恶化演变成缓慢进行性恶化,也有患者根本没有进展[16]。这提示只根据临床和组织学特征对患者进行详细分层较为困难,初步判断蛋白尿与尿素都可以作为IgA肾病患者的诊断标志,但不适用于疾病发展进程判断,而Scr水平则可作为评价IgA肾病病情进展的辅助标准。
自噬是真核细胞中普遍存在的细胞生物学过程,它消除了受损的细胞器和生物大分子,被证明是维持细胞内稳态重要且高度保守的调节机制[17]。与选择性降解短寿蛋白的泛素-蛋白酶体系统比较,自噬更喜欢老化和功能失调的细胞质蛋白[18]。IgA肾病患者的自噬现象最早是通过电子显微镜观察足细胞发现,SATO等[19]发现支持细胞的自噬类型与IgA肾病的预后密切相关,以Ⅰ型自噬为主的IgA肾病患者肾损伤更严重,复发次数更多,进展更快,预后更差[20-21]。TFEB是溶酶体生物发生和自噬的主要调节因子,在正常生理条件下,TFEB被哺乳动物雷帕霉素C1靶蛋白(mTORC1)磷酸化,导致其被保留在细胞质中[22]。在饥饿或其他应激条件下,mTORC1从溶酶体中被释放出来,导致TFEB去磷酸化,快速易位至细胞核,与自噬相关基因的启动子区结合,诱导自噬体的生物发生、自噬体与自噬体融合[23]。在自噬溶酶体过程中,过表达TFEB可增加自噬小体的形成,而缺乏LC3/Atg8同源物会导致TFEB活化受阻[24],说明TFEB与LC3两者可能与IgA肾病发展进程具有直接关系。本研究结果显示,与Katafuchi 0级患者比较,Katafuchi Ⅰ级患者LC3B蛋白表达水平升高,nephrin蛋白表达水平降低,Katafuchi Ⅱ、Ⅲ级患者TEFB与LC3B蛋白表达水平升高,nephrin和p62蛋白表达水平降低,IgA肾病分级与患者Scr和TEFB、LC3B蛋白表达水平呈正相关,与p62和nephrin蛋白表达水平呈负相关。其中,nephrin是一种重要的足细胞特异性蛋白,参与调节肌动蛋白动力学和细胞存活的信号通路[25]。有研究发现,在IgA肾病大鼠中,nephrin的表达先增加后减少,提示这是一种代偿性改变[26],结合本研究结果,说明IgA肾病患者中肾脏及肾小球损伤有可能是TFEB通路介导自噬造成的,高水平自噬及nephrin减少均有可能是促进IgA肾病进程的关键因素。单因素回归分析结果显示,TFEB、nephrin、LC3B和p62蛋白水平均是IgA肾病疾病进程的影响因素,与赵明明[27]研究结果一致,说明基于TFEB、LC3B和p62等自噬通路关键靶点可以对IgA肾病进行预测与治疗,nephrin表达与自噬具有一定的相关性,可用于日后相关药物的研究与开发,但其中涉及的机制还需要进一步深入研究。
综上所述,IgA肾病患者发病进程与Scr、TFEB、LC3B、p62和nephrin等指标高度相关,提示Scr高水平,TFEB、LC3B高表达及nephrin、p62低表达均是IgA肾病患者病情恶化的潜在标志。



