安徽省霍邱县第一中学 王俊祺
FeSO4晶体纯度的测定
安徽省霍邱县第一中学 王俊祺
利用酸性KMnO4滴定亚铁盐,进而测定亚铁盐纯度的传统滴定实验,对操作技能要求很高,容易因操作不当及读数不准确产生误差,而且根据颜色变化判断终点容易受到主观因素的影响。并不适合进行一些没有明显颜色变化或找不到合适指示剂的化学反应。本实验利用氧化还原电势传感器和滴数传感器对实验进行改进,极大地提高了实验的准确性,且降低了实验的操作难度。
氧化还原滴定 氧化还原电势传感器 滴数传感器
氧化还原反应滴定是中学化学几个重要的实验之一,在高考试题中也经常涉及氧化还原滴定的计算问题。然而对于常规的滴定实验,滴定之前需要验漏、排气泡,看似简单的操作实际上做起来并不那幺简单。而且滴定时要求先快后慢,边滴边振荡,利用终点颜色突变判定终点,读数时需要估读到小数点后两位,这对实验技能要求很高,还容易产生误差。本实验利用氧化还原电势传感器的电势突变判定终点,以及使用滴数传感器来确定溶液的体积,能够极大地提高实验的准确性以及降低实验的操作难度。
一、实验原理
酸性KMnO4滴定Fe2+发生反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++ 4H2O。随着滴定的进行,还原性离子浓度降低,氧化性离子浓度增大,溶液中离子电势会慢慢升高。当Fe2+被完全氧化之后,再滴入强氧化性的酸性KMnO4,离子的电势会瞬间突变(增大),此时意味着反应终点已经到达。可以在图像中找到滴定终点所消耗的酸性KMnO4的准确体积,代入公式:5c(KMnO4)·V(KMnO4)·10-3·M(FeSO4)/m(样品)×100%便可计算出FeSO4晶体的纯度。
二、实验仪器和药品
实验药品:0.05mol/L酸性KMnO4、FeSO4晶体、蒸馏水
实验仪器:烧杯、铁架台、150mL烧杯、磁力搅拌器、滴数传感器、氧化还原电势传感器、数据采集器
实验装置图:

三、实验步骤
1.准确配制0.05mol/L的酸性KMnO4溶液;
2.称取0.5g FeSO4晶体,加入约50mL水溶解于烧杯中;
3.安装好磁力搅拌器,接通电源。将烧杯放在磁力搅拌器上,并放入磁籽;
4.将滴数传感器固定在磁力搅拌器上,取出氧化还原电势传感器,用蒸馏水冲洗之后固定在滴数传感器上,保证底部的玻璃珠完全浸没在溶液中且与磁籽有一定的距离;
5.在滴数传感器的上方安装金属夹,将装有约20ml酸性KMnO4溶液的塑料试剂库用夹子固定好。保证其尖嘴处正置于滴数传感器上方;
6.打开磁力搅拌器,点击数据采集,然后将塑料试剂库上方的阀门打开(下方的阀门用于控制滴速);
7.观察图像变化,待到电势曲线发生突变时,可关闭上方的阀门,停止滴定,同时停止采集。
四、数据分析
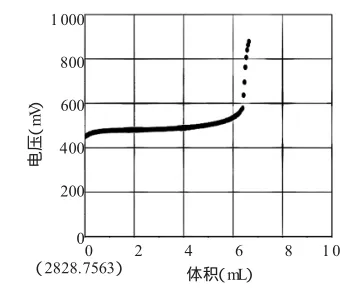
图一
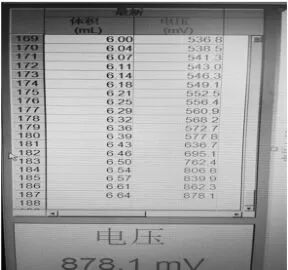
图二
从图二中可以找出,当酸性KMnO4滴入6.39mL时,终点达到。通过计算得出该FeSO4晶体纯度为48.56%(以FeSO4计)
五、数字滴定实验的优势
1.磁力搅拌器匀速搅拌能保证液体充分反应。标准液由滴数传感器匀速滴出,不必先快后慢自动化操作,简单易行。
2.根据电势突变判断反应终点,不必关注终点颜色变化来终止滴定,避免了主观因素造成的误差。因而适用范围更广。
3.从软件中直接找到电势突变点对应的标准液体积,十分准确,不必估读。传感器采集实际滴入待测液的KMnO4体积,不受气泡干扰。
由此可见,利用传感器技术能够有效地提高实验的精确度并降低实验的难度,且绘制出的图像也经常出现在高考的试题中,有条件的学校,应该大力推广传感器的使用。



