胡冠宇,杨 康,王宇峰,丛德毓
(长春中医药大学,长春 130117)
中风病严重危害人类的生存健康,是一类致死率高、致残率高的疾病,由于中风后脑功能区血管神经单元损伤,损伤相应脑功能区会导致多种功能障碍的出现。中风后肢体痉挛(post-stroke spasticity,PSS)是中风后主要功能障碍之一。研究表明,全球范围内中风患者中风后肢体痉挛的发生率为30%~80%[1-4]。中风后肢体痉挛的预后与中风病发病后的及时治疗与康复有着密切关联,头针疗法能改善脑血流及能量代谢,降低兴奋性氨基酸毒性,调节神经生长因子,减轻脑组织炎性反应,减缓神经元凋亡[5]。头针疗法在中风后肢体痉挛及中风后偏瘫的康复应用较为广泛,且头针配合康复训练较单纯的康复训练效果更优[6]。目前头针疗法在多种神经退行性疾病的治疗中得到应用且效果显著。本文利用大脑中动脉闭阻大鼠动物模型,初步探讨环磷腺苷效应元件结合蛋白(CREB)对中风后肢体痉挛大鼠神经细胞恢复的作用机制,及头针对中风后肢体痉挛大鼠的运动功能改善效应。
1 材料与方法
1.1 实验动物 45 只SPF 级8 周龄的雄性Sprague Dawley 大鼠,生产许可证SCXK(吉)-2018-0007,购自长春市亿斯实验动物技术有限公司。大鼠在温度(23±3)℃、湿度(50±5)%、标准光/暗循环12 h的环境下饲养,自由饮水摄食。
1.2 造模方法及模型评价 适应性喂养1 周后,采用数字随机法将45 只大鼠随机分为假手术组15 只和造模组30 只,对造模组大鼠进行线栓法左侧大脑中动脉闭阻模型建立,具体方法如下:1)采用腹腔注射3%浓度的戊巴比妥钠对大鼠进行麻醉,麻醉后对大鼠颈部皮肤备皮、碘伏消毒;2)沿前正中线,在颈部进行切口,并暴露左侧颈总动脉(CCA),分离动脉周围的神经及肌肉;3)找到颈外动脉(ECA),并结扎ECA,同时找到颈内动脉(ICA),在ICA 和CCA 近心端备线,并用动脉夹暂时夹闭CCA 远心端;4)在动脉夹夹闭近心端附近的做CCA 的微小切口,并将制品线栓(型号:MSRC42B250PK50,瑞沃德/RWD,Shenzhen,China)插入切口,打开动脉夹,并继续插入线栓约18 mm;5)结扎ICA 和CCA,缝合肌肉及皮肤切口。术后对大鼠腹腔注射4 万单位的青霉素。假手术组仅仅做1)2)步后进行缝合和青霉素注射。造模后1 d,采用Zealonga 评分和改良Ashworth评分的方法进行模型筛选,评分在1~3 分,改良Ashworth 评分在I 级以上判定为模型成功。
1.3 动物分组及干预方法
1.3.1 动物分组 采用数字随机法,将造模组大鼠随机随机平均分配到模型组和头针组,头针组采用头针干预治疗7 d,模型组不做任何干预仅做同期对照观察;假手术组大鼠不做任何干预仅做同期对照观察。
1.3.2 头针干预方法 在造模后对大鼠进行7 d 的头针干预,每日1 次。具体针刺方法为:采用异氟醚麻醉大鼠,在对应人体的进针区域,对大鼠的顶区和两侧顶前区进行针刺。采用撵转的方法加强针刺刺激,1 分钟/只,并用胶带固定针柄,大鼠清醒后带针自由活动,2 h 后拔针。
1.4 观察及检测方法
1.4.1 行为学检测 造模后8 d,采用改良Ashworth 评分[7-8]和平衡木行走实验[9]对大鼠的肌张力及运动能力进行评估。
1.4.2 组织学检测 造模后8 d,对大鼠脑组织进行取材,采用4%多聚甲醛固定组织,并进行石蜡包埋切片。并对大脑皮质尼氏染色,观察视野内神经细胞核及尼氏小体的变化。
1.4.3 Westernblot 造模后8 d,对大鼠患侧脑皮质组织总蛋白进行BCA 蛋白定量,并进行蛋白变性,经SDS-PAGE 电泳凝胶电泳、转膜、封闭。一抗孵育,4 ℃冰箱过夜。二抗室温孵育 1 h 后,对含有蛋白条带的 PⅤDF 膜进行 ECL 化学发光,并对发光结果进行统计分析。
1.4.4 RT-PCR 造模后8 天,取材患侧脑皮质组织,按Trizol 试剂盒提供的方法提取RNA,采用实时荧光定量PCR法对脑皮质中CREB mRNA表达水平进行测定,GAPDH 作为内参对照,引物序列见表1。
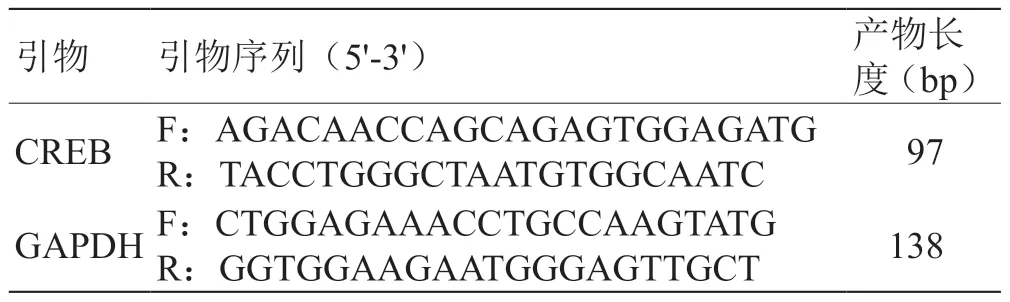
表1 CREB、GAPDH 引物信息
1.5 统计学方法 采用 SPSS 22.0 统计分析数据,用均数 ± 标准差()表示计量资料,多组间比较采用单因素方差分析,不符合正态分布的数据,采用非参数检验秩和检验。
2 结果
2.1 头针对肢体痉挛的治疗效应 头针干预对肢体痉挛的治疗效应采用改良Ashworth 评分和平衡木行走实验进行评价。见表2。结果说明,头针干预能有效改善中风后出现的肢体痉挛状态。
表2 各组大鼠头针干预8 d 行为学指标比较(,n =6)

表2 各组大鼠头针干预8 d 行为学指标比较(,n =6)
注:与假手术组比较,# P <0.05;与模型组比较,△ P <0.05
2.2 头针对大鼠皮质尼氏体结构及数量的影响 各组尼氏染色结果如图1 所示(图1A 为假手术组,图1B为模型组,图1C 为头针组)。假手术组大鼠大脑皮质神经元排列整齐致密,形态规则,且神经元内尼氏体充盈,呈虎斑状或点状;模型组大鼠皮质神经元排列散乱、间隙较大,尼氏体数量较少,染色较浅;头针组大鼠海马区神经元形态有所改善,排列较为整齐,尼氏体数量增多,染色加深。
2.3 头针干预对脑皮质中CREB 的影响 如图2 所示,头针后第8 天,与假手术组相比,模型组大鼠皮质中CREB 蛋白表达显著降低,差异具有统计学意义,模型组大鼠皮质中p-CREB 蛋白表达较之无显著性差异;头针组大鼠皮质中CREB 及p-CREB 蛋白表达明显增加,与模型组相比,差异具有统计学意义。CREB、p-CREB 相对表达量比较及统计分析结果详见表3。
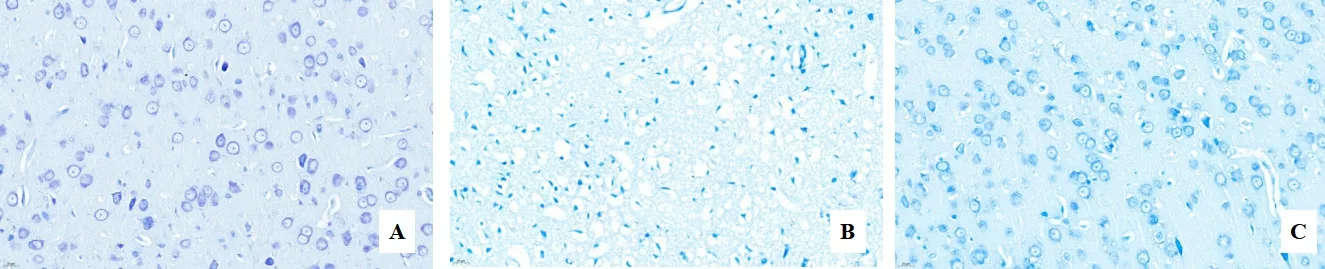
图1 各组大鼠脑皮质组织神经细胞变化(尼氏染色,×400)

图2 各组大鼠脑皮质 CREB、p-CREB 蛋白表达结果
应用PCR 检测各组大鼠CREB 对应mRNA 的表达。如表4 所示,与假手术组相比,模型组大鼠皮质中CREB mRNA 表达显著降低(P<0.05);而头针组大鼠皮质中CREB 蛋白表达明显增加,与模型组相比,差异具有统计学意义(P<0.05)。
表3 各组大鼠皮质中CREB、p-CREB 蛋白相对表达量比较(,n =3)

表3 各组大鼠皮质中CREB、p-CREB 蛋白相对表达量比较(,n =3)
注:与假手术组比较,# P <0.05;与模型组比较,△ P <0.05
表4 各组大鼠CREB mRNA 相对表达比较(,n =6)
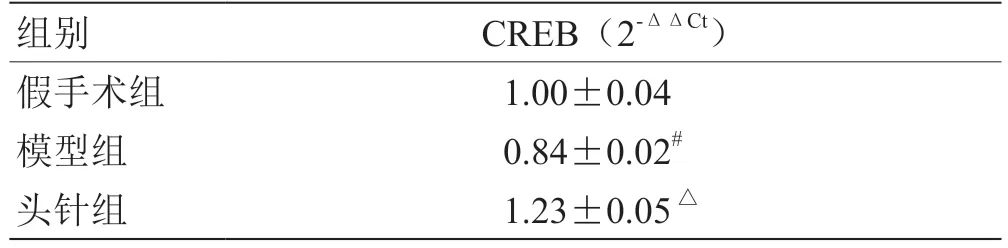
表4 各组大鼠CREB mRNA 相对表达比较(,n =6)
注:与假手术组比较,# P <0.05;与模型组比较,△ P <0.05
3 讨论
中风后肢体痉挛在中医学范畴内归类于“痉病”[10]。中医学研究认为,肢体痉挛的发病主要责之于患者气血瘀滞不通而产生的筋脉失养。采取头针对头部穴位刺激的方式,可调周身的经气运行,根据中医气行则血行的理论,进一步促进了肢体气血津液运行的恢复。中风后肢体痉挛的发生,通常都是其上运动神经元受损,导致患者中枢神经系统出现应激反射神经反应,进而致使患者出现不受意识控制的高肌张力反应。CREB 是真核生物细胞核内的调控因子,是脑源神经营养因子BDNF 的上游信号,能够影响BDNF 的转录与合成,其相关的信号通路是促进中风后脑组织恢复的重要途径[11-13]。大脑中动脉闭阻是目前公认的脑卒中动物模型之一[14-15],能较为精确的还原缺血性脑卒中或大脑的缺血再灌注损伤的病理过程,且模型的可重复性强、损伤程度可控,创口在颈部前正中线且范围较小,适用于头针的动物实验研究。据研究显示,头针在改善中风后运动功能障碍方面主要具有调节神经递质[16]、促进脑功能重塑[17]、改善神经电生理[18]、改善脑部侧支循环[19]及促进神经修复[20]等多方面的效应。本研究通过动物行为学实验发现,头针能够明显改善中风后肢体痉挛大鼠的肢体痉挛程度和运动能力。结合组织学和蛋白检测的结果,本研究发现,头针能够明显增加大鼠皮质内CREB、p-CREB 蛋白及mRNA 的表达,并发挥了促进神经细胞恢复的作用,这可能与CREB 相关通路的激活有关。
综上所述,头针可有效调节CREB 的表达,并对脑皮质中神经细胞的恢复具有促进作用,从而起到了对中风后肢体痉挛的治疗效应。



