祝永福 夏黎明 郑圣齐
(安徽中医药大学第一附属医院肿瘤科,合肥230031)
复方守宫散抗人胃癌裸鼠移植瘤血管生成的实验研究※
祝永福 夏黎明 郑圣齐
(安徽中医药大学第一附属医院肿瘤科,合肥230031)
目的 通过研究复方守宫散对VEGF、bFGF的影响,探讨其抑制血管生成的机理。方法裸鼠皮下接种人胃癌MKN-45细胞悬液,待肿瘤直径长至0.5cm左右,随机分组,分别给予生理盐水、5-FU、1、2、4mg/kg/d复方守宫散进行干预,共6周。治疗前后及治疗期间用游标卡尺测量肿瘤最大直径和最小直径,计算肿瘤体积。采用S-P免疫组织化学法检测复方守宫散对裸鼠皮下胃癌组织中VEGF、bFGF表达的影响。结果治疗前各组裸鼠肿瘤体积无明显差异(P>0.05)。治疗结束后,复方守宫散各组及5-FU组肿瘤体积及重量小于生理盐水组(P<0.05),而且复方守宫散对肿瘤生长的抑制作用呈现剂量依赖性,5-FU的抑瘤效果强于中、高剂量复方守宫散(P<0.05)。免疫组织化学检测结果显示,与生理盐水组比较,复方守宫散和5-FU均能下调裸鼠皮下胃癌组织中VEGF、bFGF的表达(P<0.05),并且存在剂量依赖性。复方守宫散中低剂量组VEGF表达高于5-FU组,复方守宫散各组bFGF表达亦高于5-FU组(P<0.05)。结论复方守宫散抗血管生成的机理可能是通过抑制VEGF、bFGF的表达,导致肿瘤血管生成受到抑制。
复方守宫散;胃癌;血管生成;血管内皮细胞生长因子;碱性成纤维细胞生长因子
1971年Folkma首次提出肿瘤的生长和转移具有血管依赖性之后[1],肿瘤血管生长的调节机制和抗血管生成在肿瘤治疗中的意义得到广泛关注。近年来,随着对肿瘤血管生成机制研究的不断深入,抗血管生成药物也得以快速研发,其中对天然药物及其组分的研究占有相当大的比例。我们在既往研究的基础上设计了该课题,目的在于明确复方守宫散抗胃癌血管生成作用,阐明其作用机制,为开发具有抗肿瘤血管生成作用的中药新药提供理论基础和实验数据。
1 材料与方法
1.1 实验材料
1.1.1 实验药品鼠抗人VEGF单抗隆抗体、鼠抗人bFGF单抗隆抗体、鼠抗人CD-34单克隆抗体购于武汉博士德生物工程有限公司;SP超敏试剂盒、DAB购于福州迈新生物技术有限公司。另外,实验用药中药剂量确定:复方守宫散按照传统煎煮法,低、中、高剂量组药物浓度根据人与动物体表面积与计量换算法计算[2],低剂量组:1mg/kg/d,中剂量组:2mg/kg/d,高剂量组:4mg/kg/d,分别相当于临床等效剂量的1/2、1、2倍。根据5-氟脲嘧啶的LD50为117.2mg/kg,注射用量为LD50的1/3~1/5[3],参考文献选用剂量20mg/kg/d。
1.1.2 实验动物BALB/C-nu/nu裸鼠,4~6周龄,体重18~20g,雄性,在安徽医科大学动物实验中心无特殊病原体(Specific pathogens free,SPF)条件下分笼饲养,自由觅食、饮水,由上海斯莱克实验动物有限公司提供。
1.2 方法
1.2.1 人胃癌裸鼠皮下移植瘤模型的建立将带有胃癌MKN-45瘤体生长良好的裸鼠以颈椎脱臼法处死,取出瘤块置生理盐水中切割成1.5~2.0mm 3小块备用。将瘤块轻推入套管针内,左手固定裸鼠偏右侧,皮肤消毒后,将带有瘤块的套管针刺入BALB/C-nu/nu裸鼠右侧腋下皮肤,瘤块植入皮下即可。
1.2.2 动物分组及给药裸鼠皮下瘤块植入约一周左右即可见圆形小皮丘,待肿瘤直径长至0.5~0.7cm(约20 d左右)时,将裸鼠随机分为5组,每组3只,具体分组及给药如下:①阴性对照组(NS组):灌胃,生理盐水0.2ml/d,6周;②5-氟脲嘧啶组(5-Fu组):腹腔注射,5-Fu 20mg/kg/d,3周;③复方守宫散低剂量组(Sgs1组):灌胃,1mg/kg/d,6周;④复方守宫散中剂量组(Sgs2组):灌胃,2mg/kg/d,6周;⑤复方守宫散高剂量组(Sgs3组):灌胃,4mg/kg/d,6周。实验过程中定期(间隔3~4天)测量肿瘤大小,并称量裸鼠体重。
1.2.3 测定裸鼠胃癌瘤块组织VEGF、bFGF及免疫组化图像分析采用S-P免疫组织化学法(Immunohistochemistry,IHC)对裸鼠皮下胃癌组织中VEGF、bFGF等蛋白表达进行检测,操作方法参见说明书。阳性染色为棕黄色颗粒,定位于细胞浆和(或)细胞核中,观察染色切片中具有代表意义的高倍视野,以上述方法分析每个视野中的阳性面积和相应OD值作为结果,免疫组化阳性表达指数=阳性面积比×OD值。比较各组免疫组化阳性表达指数。
1.3 统计学分析所有数据均以平均值±标准差(χ± s)表示。采用SPSS11.5统计软件进行分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 人胃癌细胞致瘤结果及荷瘤裸鼠生长情况BALB/C-nu/nu裸鼠皮下接种人胃癌MKN-45瘤块后,所有动物均于一周左右出现肉眼可见的皮下圆形小结节,大约20 d左右肿瘤直径长至0.5~0.7cm,接种成功率为100%。经随机分组后,在给药1周左右化疗组部分动物开始出现消瘦、活动减少,饮食有不同程度减少的现象,而中药组则在2周左右才开始出现类似情况,而且中药组生长状况明显优于5-Fu对照组及NS组。给药2周左右,5-Fu对照组有裸鼠出现衰竭症状,消瘦呈弓背状,肋骨隐约可见,活动受限,腹部膨隆或呈蛙形腹,遂结束实验,牺牲所有实验动物。(见图1)。
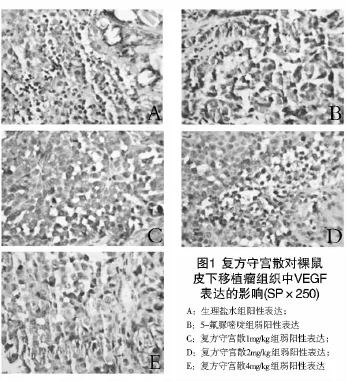
2.2 复方守宫散对裸鼠皮下肿瘤生长的影响实验结果显示,治疗前各组裸鼠肿瘤大小无明显差异(P>0.05),提示各组瘤体具有可比性。在治疗过程中,生理盐水组裸鼠肿瘤生长较快,个别肿瘤表面有破溃倾向,而复方守宫散及5-Fu组裸鼠肿瘤生长相对缓慢。治疗结束后复测肿瘤大小,结果显示,复方守宫散各组及5-Fu组肿瘤体积明显小于生理盐水组(P<0.05),其中复方守宫散组随着给药剂量的增大其相对肿瘤增殖率逐渐减小,说明复方守宫散组抑制肿瘤生长的作用存在剂量依赖性,与5-Fu组比较差异无统计学意义(P>0.05)(见表1,图2)。
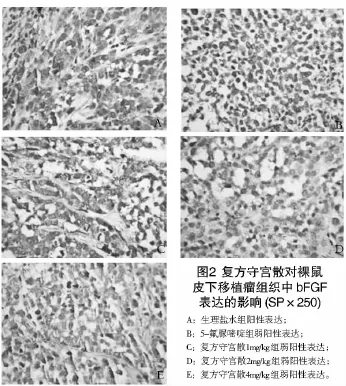
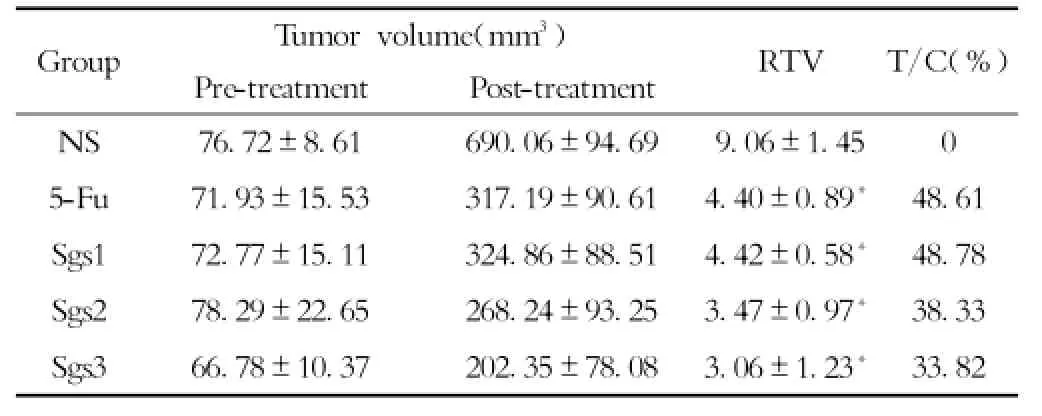
表1 复方守宫散组对人胃癌MKN-45细胞裸鼠皮下移植瘤生长的影响(χ±s,n=3)
2.3 复方守宫散对裸鼠皮下移植瘤组织中VEGF和bFGF表达的影响将裸鼠皮下胃癌组织进行免疫组织化学检查,结果显示,复方守宫散和5-FU能够下调胃癌组织中VEGF和bFGF的表达,与生理盐水组比较差异具有统计学意义(P<0.05)。复方守宫散各组随着用药剂量的增大抑制效果愈加明显,说明存在剂量依赖关系。复方守宫散中低剂量组VEGF表达高于5-FU组(P<0.05),而复方守宫散高剂量组的VEGF表达却低于5-FU组(P<0.05)。复方守宫散各组bFGF表达均高于5-FU组(P<0.05或P<0.01),说明5-FU下调bFGF的作用强于复方守宫散(表2)。

表2 复方守宫散对MKN-45细胞裸鼠皮下移植瘤VEGF和bFGF表达的影响(χ±s,n=3)
3 讨论
胃癌的生长和代谢需要持续的血管生成,而且胃癌的血管新生化与其生长、浸润、转移、分期及预后有着密切联系。血管生成是肿瘤生长的必要条件,直径超过1~2mm的实体瘤的生长需要新生血管的介入和支持[4]。肿瘤的生长依赖于血管的生成,只有当大量的肿瘤相关血管长入肿瘤实质内部,才能促使肿瘤持续生长和转移;反之,肿瘤生长将受到明显限制[5]。1996年Hanahan等[6]提出肿瘤新生血管开关学说,该学说认为:肿瘤血管生成是诸多与血管生成有关的调节因子相互作用的结果。这些调节因子包括促血管生成因子和血管生成抑制因子,在通常情况下二者处于一定的平衡点,当肿瘤由静止状态发展至伴随血管生成的浸润状态时,这一平衡被打破,表现为促进因子的增多或/和抑制因子的减少。此时,肿瘤血管再生的开关点就朝向有利于血管生成的方向发展,从而启动了肿瘤血管再生过程,促进肿瘤的发生、发展和转移。
VEGF和bFGF是最重要的两个血管生成调控因子,有研究证实,VEGF参与了胃癌的形成、生长、侵袭和转移,VEGF是目前所知作用最强的一种促血管生成因子,它具有以下生物学活性:①与特殊受体结合激活磷脂酶C,快速诱导钙离子对血管内皮细胞的直接作用,增加血管通透性,为多种细胞迁移提供一个纤维网架。②刺激血管内皮细胞的增殖和迁移,促进血管构建及生成。③参与免疫系统的调节,抑制抗原递呈细胞成熟,促使肿瘤细胞逃避免疫监视[7-10]。碱性成纤维细胞生长因子(bFGF)在细胞增殖、分化、迁移和血管生成中发挥重要的调节作用,与VEGF共同存在时二者具有协同作用[11,12]。
鉴于以上理论,我们应用免疫组织化学法对裸鼠皮下移植性胃癌组织中的VEGF和bFGF进行了检测,结果表明,在胃癌组织中有VEGF和bFGF表达,而且不同剂量复方守宫散和5-氟脲嘧啶均可抑制VEGF和bFGF的蛋白表达,复方守宫散的抑制强度随着药物剂量的增大而增强,存在明显量效依赖关系。提示复方守宫散对胃癌血管的生成抑制作用是通过下调血管生成促进因子的表达来实现的。
通过以上研究我们认为,复方守宫散具有明显抑制裸鼠皮下移植性胃癌生长的作用,它对移植瘤的血管生成产生阻断效应,其作用机理可能与影响VEGF、bFGF等血管生成因子的表达,藉此抑制血管内皮细胞的增殖、迁移和小管形成,最终起到抗血管生成和抑制肿瘤的作用。可见,复方守宫散具有抗血管生成和抑制肿瘤生长的作用,它在提高胃癌治疗效果方面具有良好的应用前景。
[1]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med.1971,285(21):1182-1186.
[2]马超英.实验中医学基础[M].北京:中国协和医科大学出版社,2000:279.
[3]徐叔云,卞如廉,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:1762.
[4]So J,Wang FQ,Navari J,et al.LPA-induced epithelial ovarian cancer(EOC)in vitro invasion and migration are mediated by VEGF receptor-2(VEGF-R2)[J].Gynecol Oncol,2005,97(3):870-878.
[5]Boehm T,Folkman J,Browder T,et al.Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance[J].Nature.1997;90(6658):404-407.
[6]Hanahan D,Folkman J.Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis[J].Cell,1996,86(3):353-364.
[7]Dvorak HF,Sioussat TM,Brown LF,et al.Distribution of vascular permeability factor(vascular endothelial growth factor)in tumors:concentration in tumor blood vessels[J].JExp Med,1991,174(5):1275-1278.
[8]Ferrara N.Role of vascular endothelial growth factor in physiologic and pathologic angiogenesis:therapeutic implications[J].Semin Oncol,2002,29(6 Suppl 16):10-14.
[9]Jain RK.Tumor angiogenesis and accessibility:role of vascular endothelial growth factor[J].Semin Oncol,2002,29(6 Suppl 16):3-9.
[10]Kondo Y,Arii S,Furutani M,et al.Implication of vascular endothelial growth factor and p53 status for angiogenesis in noninvasive colorectal carcinoma[J].Cancer,2000,88(8):1820-1827.
[11]Cronauer MV,Schulz WA,Seifert HH,et al.Fibroblast growth factors and their receptors in urological cancers:basic research and clinical implications[J].Eur Urol,2003,43(3):309-319.
[12]Lissoni P,Rovelli F,Malugani F,et al.Changes in circulating VEGF levels in relation to clinical response during chemotherapy for metastatic cancer[J].Int JBiol Markers,2003,18(2):152-155.
Experimental Study on Anti-angiogenic Effects of Fufang Shougong San on the Human Gastric Carcinoma Transplanted in Nude Mice
Zhu Yongfu Xia Liming Zheng Shengqi
(Oncology Department,The First Affiliated Hospital,Anhui University of TCM,Anhui Province,Hefei,230031,China)
Objective To explore the mechanisms of antiangiogenic effects of Fufang Shougong San by studying theeffects of Fufang Shougong San on the expression of proangiogenic factors such as VEGF,bFGF.MethodsXenotransplanted models of human gastric carcinoma cell MKN-45 suspension under the dorsal skin of nude mice were established.Inoculated mice were randomly divided into normal saline(NS)group,positive control(5-fluorouracil,5-FU,20mg/kg)group,low dose Fufang Shougong San(1mg/kg)group,medium dose Fufang Shougong San(2mg/kg)group and high dose Fufang Shougong San(4mg/kg)group when the diameter of tumor was more than 0.5cm,3 in each group,and lavaged Fufang Shougong San、NS of different dosage for 6 weeks,injected 5-FU once a day for 3 weeks.All the nude mice were sacrificed after treatment,the size and weight of tumor were measured and the tumor volumes and the inhibition rates of tumor were calculated.Expression of VEGF,bFGF in subcutaneous tumors of nude mice was detected by immunohistochemical method.Results There was no significant difference in tumor volume of nude mice of different groups before treatment.The mice treated with Fufang Shougong San and 5-FU showed significantly smaller volume and weight of tumor than those of NS group(P<0.05)after treatment,and inhibitory effects of Fufang Shougong San were in a dose-dependent manner.The volume and weight of tumor of 5-FU group were smaller than those of medium and high dose Fufang Shougong San groups(P<0.05).The protein expression of VEGF、bFGF of the Fufang Shougong San groups and 5-FU group were significantly lower than those of the NS group(all P<0.05).The protein expression of VEGF of the low and medium dose Fufang Shougong San groups was significantly higher than that of 5-FU group,and the protein expression of bFGF of 5-FU group was lower than that of the Fufang Shougong San groups(P<0.05).ConclusionsThe mechanism of the inhibition of angiogenesis with Fufang Shougong San treatment may be related to the downregulation of the expression of proangiogenic factors such as VEGF,bFGF.
Fufang Shougong San;Gastric carcinoma;Angiogenesis;Vascular endothelial growth factor;Basic fibroblast growth factor
10.3969/j.issn.1672-2779.2013.23.115
:1672-2779(2013)-23-0155-03
吴义红
2013-10-21)
安徽省教育厅自然科学重点项目计划[No:KJ2007A037]



