龚 倩,匡继林,张 翼
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第二附属医院,湖南 长沙 410005)
输卵管炎性阻塞性不孕(salping obstruent infertility,SOI)是指各种致病菌如生殖道支原体、沙眼衣原体和淋病奈瑟菌等作用于输卵管,使输卵管黏膜破坏,或伞端黏连,引起管腔变形、瘢痕形成,甚者与周围组织器官形成粘连,从而使精卵细胞的结合或受精卵运送至宫腔受阻导致的女性不孕[1]。近年来,性传播疾病和宫腔手术逐年增加,患有SOI的女性越来越多,严重影响患者身心健康及其家庭关系[2]。
通管丸是在谢剑南教授治疗SOI的经验方——通管方的基础上所制成。本课题组前期证实通管方对改善输卵管炎性阻塞性不孕有显着疗效[3]。后逐渐开展了通管方治疗输卵管炎性阻塞性不孕的动物实验研究、药理研究,证实通管方能降低模型大鼠血清中IL-1、IL-6、TNF-α的含量[4-5],并通过降低或抑制输卵管上皮EGFR、ICAM-1、BAX表达而达到治疗SOI的目的[6-7]。但通管丸治疗SOI的具体机制尚不明确,因此本课题通过检测通管丸含药血清对巨噬细胞炎症模型中磷酸化IRAK4、磷酸化IKKs蛋白表达水平的影响,探讨通管丸对介导炎症反应TLR2/MyD888/NF-κB信号通路的影响,从蛋白质分子水平对通管丸治疗SOI的作用机制进行阐明,为中医药防治SOI提供切实可靠的实验依据。
1 材料与方法
1.1 实验动物8~12周健康SPF级Wistar雌性大鼠10只,体质量(191.84±7.73)g,购于北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006,均饲养于湖南中医药大学动物实验中心SPF级实验室,温度22~26℃,相对湿度30%~70%,保持实验室内环境安静,通风干燥。实验开始前适应性喂养大鼠3 d。
1.2主要药物及试剂 通管丸药物组成:穿破石20 g,党参15 g,茺蔚子10 g,白术15 g,当归10 g,薤白10 g,丹参10 g,赤芍10 g,泽兰10 g,乳香10 g,香附10 g,没药10 g,王不留行10 g,路路通10 g,甘草5 g,三七5 g,穿山甲7 g。以上所述中药均由湖南中医药大学第二附属医院的中草药房提供。本课题组前期实验研究证实通管丸混悬液高剂量组对SOI的炎症抑制最显着[7],根据“人和动物间体表面积折算的等效剂量比率表”折算出大鼠的给药高剂量为18.9 g/kg;兔多抗P-IRAK4(60 KDa)(Affinity,批号:DF7567);兔多抗P-IKK(85KDa)(Affinity,批号:AF3013)。
1.3 主要仪器JY3002型电子天平(上海精密科学仪器有限公司);CO2恒温培养箱(Thermo公司);荧光倒置显微镜(BIORAD);电泳仪(芬兰雷勃);FlexStation 3多功能酶标仪(Molecular Devices);微型高速离心机(美国Labnet);医学图像分析系统(Motic 6.0)等。
1.4 血清的制备将10只大鼠按照随机数字表法将其分为实验组和对照组,每组5只。用蒸馏水配置通管丸浸膏高剂量混悬液(1.26 g/mL),实验组大鼠予通管丸高剂量混悬液(18.9 g/kg)灌胃,对照组大鼠予等量生理盐水,2次/d,连续3 d。在最后一次给药1 h后,用10%水合氯醛腹腔注射麻醉大鼠,将大鼠四肢固定,解剖,腹主动脉采血4 mL,离心后取上血清,56℃水浴30 min灭活,-20℃低温冷藏备用。
1.5 最佳含药血清浓度检测将武汉巴菲尔生物技术服务有限公司所赠RAW264.7细胞随机分为9组,正常培养组、无药血清组(5%、10%、20%、40%)和含药血清组(5%、10%、20%、40%),每组设3个复孔。正常培养组添加10%胎牛血清;无药血清各组分别添加5%、10%、20%、40%浓度的无药血清,含药血清各组分别添加5%、10%、20%、40%浓度的含药血清,放入恒温培养箱中培养24 h,CCK8法检测最佳含药血清浓度[8]。
1.6 RAW264.7细胞炎症模型制备参考文献[9]方法,将RAW 264.7细胞随机分为造模组和非造模组,每组设8个复孔。造模组的培养基中添加100 ng/mL的LPS,非造模组培养基中添加等量的PBS溶液。诱导24 h后,观察各组细胞形态变化。将各组离心后取上清液,采用ELISA方法检测两组上清液中TNF-α、IL-1β的含量,确定100 ng/mL的LPS是否能够成功制造巨噬细胞体外炎症模型。
1.7 Western blotting检测磷酸化IRAK4、磷酸化IKKS蛋白相对表达量将培养的RAW264.7细胞随机分为5组,空白对照组、NF-κB阻断剂组、PPAR-γ激动剂组、无药血清组、含药血清组,每组设6个复孔。空白对照组:正常RAW264.7细胞+10%胎牛血清;NF-κB阻断剂组:造模后的RAW264.7细胞+20 μmol/L NF-κB阻断剂SN50;PPAR-γ激动剂组:造模后的RAW264.7细胞+20 μmol/L吡格列酮;无药血清组:造模后的RAW264.7细胞+10%无药血清;含药血清组:造模后的RAW264.7细胞+10%含药血清;将各组放入恒温培养箱培养24 h后,Western blotting检测磷酸化IRAK4、磷酸化IKKS蛋白相对表达量[10]。
1.8 统计学方法采用统计软件SPSS 21.0进行统计分析,计量资料以“均数±标准差”(±s)表示,两组比较采用t检验,多组比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 正常RAW264.7细胞形态学观察培养24 h后镜下观察细胞形态,可见贴壁细胞胞体较小,呈圆形或椭圆形,少量细胞可见伪足或突起,单核,呈明显的RAW264.7细胞形态。(见图1)
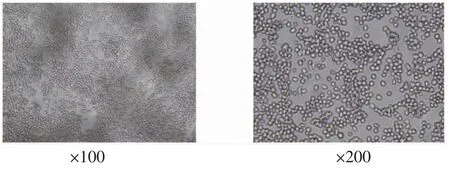
图1 正常RAW264.7细胞形态
2.2 不同浓度含药血清对RAW264.7细胞活力影响的比较与正常培养组比较,10%无药血清组、5%含药血清组、10%含药血清组和20%含药血清组细胞活力明显增加,而40%无药血清组、40%含药血清组RAW264.7细胞活力明显降低(P<0.05);5%无药血清组、20%无药血清组细胞活力与正常培养组比较无明显变化(P>0.05)。与10%含药血清组比较,5%含药血清组、20%含药血清组和40%含药血清组的细胞活力明显降低(P<0.05)。因此浓度为10%的血清为最佳浓度含药血清。(见表1、图2)
表1 各组RAW 264.7细胞活力比较(±s,%)
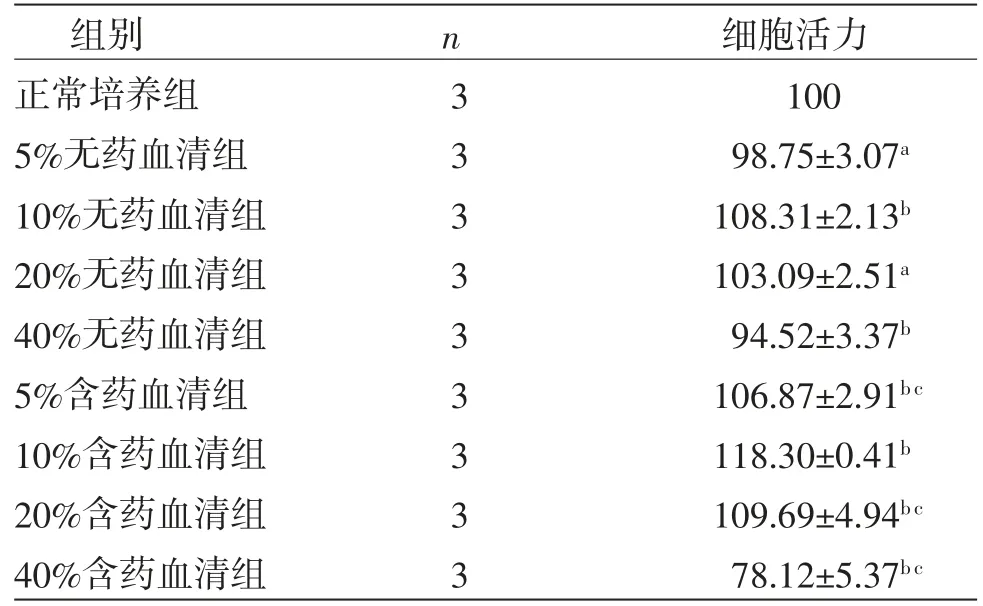
表1 各组RAW 264.7细胞活力比较(±s,%)
注:与正常培养组比较,aP>0.05,bP<0.05;与10%含药血清组比较,cP<0.05
组别 n 细胞活力正常培养组 3 100 5%无药血清组 3 98.75±3.07a 10%无药血清组 3 108.31±2.13b 20%无药血清组 3 103.09±2.51a 40%无药血清组 3 94.52±3.37b 5%含药血清组 3 106.87±2.91b c 10%含药血清组 3 118.30±0.41b 20%含药血清组 3 109.69±4.94b c 40%含药血清组 3 78.12±5.37b c
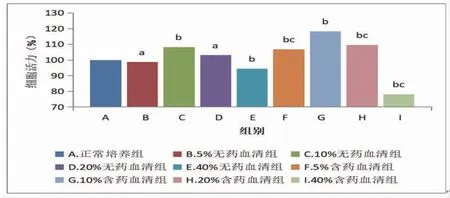
图2 各组RAW 264.7细胞活力比较
2.3 RAW264.7细胞形态变化诱导24 h后镜下观察,非造模组RAW264.7细胞无明显变化,造模组RAW264.7细胞呈梭形或长梭形改变,大量细胞呈现伪足或突起,胞体内可见吞噬小泡呈炎症反应变化。(见图3)
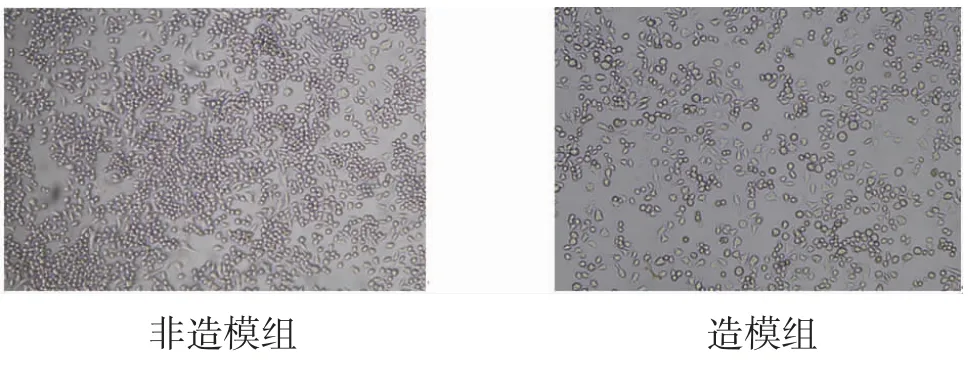
图3 各组RAW264.7细胞形态变化(×100)
2.4 各组RAW264.7细胞TNF-α、IL-1β蛋白含量比较与非造模组比较,造模组TNF-α、IL-1β含量明显增加(P<0.05),结合镜下RAW264.7细胞形态学变化,由此表明巨噬细胞体外炎症模型造模成功。(见表2)
表2 各组RAW264.7细胞TNF-α、IL-1β含量比较(±s,pg/mL)

表2 各组RAW264.7细胞TNF-α、IL-1β含量比较(±s,pg/mL)
组别 n TNF-α IL-1β非造模组 8 15.096±1.186 8.178±0.285造模组 8 67.371±1.602 24.589±0.184
2.5 各组RAW264.7细胞磷酸化IRAK4、磷酸化IKKs蛋白相对表达量比较与空白对照组比较,无药血清组、NF-κB阻断剂组、PPAR-γ激动剂组、含药血清组中磷酸化IRAK4、磷酸化IKKs蛋白含量明显升高(P<0.05);与无药血清组比较,NF-κB阻断剂组、PPAR-γ激动剂组、含药血清组RAW264.7细胞中磷酸化IRAK4、磷酸化IKKs蛋白含量均降低(P<0.05)。(见图4、表3)
表3 各组RAW264.7细胞磷酸化IRAK4、磷酸化IKKs蛋白相对表达量比较(±s)
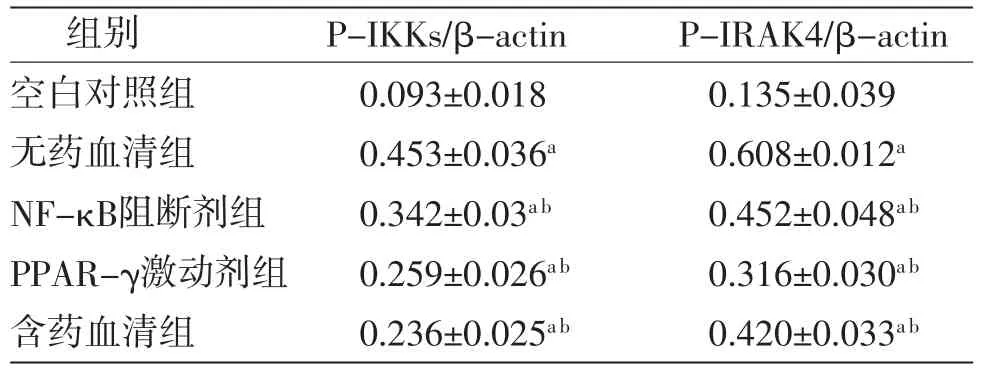
表3 各组RAW264.7细胞磷酸化IRAK4、磷酸化IKKs蛋白相对表达量比较(±s)
注:与空白对照组比较,aP<0.01;与无药血清组比较,bP<0.05
组别 P-IKKs/β-actin P-IRAK4/β-actin空白对照组 0.093±0.018 0.135±0.039无药血清组 0.453±0.036a 0.608±0.012a NF-κB阻断剂组 0.342±0.03a b 0.452±0.048a b PPAR-γ激动剂组 0.259±0.026a b 0.316±0.030a b含药血清组 0.236±0.025a b 0.420±0.033a b
图4 各组RAW264.7细胞磷酸化IRAK4、磷酸化IKKs蛋白表达
3 讨 论
SOI属中医“断绪”“无子”“痛经”及“症瘕”的范畴,其发病以气滞血瘀为核心病机,气血运行不畅,气滞则血瘀,冲任、胞脉不通,精卵不能交融而致不孕。因此治疗本病重在“活血化瘀通络”,通过改善输卵管血液循环,促进输卵管的炎症吸收,达到治疗SOI的目的。
通管方中穿破石有活血化瘀、通络止痛、解毒消肿之功效。现代药理研究发现穿破石具有显着的镇痛抗炎作用,并且穿破石能够抑制输卵管组织的炎症反应,促进病变输卵管上皮细胞的增生修复[11]。穿山甲气腥而窜,贯穿经络,通滞散结。二者共为君药,能够加强活血化瘀、消症散结之功效。当归养血活血调经;丹参活血祛瘀,理气调经,凉血消痈;茺蔚子调经明目;三七通脉行瘀定痛。四药共为臣药,意在疏通血脉,流动气血,使气血调和,经自通也。香附疏肝理气;赤芍散瘀止痛,凉血消肿。薤白行气导滞,通阳散结;乳香活血,没药散血,皆能定痛消肿生肌;路路通和血通窍;泽兰活血祛瘀行水。党参、白术补气健脾。诸药共为佐药,加强君药、臣药之效,并且使其化瘀而不伤正。甘草为使药,起到调和诸药之效。诸药合用化瘀消症,通经活络,能够攻邪不伤正,扶正不留邪,使输卵管复通,冲任得以调达而摄精受孕。
研究表明TLR2/MyD88/NF-kB信号转导通路介导的炎症反应在输卵管炎性病变发生、发展及预后的过程中,发挥了重要的作用[12]。TLR2与配体结合后,向MyD88蛋白传导信号,MyD88进一步募集IRAKs家族,其中IRAK4是依赖于MyD88激活的关键蛋白分子,磷酸化的IRAK4与TRAF6形成复合物,使TRAF6产生低聚作用,进一步通过衔接蛋白TAB激活TGF-β与NIK,活化的NIK进而磷酸化IKKs,磷酸化的IKKs催化IκB蛋白磷酸化,随后IκB蛋白被降解,使NF-κB从IkB/NF-κB复合物中被释放出来,从而NF-κB得以激活,活化的NF-κB引起促炎细胞因子基因的转录和表达,使大量的炎性细胞和炎症介质积聚浸润于炎症部位,导致炎症反应的持续和放大[13]。IRAK4和IKKs在TLR2/MyD88/NF-κB介导的信号通路中有着承上启下的作用。研究发现在R848、LPS及IL-1的作用下,IRAK4激酶失活的模型组小鼠的巨噬细胞在炎症反应中的趋化因子和炎性因子的mRNA稳定性明显降低[14]。研究发现IKKs催化亚基IKKα和IKKβ的基础活化质粒表达本身即可诱导NF-κB活化,而失活质粒的表达则显着抑制NF-κB的活化[15]。
本课题前期实验研究表明通管方能降低SOI模型大鼠血清中IL-1、IL-6、TNF-α的含量,并通过降低或抑制输卵管上皮EGFR、ICAM-1、BAX表达而达到治疗SOI的目的。本研究发现给予通管丸含药血清后,磷酸化IRAK4和磷酸化IKKs蛋白的表达明显降低,因此推断通管丸可能通过抑制TLR2/MyD88/NF-κB信号通路中“关键元件”磷酸化IRAK4和磷酸化IKKs蛋白的表达,从而达到抑制炎症反应的目的。



