张华敏,刘娜,邓巧娟
(广东医科大学附属医院,广东 湛江 524000)
非酒精性脂肪性肝病(non alcoholic fatty liver disease,NAFLD)是指除病毒或酒精等因素引起的肝损伤,国内目前有超过1.5亿患者,其中20%~40%患者发展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)[1-2]。细胞焦亡是近年来发现并证实的一种新的程序性细胞死亡方式,目前已有研究表明细胞焦亡在NASH的发展中起着至关重要的作用[3-4]。
羟基红花黄色素A是一种单查尔酮类化合物,具有抗氧化、抗凋亡、抗炎症、抗血小板凝集等活性。LI Y N[5]等研究表明羟基红花黄色素A对于肝纤维化有一定的疗效。HE Y[6]等研究表明羟基红花黄色素A对大鼠酒精性肝损伤具有保护作用。本研究采用游离脂肪酸(free fatty acid,FFA)处理L-02细胞建立NASH细胞模型,在此基础上观察和测定羟基红花黄色素A对NASH的影响,并探寻其作用机制是否与肝细胞细胞焦亡有关,从而为NASH的临床治疗研究提供参考。
1 材料与方法
1.1 细胞L-02细胞系购于中科院上海细胞库,将细胞解冻后离心,加入DMEM培养基,于37℃,5%CO2条件下培养。
1.2 药物与试剂 羟基红花黄色素A(上海士锋生物科技有限公司,货号:78281-02-4,纯度≥98%);DMEM(美国Gibco公司,货号:12100046);胎牛血清(美国Gibco公司,货号:16000044);油红O染色液(上海生工,货号:E607319-0010);油酸(上海生工,货号:A502071-0250);棕榈酸(上海纯优生物,货号:P0687);一步法反转录荧光定量试剂盒(上海生工,货号:B639277-0050);Trizol(上海生工,货号:B610409-0025);炎症小体感受器分子NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)兔单克隆抗体(艾博抗公司,货号:M00034);半胱氨酸蛋白酶1(Cysteinyl aspartate specific proteinase 1,Caspase-1)兔单克隆抗体(艾博抗公司,货号:ab207802);消皮素D(Gasdermin D,GSDMD)兔单克隆抗体(艾博抗公司,货号:ab209875);白细胞介素-18(IL-18)兔多克隆抗体(艾博抗公司,货号:ab207324);白细胞介素-1β(IL-1β)兔多克隆抗体(英国abcam,货号:ab9722);磷酸甘油脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多克隆抗体(英国abcam,货号:ab9485);HRP标记二抗(英国abcam,货号:ab30451)。
1.3 主要仪器HERAcell150i型CO2细胞培养箱(美国Thermo公司);51029702型超净台(Thermofisher公司);680型酶标仪(Bio-Rad公司);CFX96型PCR仪(Bio-Rad公司);PowerPac Basic型电泳仪(Bio-Rad公司);AlphaImager HP型凝胶成像系统(美国阿尔法公司)。
1.4 分组与给药 将油酸或棕榈酸溶解于无水乙醇中,制备为50 mmol/L的储存液。羟基红花黄色素A溶解于DMEM培养基,浓度为500 mg/L。实验分为对照组、模型组和羟基红花黄色素A组,对照组为不做处理的人正常肝脏细胞L-02,模型组用500μmol/L的FFA(油酸∶棕榈酸=2∶1)处理L-02细胞24 h,羟基红花黄色素A组在模型组基础上用0.2 mg/mL的羟基红花黄色素A处理细胞24 h,羟基红花黄色素A处理时间和方法参考文献[5]。
1.5 油红O染色检测各组细胞中的脂质沉积 将油红O工作液加入各组细胞中,室温孵育60 min,弃染色液,用PBS清洗后,显微镜下观察拍照。
1.6 ELISA检测各组细胞内ALT、AST、SOD、MDA、IL-18、IL-1β含量 收集各组细胞,2 500 r/min离心20 min,收集上清备用。按照各自ELISA检测试剂盒说明书检测细胞内谷丙转移酶(Alanine transaminase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Malondialdehyde,MDA)、IL-18、IL-1β含量。
1.7 RT-qPCR检测细胞中NLRP3 mRNA、Caspase-1 mRNA、GSDMD mRNA表达水平 收集各组细胞,分别加入TRIzol提取RNA,再参照一步法反转录荧光定量试剂盒检测NLRP3 mRNA、Caspase-1 mRNA、GSDMD mRNA表达水平,以GAPDH为内参。RT-qPCR反应程序见说明书。引物如下,NLRP3正向:5'-GCGCCTCAGTTAGAGGATGT-3',反向:5'-ACCAGCTACAA AAAGCATGGA-3';Caspase-1正向:5'-TTTCCGCAAGGTTCGATTTTCA-3',反向:5'-GGCATCTGCGCTCTACCATC-3'。GSDMD正向5'-CCATCGGCCTTTGAGAAAGTG-3',反向:5'-ACACATGAATAACGGGGTTTCC-3';GAPDH正向:5'-AAGGTGAAGGTCGGAGTCAAC-3',反向:5'-GGGGTCATT GATGGCAACAATA-3'。
1.8 Western blotting检测各组细胞中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白表达 收集各组细胞,分别加入RIPA裂解液,冰上放置20 min后,4℃13 000 r/min离心20 min,取35μg总蛋白进行SDS-PAGE,转PVDF膜,用2%BSA封闭液封闭,分别加入一抗(1∶1 000)4℃过夜,以GAPDH抗体(1∶10 000)为参照,再加入二抗(1∶10 000)室温孵育1 h。ECL曝光成像,采用Alpha Imager HP凝胶成像系统分析结果。
1.9 统计学方法 数据均采用SPSS 21.0软件进行分析。符合正态分布的计量资料用(±s)表示,多组比较采用单因素方差分析,组间两两比较均采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 油红O染色结果 对照组细胞内未出现红色脂滴,模型组细胞红色脂滴较多,细胞肿胀,细胞间隙变大;与模型组比较,羟基红花黄色素A组红色脂滴减少,细胞肿胀得到改善。(见图1)
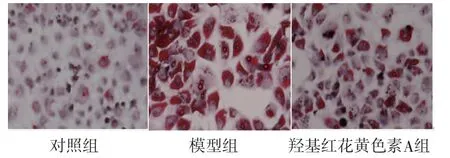
图1 油红O染色结果图(×400)
2.2 羟基红花黄色素A抑制NASH炎症反应及氧化应激 与对照组比较,模型组IL-18、IL-1β、MDA明显升高(P<0.05),SOD明显下降(P<0.05);与模型组比较,羟基红花黄色素A组IL-18、IL-1β、MDA明显下降(P<0.05),SOD明显升高(P<0.05),提示羟基红花黄色素A能够改善NASH炎症反应和氧化应激。(见图2~3)
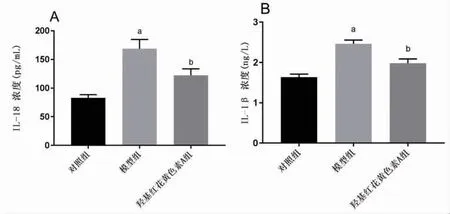
图2 各组细胞炎症因子含量比较(±s,n=3)
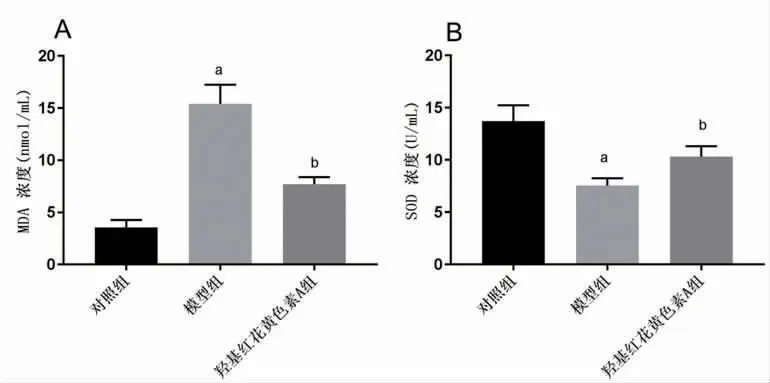
图3 各组细胞MDA、SOD含量比较(±s,n=3)
2.3 羟基红花黄色素A改善NASH肝细胞损伤 与对照组比较,模型组AST、ALT含量明显升高(P<0.05);与模型组比较,羟基红花黄色素A组AST、ALT含量明显下降(P<0.05),提示羟基红花黄色素A能够改善肝细胞损伤。(见图4)
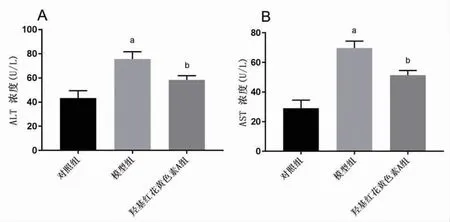
图4 各组细胞ALT、AST含量比较(±s,n=3)
2.4 羟基红花黄色素A抑制NLRP3 mRNA、Caspase-1mRNA、GSDMD mRNA的表达 与对照组比较,模型组NLRP3 mRNA、Caspase-1 mRNA、GSDMD mRNA表达水平明显升高(P<0.05);与模型组比较,羟基红花黄色素A组NLRP3 mRNA、Caspase-1 mRNA、GSDMD mRNA表达水平明显下降(P<0.05)。(见图5)
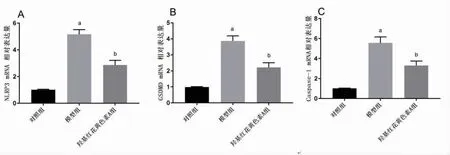
图5 各组细胞NLRP3 mRNA、GSDMD mRNA、Caspase-1 mRNA表达水平比较(±s,n=3)
2.5 羟基红花黄色素A抑制NLRP3、Caspase-1、GSDMD、IL-18、IL-1β蛋白表达 与对照组比较,模型组NLRP3、Caspase-1、GSDMD、IL-18、IL-1β蛋白表达明显升高(P<0.05);与模型组比较,羟基红花黄色素A组NLRP3、Caspase-1、GSDMD、IL-18、IL-1β蛋白表达明显下降(P<0.05)。(见图6)
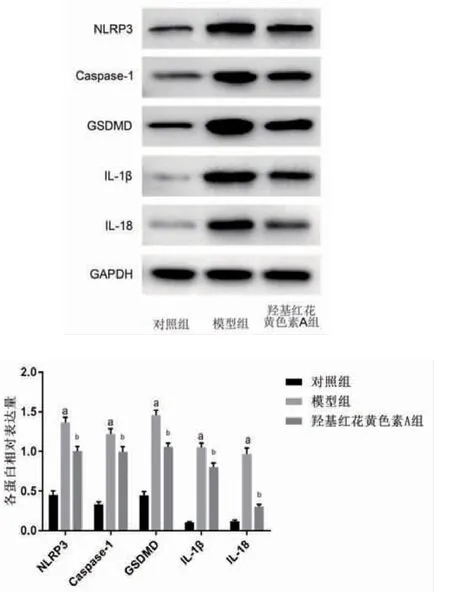
图6 各组细胞NLRP3、Caspase-1、GSDMD、IL-18、IL-1β蛋白表达比较(±s,n=3)
3 讨 论
随着对NASH发病机制研究的深入,目前越来越多研究表明炎症反应是NASH的主要诱导因素,而肝脏脂质过氧化导致的氧化应激也会加重对肝脏的损伤[7-9]。IL-1β和IL-18是炎症因子,在NASH发展中加重肝脏炎症反应;SOD具有抗氧化的作用,而MDA是脂质过氧化产物,二者分别代表着抗氧化能力和氧化损伤程度;ALT和AST反映肝功能损伤程度,当肝细胞受损时,ALT和AST会呈升高状态[10-11]。李风林等[12]发现非酒精性脂肪肝病大鼠血清IL-1β、IL-18含量较对照组明显升高。杨素贞等[13]对NASH模型大鼠及正常大鼠血清ALT、AST、肝组织中MDA和SOD进行检测,发现模型组大鼠ALT、AST、MDA含量明显升高,SOD含量明显下降。羟基红花黄色素A具有单查尔酮苷类结构,是红花黄色素的有效成分。近几年已有研究表明,羟基红花黄色素A可通过抑制活性氧的生成,调节SOD和MDA的活性来缓解氧化应激[14]。此外,羟基红花黄色素A能抑制炎性细胞因子IL-1β,TNF-α的表达[15-16]。因此,推测羟基红花黄色素A抑制NASH的发生发展可能与抑制氧化应激反应和炎症反应有关。为了验证推测,本研究采用FFA处理L-02建立NASH细胞模型,经羟基红花黄色素A处理后,L-02细胞的氧化应激和炎症水平明显降低,且AST、ALT含量明显下降,这与推测结论一致。此外,羟基红花黄色素A处理细胞的剂量0.2 mg/mL是经过参考文献及前期MTT预实验筛选确定的,羟基红花黄色素A在0~0.2 mg/mL的范围内细胞存活率较高,为非细胞毒性剂量。
细胞焦亡是一种依赖于Caspase的炎性细胞死亡形式,伴随着细胞肿胀,质膜孔洞形成,调控大量促炎性细胞内容物释放[17]。目前已有研究表明肝脏库普弗细胞、中性粒细胞、树突状细胞和肝细胞都能发生焦亡参与NASH发生机制的调节[18]。NLRP3属于Nod样受体家族,由凋亡相关斑点样蛋白、核苷酸结合寡聚化结构域及半胱氨酸蛋白酶1前体蛋白3部分组成,其通过激活并裂解pro caspase-1来调控成熟IL-1β和IL-18的释放,诱导细胞焦亡,进而扩大炎症反应[19]。目前已有研究表明敲除NASH模型小鼠肝组织NLRP3基因后可抑制炎性反应,缓解脂肪变性和肝炎病情[20]。GSDMD基因定位于人染色体8q24,因具有质膜成孔活性成为Caspase-1和Caspase-11介导的细胞焦亡的主要执行者。YANG Y[21]等研究表明激活NLRP3/Caspase-1/GSDMD细胞焦亡信号通路可以促进人类子宫内膜癌细胞焦亡。本研究结果显示模型组细胞NLRP3、Caspase-1、GSDMD、IL-18、IL-1β均被激活,说明NASH介导了细胞焦亡,而经羟基红花黄色素A处理后,L-02细胞中NLRP3、Caspase-1、GSDMD、IL-18、IL-1β表达水平明显降低,这与MRIDHA A R等[20]的研究和XU B[22]等的研究结果相似,提示羟基红花黄色素A可以抑制NLRP3/Caspase-1/GSDMD细胞焦亡信号通路激活。
综上所述,羟基红花黄色素A可减轻L-02细胞的炎症反应和氧化应激水平,抑制肝细胞焦亡,从而改善NASH肝细胞损伤,可能与其抑制NLRP3/Caspase-1/GSDMD细胞焦亡信号通路的激活有关。然而羟基红花黄色素A通过何种途径抑制NLRP3/Caspase-1/GSDMD细胞焦亡信号通路有待进一步研究。



