潘晓君,吕渭升,杨文惠,梁 慧,潘 婷,陈 芳,邓淙友,霍文杰,李振雨
(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
酒萸肉是中药材山茱萸除去杂质和残留果核,经酒炖或酒蒸炮制而成的饮片[1]。山茱萸除去杂质和残留果核为山萸肉,山萸肉长于敛汗固脱,用于自汗或大汗不止,阴虚盗汗[2]。山萸肉酒制后,补益肝肾作用增强,多入滋补方剂,常用于眩晕耳鸣、阳痿遗精、遗尿、尿频、月经过多或崩漏、腰部酸痛等[3]。2020年版《中华人民共和国药典》规定了酒萸肉的炮制方式为“取净山萸肉,照酒炖法或酒蒸法炖或蒸至酒吸尽”,炮制后的酒萸肉形如山茱萸,但表面紫黑色或黑色,质滋润柔软,微有酒香气。由于各版《中华人民共和国药典》对酒萸肉的酒炖或酒蒸工艺参数均没有明确规定,市面上所售酒萸肉饮片多按自拟的工艺炮制。有多篇文献对酒萸肉的炮制方式进行过考察,但得出的最佳炮制工艺和参数不尽相同[4-8],市售的酒萸肉饮片颜色上差异较大,内在的质量更是无法保证,仅依靠《中华人民共和国药典》的质量控制方法,评价酒萸肉饮片的质量仍显不足。笔者采用UPLC指纹图谱并结合多成分定量,以及化学计量学方法,对从市面上采购的酒萸肉饮片的质量差异进行分析,旨在为酒萸肉饮片质量的评价提供参考。
1 仪器与试药
1.1 主要仪器 超高效液相色谱仪(H-class PDA检测器,沃特世公司);Waters CORTECS T3色谱柱(2.1 mm×150 mm,1.6 μm);ME204E万分之一天平(梅特勒-托利多公司);XP26百万分之一天平(梅特勒-托利多公司);JJ600百分之一天平(常熟市双杰测试仪器厂);KQ500D型超声波清洗器(昆山市超声仪器有限公司);HWS28型恒温水浴锅(上海一恒科技有限公司);Milli-Q级超纯水系统(德国默克股份有限公司)。
1.2 试药14批酒萸肉饮片经广东一方制药有限公司魏梅主任药师鉴定均为山茱萸科植物山茱萸Cornus officinalis Sieb.et Zucc.的酒制品,饮片信息见表1。没食子酸对照品(批号:110831-201906,含量:91.5%)、5-羟甲基糠醛对照品(批号:111626-201912,含量:99.2%)、莫诺苷对照品(批号:111998-201602,含量:96.3%)、马钱苷对照品(批号:111640-201808,含量:99.0%)、山茱萸对照药材(批号:121495-202004)均购自中国食品药品检定研究院;乙腈(色谱纯,默克股份有限公司);磷酸(色谱纯,天津市科密欧化学试剂有限公司);甲醇(分析纯,西陇科学股份有限公司);水为超纯水。
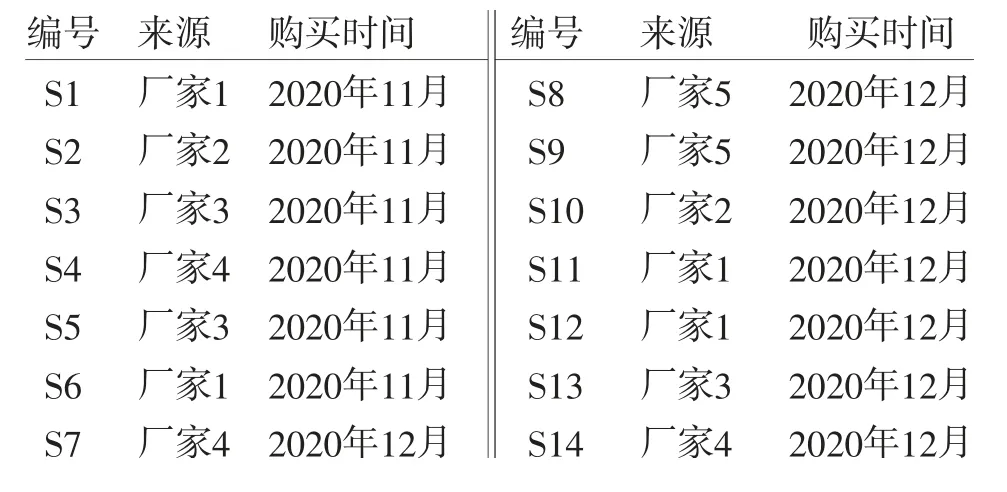
表1 14批市售酒萸肉来源信息表
2 方法与结果
2.1 酒萸肉饮片指纹图谱的建立
2.1.1 色谱条件Waters CORTECS T3(2.1 mm×150 mm,1.6 μm)色谱柱;以乙腈为流动相A,0.2%磷酸为流动相B,梯度洗脱(0~3 min,2%~8%A;3~9 min,8%~15%A;9~13 min,15%~25%A;13~16 min,25%~100%A;16~19 min,100%A);流速:0.2 mL/min;检测波长:260 nm;柱温:35℃;进样量:1 μL。
2.1.2 对照品溶液的制备 取没食子酸、5-羟甲基糠醛、莫诺苷、马钱苷对照品适量,精密称定,加50%甲醇制成每1 mL含没食子酸15 μg、5-羟甲基糠醛50 μg、莫诺苷80 μg和马钱苷100 μg的溶液。
另取山茱萸对照药材约0.2 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇20 mL,密塞,称定质量,超声提取30 min,放冷,用50%甲醇补足减失的质量,摇匀,离心,滤过,取续滤液,即得。
2.1.3 供试品溶液的制备 取酒萸肉饮片粉末(过三号筛)约0.2 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇20 mL,密塞,称定质量,超声提取30 min,放冷,用50%甲醇补足减失的质量,摇匀,离心,滤过,取续滤液,即得。
2.1.4 方法学考察
2.1.4.1 精密度试验 取酒萸肉供试品(编号:S2)溶液,按“2.1.1”项下色谱条件连续进样6次,以马钱苷色谱峰为参照峰S,计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于2.0%,说明该仪器精密度良好。
2.1.4.2 稳定性试验 取同一批酒萸肉饮片(编号:S2)粉末,按“2.1.3”项下方法制备6份供试品溶液,按“2.1.1”项下色谱条件分别在0、4、8、16、20、24 h进样分析,以马钱苷色谱峰为参照峰S,计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于2.0%,说明供试品溶液在24 h内稳定性良好。
2.1.4.3 重复性试验 取“稳定性试验”项下供试品溶液,按“2.1.1”项下色谱条件进样分析,以马钱苷色谱峰为参照峰S,计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于3.0%,说明该方法重复性良好。
2.1.5 指纹图谱的建立及共有峰的确定 取14批酒萸肉饮片样品,按“2.1.3”项下方法制备14份供试品溶液,按“2.1.1”项下色谱条件进样测定,得到14批酒萸肉饮片样品指纹图谱,采用“中药色谱指纹图谱相似度评价系统(2012版)”软件,以编号S1样品指纹图谱为参照,进行保留时间校正和全峰匹配,共标定出9个共有指纹峰。14批酒萸肉饮片指纹图谱叠加图见图1,以平均数法生成酒萸肉饮片对照指纹图谱,见图2。马钱苷是酒萸肉的主要有效成分之一,色谱峰居中,分离度较好,且该成分色谱峰面积较大,因此选择马钱苷(峰6)色谱峰为参照峰S,计算各共有指纹峰的相对保留时间和相对峰面积,并计算RSD值;各共有指纹峰的相对保留时间RSD值在0.32%~2.82%范围内,相对峰面积RSD值在30.04%~115.69%范围内。以山茱萸对照药材为参照(见图3),酒萸肉饮片样品指纹图谱的9个共有指纹峰与对照药材色谱中相应的色谱峰均能够一一对应,说明14批酒萸肉饮片与对照药材基原的一致性,9个共有指纹峰能很好地表征酒萸肉饮片的特征。
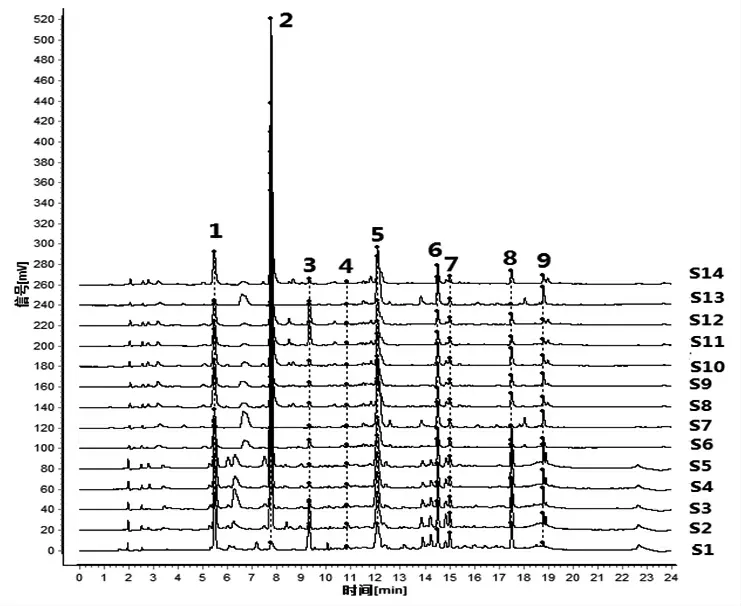
图1 14批酒萸肉饮片UPLC指纹图谱
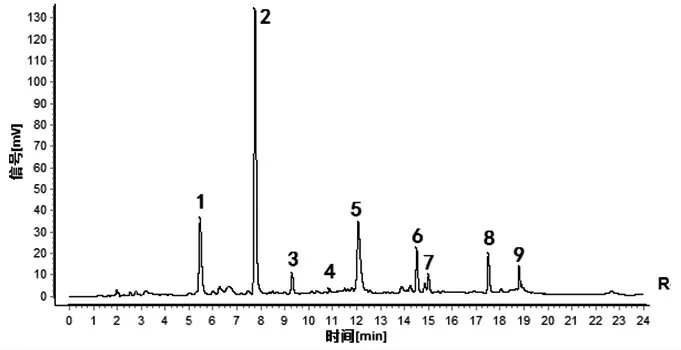
图2 14批酒萸肉饮片对照指纹图谱
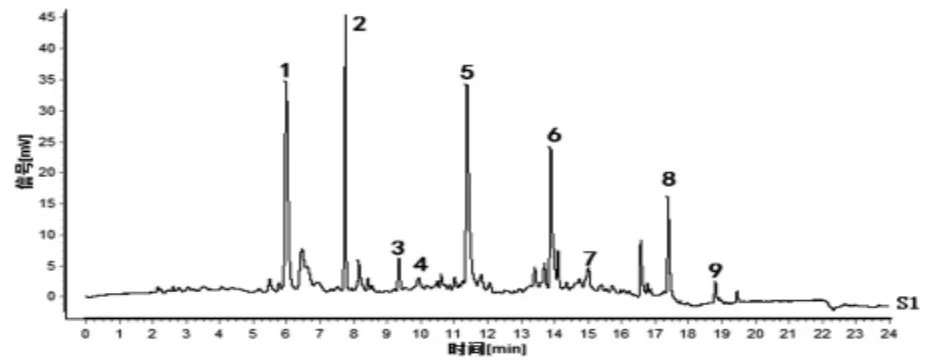
图3 山茱萸对照药材指纹图谱
2.1.6 相似度评价 “中药色谱指纹图谱相似度评价系统(2012版)”采用自主编程,采用夹角余弦算法,将指纹图谱导入数据库管理,对图谱进行处理,能定量地表征各样品间相似程度。相似度范围从0到1,数值越大表明样品间相似程度越高[9-10]。采用“中药色谱指纹图谱相似度评价系统(2012版)”计算14批酒萸肉饮片指纹图谱的相似度,结果见表2。结果显示,14批酒萸肉饮片样品指纹图谱与对照指纹图谱的相似度在0.380~0.992范围内,说明不同厂家的酒萸肉饮片质量存在较大差异,其中编号为S1、S6、S7和S13的样品指纹图谱与其他批次相比,相似度值明显较低,说明以上4批酒萸肉饮片的化学成分与其他批次存在较大差异,以上4批饮片分别来自厂家1、厂家4和厂家3。此外,同一家公司生产的酒萸肉饮片在指纹图谱相似度上也存在较大的差异,如编号S3、S5和S13的样品,可能是因为同一厂家所采购的药材原料质量不一,也可能是由于同一厂家的炮制工艺不稳定,虽然都来自厂家3,但S3与S5的相似度为0.818,S5和S13的相似度为0.209,S3和S13的相似度为0.570,3批样品的指纹图谱相似度均有较大差异。编号S4、S7和S14的样品,虽然都来自厂家4,但S4与S7的相似度只有0.345,S4与S14的相似度为0.937,S7与S14的相似度只有0.178,说明S7与S4、S14差异较大。
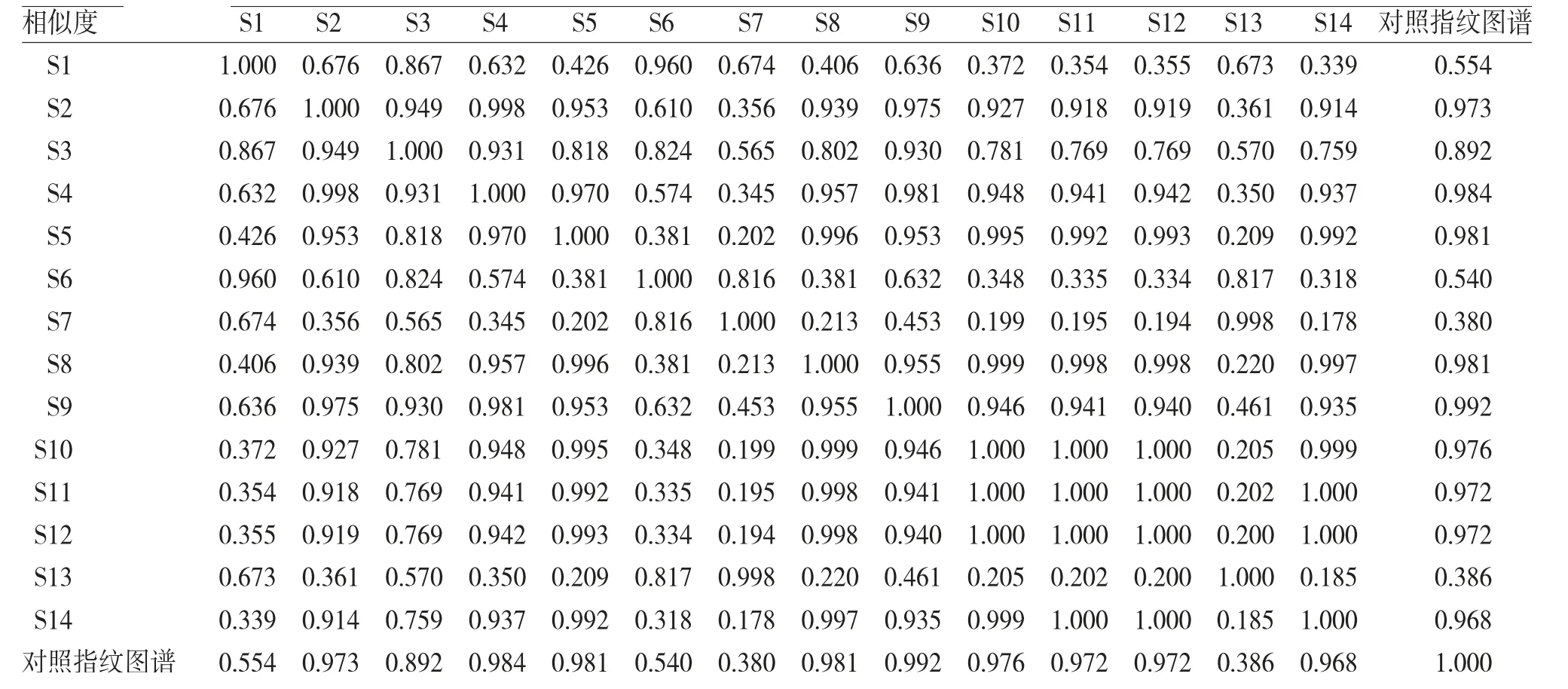
表2 14批酒萸肉饮片指纹图谱相似度评价表
2.1.7 共有峰的指认 查阅相关文献,通过与对照品保留时间进行比对,结并合紫外吸收光谱图,确定峰1为没食子酸、峰2为5-羟甲基糠醛、峰5为莫诺苷、峰6为马钱苷。(见图4)
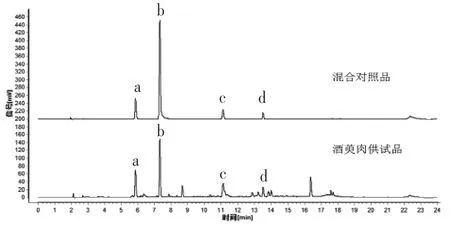
图4 指纹图谱共有峰的指认
2.1.8 聚类分析(CA)采用SPSS 25.0统计学软件以9个共有指纹峰的峰面积积分为变量,采用组间平均数联接法对14批样品进行系统聚类分析,结果见图5。14批酒萸肉饮片样品按相似度分成3类,其中S11、S12、S8、S9、S10和S14为Ⅰ类,S2、S3、S4和S5为Ⅱ类,S1、S6、S13和S7为Ⅲ类,聚类分析的结果表明批次间有较大差异,与指纹图谱相似度计算结果类似。
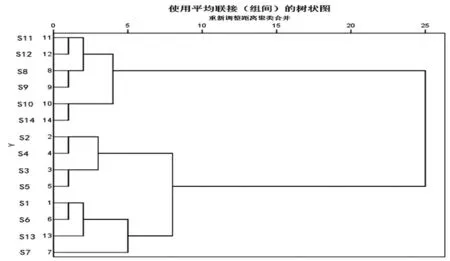
图5 14批酒萸肉饮片聚类树状图
2.1.9 主成分分析(PCA) 采用SPSS 25.0软件以9个共有指纹峰的峰面积为变量进行主成分分析,以特征根>1为判定标准,共提取4个成分,累积贡献率达到91.8%,结果见表3,成分载荷矩阵的数值及符号代表变量在主成分当中的载荷,载荷越大,表明该化合物在药材主成分分析中作用越大[11],结果见表4,其中峰4、没食子酸、峰3对主成分1的贡献最大,峰8、峰9和马钱苷对主成分2的贡献最大,5-羟甲基糠醛、莫诺苷和峰7对主成分3的贡献最大,莫诺苷对主成分4的贡献最大。前3个成分累积贡献率约80%,表明3个主成分能够反映酒萸肉饮片指纹图谱大部分信息,以前3个主成分绘制主成分3D得分图,见图6。其中S1、S7、S11和S12离群较远,因为S1和S7的主成分3得分值明显高于其他批次,S11和S12主成分2得分值为负数且明显低于其他批次。结合峰面积可知,S1样品峰7的峰面积,以及S7样品马钱苷的峰面积明显高于其他批次,而S11和S12样品峰8、峰9的峰面积明显小于其他批次。

表3 特征根
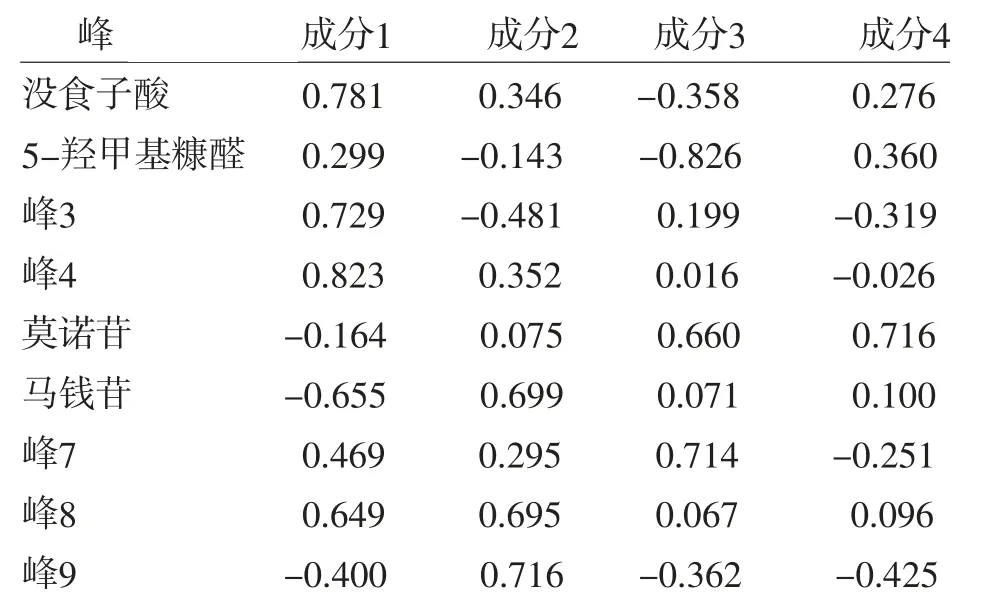
表4 主成分载荷矩阵
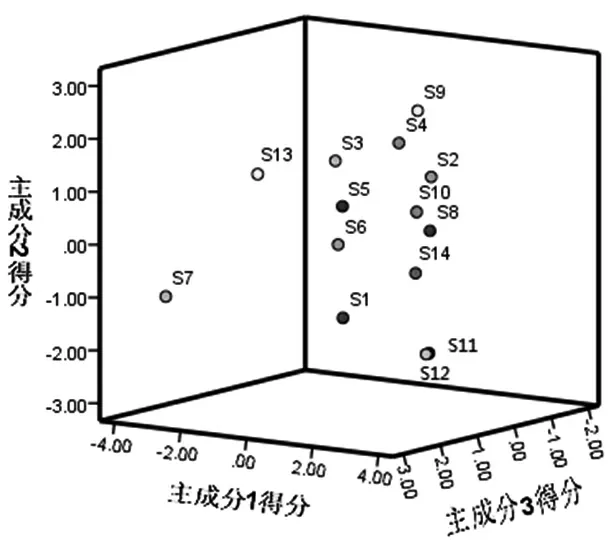
图6 主成分得分图
2.2 含量测定
2.2.1 方法学考察
2.2.1.1 线性关系考察 精密称定没食子酸3.145 mg、5-羟甲基糠醛13.855 mg、莫诺苷对照品24.150 mg、马钱苷对照品15.552 mg,置50 mL量瓶中,加50%甲醇至刻度,摇匀,即得每1 mL含没食子酸57.554 μg、5-羟甲基糠醛274.883 μg、莫诺苷465.129 μg、马钱苷307.930 μg混合对照品贮备液。精密吸取混合对照贮备液0.5 mL至100 mL量瓶中,再分别精密吸取混合对照贮备液0.5、2.0、3.0、5.0 mL至10 mL量瓶中,用50%甲醇稀释至刻度,摇匀,得混合对照品溶液,按“2.1.1”项下色谱方法依次进样1 μL,记录色谱峰面积。以对照品浓度为横坐标(x),峰面积为纵坐标(y),绘制标准曲线,4种成分的线性回归方程和线性范围见表5。
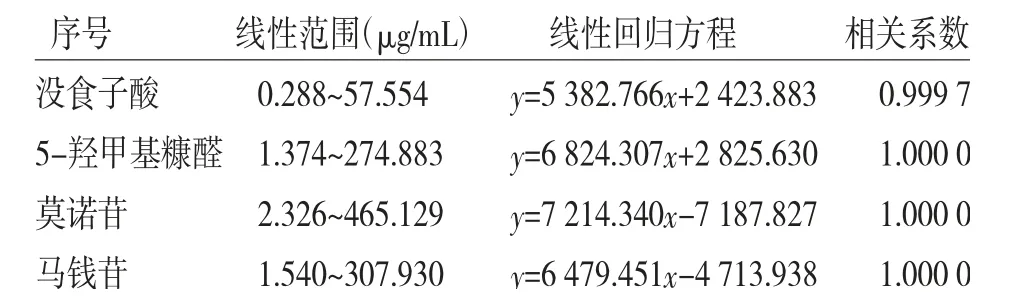
表5 4种成分的线性回归方程及线性范围
2.2.1.2 精密度试验 取酒萸肉饮片(编号:S2)供试品溶液,按“2.1.1”项下色谱条件重复进样6次,计算没食子酸峰面积RSD值为2.81%;5-羟甲基糠醛峰面积RSD值为1.51%;莫诺苷峰面积RSD值为0.72%;马钱苷峰面积RSD值为0.71%,表明该仪器精密度良好。
2.2.1.3 稳定性试验 取酒萸肉饮片(编号:S2)供试品溶液,分别在0、2、4、6、8、10、12、16、24、30 h,按“2.1.1”项下色谱条件进样测定,计算得到没食子酸峰面积的RSD值为2.55%;5-羟甲基糠醛峰面积RSD值为2.45%;莫诺苷峰面积RSD值为1.31%;马钱苷峰面积RSD值为1.27%,表明供试品溶液在30 h内稳定性良好。
2.2.1.4 重复性试验 取同一批酒萸肉饮片粉末(编号:S2),按“2.1.3”项下方法制备6份酒萸肉供试品溶液,按“2.1.1”项下色谱条件进样测定,计算没食子酸含量均值为0.180%,RSD值为0.54%;5-羟甲基糠醛含量均值为0.512%,RSD值为1.20%;莫诺苷含量均值为0.879%,RSD值为1.61%;马钱苷含量均值为0.650%,RSD值为0.49%,RSD值均小于3.00%,表明该方法重复性良好。
2.2.1.5 加样回收率试验 精密称取同一批酒萸肉饮片(编号:S2)供试品0.1 g,精密称定,平行样9份,按照样品中4种成分与对照品的含量比分别为1∶0.5、1∶1、1∶1.5加入没食子酸、5-羟甲基糠醛、莫诺苷、马钱苷对照品,每个比例平行3份,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进行含量测定,计算得到没食子酸平均加样回收率为101.16%,RSD为2.15%;5-羟甲基糠醛平均加样回收率为93.23%,RSD为1.08%;莫诺苷平均加样回收率为95.34%,RSD为1.46%;马钱苷平均加样回收率为102.68%,RSD为1.98%,表明该分析方法准确度良好,结果见表6。

表6 加样回收率试验结果
2.2.2 样品测定 取酒萸肉饮片粉末,按“2.1.3”项下供试品溶液制备方法制备酒萸肉供试品溶液,按“2.1.1”项下色谱条件进样测定,计算各批次酒萸肉饮片没食子酸、5-羟甲基糠醛、莫诺苷及马钱苷的含量,结果见表7。2020年版《中华人民共和国药典》酒萸肉项下规定,酒萸肉含莫诺苷(C17H26O11)和马钱苷(C17H26O10)的总量不得少于0.70%,14批酒萸肉饮片莫诺苷和马钱苷总量在1.09%~3.29%范围内,说明14批酒萸肉饮片均符合2020年版《中华人民共和国药典》的要求,其中编号S7和S13的样品,莫诺苷和马钱苷的总量分别是《中华人民共和国药典》的3倍和4.7倍,其余12批莫诺苷和马钱苷的总量差异不大。14批酒萸肉饮片,除编号为S8和S13的样品外,其余12批酒萸肉饮片没食子酸的含量差异并不大,但是5-羟甲基糠醛的含量,不同厂家生产的饮片却差异明显,最大值是最小值的130倍,且同一厂家生产的不同批次饮片5-羟甲基糠醛的含量也差异明显,如厂家1生产的编号为S1、S11和S12的饮片,5-羟甲基糠醛的含量分别为0.03%、0.93%和0.93%,含量相差31倍,厂家3生产的编号为S3、S5和S13的酒萸肉饮片,5-羟甲基糠醛的含量分别为0.24%、0.42%和0.01%,含量相差42倍。厂家4生产的编号为S4、S7和S14的饮片5-羟甲基糠醛的含量分别为0.56%、0.01%和1.30%,含量更是相差130倍。酒萸肉饮片5-羟甲基糖醛的含量差别大可能是因为所采购的药材原料质量不一,同时,酒萸肉的炮制中,需要对山萸肉药材进行一定时间的酒蒸,而5-羟甲基糠醛化学性质受长时间的加热影响,导致其含量的变化。因此,炮制工艺不稳定也会导致酒萸肉中5-羟甲基糖醛的含量差别。
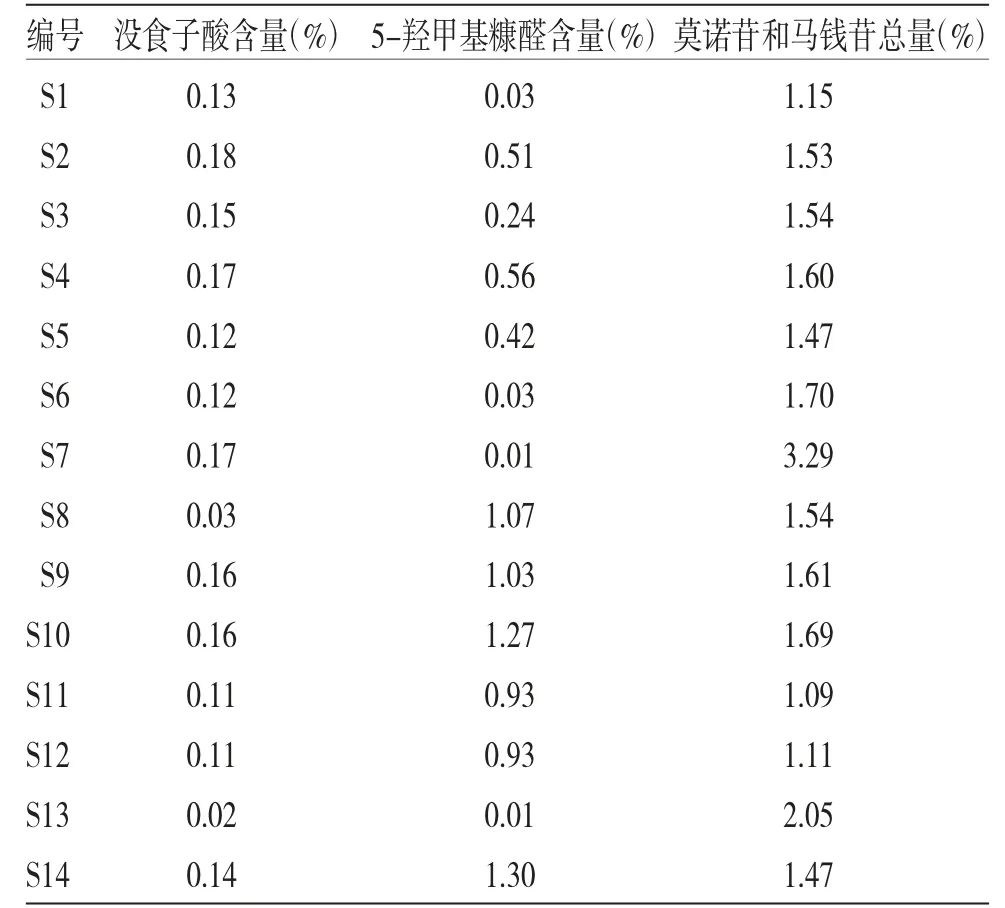
表7 14批酒萸肉样品含量测定结果
3 讨 论
3.1 色谱条件选择 本研究采用UPLC构建酒萸肉饮片的指纹图谱,并对多种成分含量同时测定。与传统的HPLC比较,UPLC分辨率高、分析能力强、分析时间短,同时减少了溶剂用量降低了分析成本[12]。分别进行了色谱柱、流动相系统、检测波长考察,结果显示采用Waters CORTECS T3色谱柱(2.1 mm×150 mm,1.6 μm),检测波长为260 nm,乙腈-0.2%磷酸溶液梯度洗脱时,整体基线平稳、各色谱峰分离效果良好且方法耐用性良好。
张振凌等[13]建立与比较了对不同方法制酒萸肉饮片高效液相指纹图谱,分析时间需要70 min,70 min后无特征峰出现。而笔者采用UPLC构建酒萸肉饮片的指纹图谱,分析时间需要24 min,24 min后无特征峰出现,这展现了UPLC分析能力强、分析时间短,同时减少了溶剂用量降低了分析成本的优势。这也是本文采用UPLC构建酒萸肉饮片的指纹图谱的优势。
3.2 供试品溶液制备方法考察 以没食子酸、5-羟甲基糠醛、莫诺苷和马钱苷的含量,以及各色谱峰“峰面积/称样量”为评价指标,考察不同浓度甲醇、乙醇的提取效果,结果发现50%甲醇作为提取溶剂时,峰面积响应值高,基线平稳,提取效率最高,且色谱峰信息丰富;另外,以50%甲醇为提取溶剂,考察了超声、加热回流对提取效率的影响,结果显示加热回流与超声处理提取效率无明显差别,因此选择操作更为简便的超声处理提取。同时,对样品提取时间进行考察,结果表明,超声提取30 min已能够完全提取。通过上述考察,最终确定最佳供试品溶液制备方法为:50%甲醇超声提取30 min,提取效率最佳。
3.3 指纹图谱、聚类分析和主成分分析14批酒萸肉饮片共确定9个共有指纹峰,与山茱萸对照药材中的9个指纹峰相对应,表明炮制过程并没有使指纹峰的数目明显增加或消失,指纹图谱的相似度评价结果显示14批饮片的质量存在较大的差异,反映了目前市售酒萸肉饮片质量的参差不齐。聚类分析将酒萸肉饮片分为3类,不同企业生产的饮片差异较大。
3.4 含量测定分析 没食子酸、5-羟甲基糠醛、莫诺苷和马钱苷均为山萸肉或酒萸肉的有效成分[14],研究结果显示,除个别批次样品中没食子酸含量及莫诺苷和马钱苷总量与其他批次差异较大外,其余样品均差别不大,但5-羟甲基糠醛的含量差异比较明显。5-羟甲基糠醛是由葡萄糖脱水产生的一种具有呋喃环结构的糠醛化合物,在许多中药加热炮制过程中均能产生或者含量增加,研究证实,5-羟甲基糠醛具有抗氧化、抗炎、改善学习记忆力和保护神经细胞等多种药理活性[15],但剂量过大也显示出急性毒性和肾毒性[16]。目前少量的5-羟甲基糠醛更多被当成食品添加剂使用,对人类健康的影响仍没有明确的定论,但是《中华人民共和国药典》从1985年版开始,对葡萄糖注射液中增加了5-羟甲基糠醛的限量检查,以防止临床上的过敏反应。5-羟甲基糠醛的含量高低与炮制过程中的加热温度、加热时间等因素密切相关,反映了酒萸肉炮制工艺的差异及炮制工艺是否稳定。从14批酒萸肉饮片5-羟甲基糠醛含量测定结果可以看出,不同厂家酒萸肉饮片的炮制工艺存在较大差异,且同一厂家其炮制工艺的稳定性也值得商榷。目前对于酒萸肉饮片炮制工艺的研究文献报道较多,但对最佳的工艺或者炮制的终点仍没有统一的定论,需要结合生物活性评价进行进一步的研究。
本研究采用UPLC指纹图谱结合多成分同时定量有效地分析了市售酒萸肉饮片的质量差异性,可为市售酒萸肉饮片的质量评价提供有益的参考。



