夏士涛,王培宇,张开创,魏 静
(黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
慢性硬膜下血肿(chronic subdural hematomas,CSDH)常见于老年群体。随着老龄化社会结构的发展,接受介入手术的老年患者日益增加,抗凝药物、抗血小板药物的广泛应用导致CSDH发病率逐年上升[1]。近年来研究发现[2-3],CSDH血肿吸收速度与血肿包膜血管新生具有紧密联系,而血管内皮细胞生长因子(vascularendoth elial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)等血管生成相关因子与该病预后同样密切相关。海风藤是胡椒科植物风藤Piper kadsura(Choisy)Ohwi的干燥藤茎,具有通经络、祛风湿的功效,主要用于风寒湿痹、筋脉拘挛、屈伸不利的治疗。有报道显示[4],海风藤提取物可通过减轻氧化应激、减少神经元凋亡改善脑缺血再灌注损伤大鼠脑损伤,提示其具有神经功能保护作用。但目前有关海风藤醇提取物对CSDH治疗作用的研究尚少。本研究通过建立CSDH大鼠模型,观察海风藤醇提取物对血管新生及VEGF、bFGF表达的影响,以期为其临床应用提供实验依据。
1 材料与方法
1.1 实验动物 12周龄SPF级雄性Wistar大鼠60只,体质量(370±20)g,购自北京百奥赛图基因生物技术有限公司,动物生产许可证号:SCXK(京)2020-0007。所有大鼠健康状态良好,实验前于动物房适应性饲养7 d,温度(24±1)℃,相对湿度(55±5)%,12 h/12 h明暗交替。本研究经实验动物管理委员会批准。
1.2 药物与试剂 海风藤醇提取物(批号:1073-06-9,纯度>98%)购自西安青芷生物技术有限公司,使用前与DMSO混合,配制成质量浓度为1、5、10 μg/mL的溶液;免疫组织化学染色试剂盒(上海邦景实业有限公司,批号:BJ-15041);HE染色试剂盒(北京百奥莱博科技有限公司,批号:ZN1970);兔抗大鼠CD31一抗(批号:ab28364)、兔抗大鼠VEGF一抗(批号:ab32152)、兔抗大鼠bFGF一抗(批号:ab208687)均购自美国Abcam公司。
1.3 主要仪器 ALC-H型大鼠电动脑立体定向仪(上海奥尔科特生物科技有限公司);微量注射泵(淮北软隆生物科技有限公司);MacroMR型小动物核磁共振(magnetic resonance imaging,MRI)成像仪(苏州纽迈分析仪器股份有限公司);H7500型电子显微镜(日本株式会社日立制作所);iBright Imager型凝胶成像分析系统(美国Thermo Fisher Scientific公司)。
1.4 造模与分组[5]大鼠适应性喂养7 d后开始建模。腹腔注射戊巴比妥钠麻醉大鼠,以立体定向仪固定于操作台,头顶部正中垂直切口,长度5 mm,采用楔形高速钻头在矢状缝及冠状缝左侧3 mm位置钻一个直径为0.9 mm的骨窗。显微镜下采用1 mL空针针尖将尚未完全磨开的硬脑膜分离。采用无菌注射器采集大鼠尾静脉静脉血600 μL,调整立体定向仪使注射器前端锥形开口在下降时可恰好嵌顿于骨窗,启动微量注射泵,以30 μL/min的速度缓慢向硬膜下隙注射非抗凝自体血液300 μL,全部注入硬膜下腔后,调整速度为10 μL/min注射10 min,防止迅速注血引发颅内压急剧升高或急性脑损伤,两个阶段注血共计400 μL。血凝后将注血针拔除,缝合切口,常规消毒。建模成功标准:建模后3、10、17、24 d采用3.0 T MRI扫描检测大鼠头部,如首次注血后第3天急性期血肿在T2WI序列图像上呈现为位于额顶颞叶及硬脑膜之间的椭圆形高信号影像,且后续扫描无严重挫裂伤、血肿突破、重度脑水肿表示建模成功。10只大鼠仅开骨窗、缝合,作为假手术组。50只大鼠建立CSDH模型,3只死亡,40只建模成功,将建模成功大鼠随机分为模型组、低剂量组、中剂量组、高剂量组,每组10只。
1.5 实验给药 建模后24 d确认建模成功后开始给药。低、中、高剂量组大鼠分别按照1 mL/100 g腹腔注射质量浓度为1、5、10 μg/mL的海风藤醇提取物DMSO溶液,假手术组、模型组大鼠均按照1mL/100 g腹腔注射DMSO溶液。1次/d,连续给药14d。
1.6 观察指标
1.6.1 硬膜下血肿体积 末次给药后次日,采用3.0 T MRI扫描检测各组大鼠头部,戊巴比妥钠腹腔注射麻醉大鼠,将其置于MRI扫描专用线圈中,设置为T2WI序列进行冠状位扫描,层厚:1 mm。选取血肿体积最大断层截面,测量血肿纵径、横径,记录血肿层面,计算血肿体积。
1.6.2 大鼠神经功能评价 末次给药后次日,采用Zea Longa评分法评价大鼠神经功能[6]。0分:无神经功能缺损;1分:对侧前爪不能完全伸张;2分:向对侧转圈行走;3分:向对侧行走倾倒;4分:意识模糊,难以站立爬行。分数越高,提示大鼠神经功能损伤越严重。
1.6.3 组织取材 MRI扫描及大鼠神经功能评价完成后,脱颈处死大鼠,剥离大鼠血肿外膜,分为两份,一份用4%多聚甲醛固定,病理切片机切成4 μm厚度切片,用于免疫组化染色及HE染色,一份保存于液氮中用于Western blotting检测。
1.6.4 硬膜新生血管密度 取硬膜组织切片,脱蜡后PBS冲洗,3%过氧化氢孵育15 min,PBS浸泡30 min。滴加枸橼酸盐抗原修复液,微波后冷却至40 ℃,蒸馏水冲洗。滴加山羊血清室温下封闭15 min,弃血清。滴加兔抗大鼠CD31一抗(1∶800),湿盒中4 ℃过夜,PBS冲洗。山羊抗兔IgG二抗(1∶2 000),37 ℃孵育15 min,PBS冲洗。DAB显色,自来水冲洗,苏木精复染,常规脱水,中性树胶封片。显微镜下观察,随机选取5个不相邻视野,计算新生血管密度。
1.6.5 硬膜组织病理变化 取硬膜组织切片常规脱蜡,冲洗1 min,苏木精染液染色5 min,冲洗,滴入1%盐酸酒精,冲洗2 s,促蓝液反蓝,冲洗15 s,1%伊红染液染色30 s,自来水冲洗,使用梯度乙醇脱水,二甲苯透明2次,每次3 s,中性树胶封固,显微镜下观察病理变化。
1.6.6 硬膜组织中VEGF、bFGF蛋白表达水平 取液氮保存的硬膜组织,RIPA裂解液裂解,BCA试剂盒定量蛋白浓度。取30 μg待测样本上样,沸水浴5 min,离心取上清,恒压下经10%SDS聚丙烯酰氨凝胶电泳后湿转至膜,室温下封闭液封闭2 h,加入兔抗大鼠VEGF、bFGF一抗(1∶500),4 ℃摇床孵育过夜,洗涤,加入山羊抗兔二抗(1∶2 000),室温孵育1 h,暗室中显影、定影,凝胶成像系统扫描,目的蛋白表达量以其条带灰度值/内参GAPDH条带灰度值表示。
1.7 统计学方法 采用SPSS 21.0软件分析数据,计量资料以“均数±标准差”()表示,多样本比较采用单因素方差分析,两两样本比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能评分比较 假手术组大鼠均无神经功能缺损;与模型组比较,低剂量组、中剂量组、高剂量组大鼠神经功能评分均明显降低(P<0.05),且具有剂量依赖性;与低剂量组比较,中剂量组大鼠神经功能评分明显降低(P<0.05);与中剂量组比较,高剂量组大鼠神经功能评分明显降低(P<0.05)。(见图1)

图1 各组大鼠神经功能评分比较(,n=10)
2.2 各组大鼠硬膜下血肿体积比较 与模型组比较,低剂量组、中剂量组和高剂量组大鼠硬膜下血肿体积明显缩小(P<0.05),且呈剂量依赖性;与低剂量组比较,中剂量组大鼠硬膜下血肿体积明显缩小(P<0.05);与中剂量组比较,高剂量组大鼠硬膜下血肿体积明显缩小(P<0.05)。(见图2)
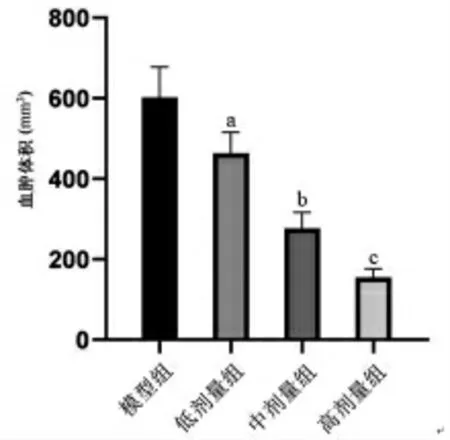
图2 各组大鼠硬膜下血肿体积比较(,n=10)
2.3 各组大鼠新生血管密度比较 采用免疫组织化学染色检测血管标志蛋白CD31蛋白表达,CD31蛋白标记的新生血管内皮细胞阳性染色为棕黄色或棕褐色。结果显示与假手术组比较,模型组大鼠CD31蛋白表达增加;与模型组比较,低剂量组大鼠CD31蛋白表达减少;与低剂量组比较,中剂量组大鼠CD31蛋白表达减少;与中剂量组比较,高剂量组大鼠CD31蛋白表达减少。(见图3)

图3 各组大鼠硬膜新生血管密度比较(免疫组化,×200,标尺50 μm)
与假手术组比较,模型组大鼠血肿外膜新生血管密度明显升高(P<0.05);与模型组比较,低剂量组大鼠血肿外膜新生血管密度明显降低(P<0.05);与低剂量组比较,中剂量组大鼠血肿外膜新生血管密度明显降低(P<0.05);与中剂量组比较,高剂量组大鼠血肿外膜新生血管密度明显降低(P<0.05)。(见表1)
表1 各组大鼠新生血管密度比较()

表1 各组大鼠新生血管密度比较()
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05;与中剂量组比较,dP<0.05
2.4 各组大鼠硬膜组织病理变化情况 假手术组大鼠硬膜组织染色较浅,未观察到血肿及炎症反应;模型组大鼠硬膜组织颜色深暗,可观察到大量血肿,以及炎症细胞浸润、组织增生;低、中剂量组大鼠硬膜组织血肿开始吸收,血肿与脑皮层间逐渐形成包膜,血肿内可观察到机化组织;高剂量组大鼠硬膜组织血肿被大部分吸收,内膜与外膜间仅可观察到薄层血肿,血肿内可观察到机化组织。(见图4)

图4 各组大鼠硬膜组织病理变化情况(HE,×100,标尺100 μm)
2.5 各组大鼠硬膜组织中VEGF、bFGF蛋白表达水平比较 与假手术组比较,模型组大鼠硬膜组织中VEGF、bFGF蛋白相对表达量明显升高(P<0.05);与模型组比较,低剂量组大鼠硬膜组织中VEGF、bFGF蛋白相对表达量明显降低(P<0.05);与低剂量组比较,中剂量组大鼠硬膜组织中VEGF、bFGF蛋白相对表达量明显降低(P<0.05);与中剂量组比较,高剂量组大鼠硬膜组织中VEGF、bFGF蛋白相对表达量明显降低(P<0.05)。(见图5~6)
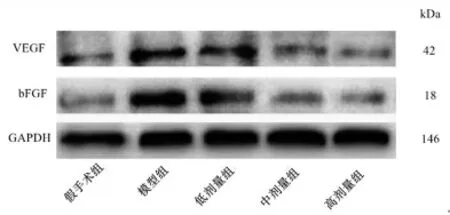
图5 各组大鼠硬膜组织中VEGF、bFGF 蛋白表达Western blotting 图

图6 各组大鼠硬膜组织中VEGF、bFGF 蛋白相对表达量比较(,n=10)
3 讨论
CSDH是一种常见的神经外科疾病,血肿位于硬膜下腔中,占位血肿通过压迫脑组织导致其缺血、缺氧,并改变血脑屏障通透性从而引发一系列继发性损害[7]。研究显示[8-9],高龄,头部外伤,酗酒,抗凝或抗血小板治疗,颅内病损,以及颅内压持续降低等均是CSDH发生的常见危险因素。目前,钻孔引流术是临床治疗CSDH的主要方式,但因该病发病位置特殊且好发于老年群体,整体疗效并不理想,且术后复发率较高[10]。CSDH在中医学中属“头痛”范畴,头部创伤伤及脑络,瘀血内滞、阻滞脑络是其主要病因,故治疗应以化瘀通络为主[11]。海风藤是常用的通络药物,其活性单体化合物在CSDH中的治疗意义及机制备受关注。
血肿包膜血管新生在CSDH发展过程中具有重要作用[12]。CSDH包膜质地厚,纤维蛋白溶酶原与新生毛细血管丰富,但因新生血管内皮细胞结构不完整、基膜不成熟,可反复生成与出血,并大多是畸形血管,通透性强,可刺激硬膜边缘细胞持续增生并不断形成新膜,导致血肿进一步增大[13-15]。本研究结果显示,与模型组比较,低、中、高剂量组大鼠神经功能评分、血肿外膜新生血管密度均明显降低,血肿体积明显缩小,且呈剂量依赖性,提示海风藤醇提取物可促进大鼠神经功能的改善及血肿吸收,并抑制血管新生。海风藤具有抗炎、抗氧化、镇痛、抑制血小板活化、保护局部缺血组织等药理作用。从海风藤中分离的醇提取物主要包括黄酮类、生物碱、木质素类、环氧化合物、挥发油等,血小板活性因子拮抗作用极强,而血小板活性因子是CSDH脑损伤进程中关键的病理介质,推测海风藤醇提取物可有效阻止CSDH病理损伤过程,促进血肿吸收。
VEGF是目前已知的最为强效的血管生成促进因子,bFGF是最为有效的血管生成因子,两者具有明显的促进血管内皮细胞增殖与管腔形成作用,明显高表达于CSDH血肿腔及硬膜中,并参与血肿转归,可作为反映机体血管新生及修复功能的敏感指标[16]。有报道显示[17],CSDH血肿壁中高VEGF表达的患者,面临着更高的钻孔引流术后复发风险,推测原因为其异常升高可扰乱血肿壁功能紊乱并致其血管增生,且明显增加微血管通透性。本研究结果显示,与模型组比较,低、中、高剂量组大鼠硬膜组织中VEGF、bFGF蛋白相对表达量明显降低,且呈剂量依赖性,提示海风藤醇提取物对CSDH的治疗作用可能通过抑制VEGF、bFGF表达来实现。
综上所述,海风藤醇提取物可改善CSDH大鼠神经功能,抑制其血管新生,且表现为剂量依赖性,推测其作用机制与抑制硬膜VEGF、bFGF表达有关。海风藤醇提取物对CSDH的作用靶点是否存在多途径尚未明确,仍需进一步研究。此外,本研究未使用VEGF、bFGF激活剂对机制进行深入探索,将在后续实验中展开。



