杨晓晓,柳毅浩,王成伟,牛浩一,王金武,2
(1.上海交通大学医学院附属第九人民医院,上海 200011;2.上海交通大学生物医学工程学院,上海 200030)
皮肤覆盖全身,是保护各种组织和器官免受物理、机械、化学和病原微生物侵害的天然屏障[1-2]。正常情况下,皮肤表面呈酸性,pH值约为4~6。伤口微环境的pH值反映和影响了伤口愈合过程中许多基本的生理和生化过程,是伤口护理中治疗干预的一个重要参数[3]。慢性、感染性伤口微环境pH值呈碱性,pH值高于7.3[4]。已有研究利用慢性伤口pH值变化的特点制备pH值响应性药物释放敷料[5-6]。军事冲突导致的创伤感染率高达27%[7],包括皮肤及深部组织的感染;其中开放型骨折的并发感染率约为7.6%[8]。伤口感染常导致脓毒血症、伤口慢性愈合等并发症,加重患者的痛苦,降低患者的生活质量,且增加其他并发症的风险,给患者和医疗系统带来极大的卫生与经济负担。同时,人口老龄化的加剧及糖尿病等慢性疾病的增多使医疗卫生系统面临着巨大的考验,急剧增加治疗负担,对公共卫生持续造成重大威胁。笔者采用抗菌肽ε-L-聚赖氨酸(ε-L-polylysine,PLL)与聚乙二醇二缩水甘油醚(polyethylene glycol diglycidyl ether,PEGDGE)通过共价键交联制成PEGDGE/PLL复合物(PP)的凝胶颗粒,再根据酚红(phenol red,PR)酸碱指示剂的特点,通过静电吸附,与正电性PP形成PRPP复合物凝胶颗粒,通过PRPP复合物的颜色变化直观地监测伤口愈合过程。同时,PRPP复合物与中药活性成分配伍组方,协同发挥抗菌抗炎活性。本研究为感染伤口的治疗及伤口愈合过程监测的医产品的开发提供了新思路和实验数据。
1 实验材料
1.1 药物与试剂ε-L-聚赖氨酸(国药集团化学试剂有限公司,分子量5 000,纯度95%);聚乙二醇二缩水甘油醚(国药集团化学试剂有限公司,分子量6 000,纯度99%);绿原酸(中国食品药品检定研究院,批号:110753-201415,含量≥98%);黄连碱(中国食品药品检定研究院,批号:110713-201206,含量≥98%);黄芩苷(中国食品药品检定研究院,批号:110715-200514,含量≥98%);去离子水(实验室自制)。
1.2 主要仪器SW-CJ-1FD型超净工作台(苏州艾克林净化设备有限公司);3111型二氧化碳培养箱(赛默飞世尔科技有限公司);TS2型倒置显微镜(上海衡浩仪器有限公司);AG135型分析天平[赛多利斯科学仪器(北京)公司];XKA-2200型低度冷冻离心机(湖南湘仪实验室仪器开发有限公司);HH-600型数显恒温水浴锅(上海齐欣科学仪器有限公司);800TS型酶标仪(Bio Tek公司);S400-B型pH计(梅特勒-托利多公司);Scientz-10ND型冷冻干燥机(宁波新芝生物科技股份有限公司);Tensor 27和MIRacle ATR FT-IR型光谱仪(Bruker Optics公司);Cary100紫外-可见分光光度计(美国VARIAN公司)。
1.3 菌种及细胞株金黄色葡萄球菌(Staphylococcus aureus,S.aurues,ATCC 25923,南京便诊生物科技有限公司);人脐静脉内皮细胞(HUVEC-CS,中国科学院昆明动物研究所);小鼠成纤维细胞(L929,武汉普诺赛生命科技有限公司)。
2 方 法
2.1 PRPP复合物凝胶颗粒的制备本实验通过温和的开环反应制备PP高吸水性树脂。首先将分子量〈5 000的PLL透析去除杂质和分子量小于3 500的短链分子,然后冻干、收集透析后的PLL,使其溶于去离子水配制50%(m/V)PLL溶液,调节pH值至10.0。分别将0.4、0.6 mL PEGDGE加入2 mL上述PLL溶液中,振荡器震荡10 s确保均匀混合后在静置于60℃水浴锅中。反应2 h后,收集PP,在大量去离子水中浸泡24 h,且每8 h更换一次去离子水,以去除未交联的PLL和PEGDGE,将上述制备的样品冷冻干燥,备用,计算凝胶分数(Gelcontent,G),公式如下:

其中,m1为PLL质量(g),m2为PEGDGE质量(g),m3为PP质量(g)。
随后于室温下分别浸泡于质量浓度为1 mg/mL的PR溶液中静置2 h以制备PRPP。大量去离子水洗涤PRPP样品5次后,继续浸泡于去离子水中24 h,冷冻干燥并收集样品备用。
2.2 PRPP复合物凝胶颗粒的性能评估
2.2.1 红外光谱检测 采用傅里叶变换红外光谱(FTIR)检测,通过特征峰观察,分析PRPP样品中无PEGDGE残留,评价检测PLL和PEGDGE的交联情况。
2.2.2 溶胀率测定 参考YUAN H C等[9]所报道的方法对常温下PRPP在去离子水和PBS中的溶胀性能进行了评估。在微量离心管中预先称重约10 mg样品,空离心管质量记为m0,加入样品后离心管总质量记为md,加入足量去离子水和pH值为7.4的PBS,并于室温静置1 h。随后,小心吸出残留的去离子水或PBS。最后,测量溶胀样品与离心管的总质量并记录为mw。计算溶胀率(Sw),公式如下:

其中,m0为离心管质量(g),md为离心管与初始样品总质量(g),mw为离心管与溶胀样品总质量(g)。
2.2.3 PRPP显色反应 依次配制pH值分别5、6、7、8和9的PBS缓冲液1 mL,分别称取1 mg PRPP放入缓冲液中,观察不同pH值下PRPP颜色变化情况。
2.2.4 生物相容性 为了评估PRPP对细胞活力的影响,本研究使用HUVEC-CS和L929细胞作为模型细胞进行CCK-8测试。该实验通过使用材料浸提液与未接触材料的DMEM完全培养基分别培养细胞,比较各组材料是否具有细胞毒性。首先,将2 mL含10%胎牛血清的DMEM完全培养基与10 mg样品混合,37℃静置24 h获得浸提液。在96孔板每孔中加入含8 000个HUVEC或L929的细胞悬液100 μL,于37℃,5% CO2培养箱中培养12 h。随后,将普通DMEM培养基替换为浸提液,对照组仅用DMEM完全培养基培养。在设定的时间点12、24和48 h通过CCK-8测试评估细胞活力,每组重复测试4次。
2.3 绿原酸与PRPP配伍体外抗菌活性考察体外抗菌性能试验以S.aurues作为模型细菌。将S.aurues接种到新鲜的MH肉汤中,37℃恒温摇床孵育6~8 h后,使用分光光度计在625 nm处计数细菌悬液,并稀释至最终浓度约为1×107CUF/mL。随后,将50 μL PBS或质量浓度为2、4和8 mg/mL的绿原酸PBS溶液与50 μL菌液混合后,滴加在48孔板中或预先紫外灭菌的各组样品表面,每组样品10 mg。于37℃,湿度90%的培养箱中共同孵育2 h后每组加入0.9 mL无菌PBS,在超声清洗仪中震荡10 min使细菌重悬于PBS中,并以无菌PBS梯度稀释上述重悬菌液,取100 μL涂布于MH琼脂平板上培养8~24 h后计数细菌菌落。每组重复3次,计算抗菌率(antibacterial rate,AR)。

其中,Cr、Cs分别代表空白对照组菌落计数和样品组菌落计数。
3 结 果
3.1 PRPP复合物凝胶颗粒的制备PRPP复合物凝胶颗粒制备结果见表1。随着PEGDGE的增加,PRPP复合物凝胶颗粒的凝胶分数增加,说明随着PEGDGE的增加,其交联程度同样增加,故得到的PRPP复合物凝胶重量也上升;同时可以发现不同比例PEGDGE所制备的PRPP复合物凝胶均能很好的吸附PR。

表1 PRPP样品制备
3.2 PRPP复合物凝胶颗粒的性能评估结果
3.2.1 红外光谱分析PRPP凝胶的FT-IR谱图见图1。在C-O特征峰1100 cm-1处,PRPP1-3透过率依次减小,提示随着PEGDGE比例增加,来源于PEG的醚基团增加,说明其交联程度随PEGDGE的增加而增加。1 540 cm-1与1 650 cm-1处为PPL的特征峰,此外,未观察到环氧环峰,反映PRPP样品中无PEGDGE残留[10]。
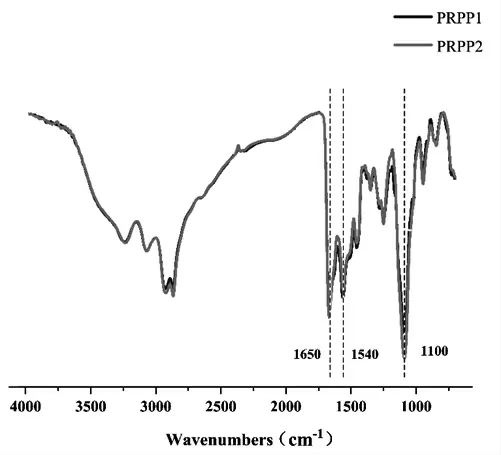
图1 PRPP水凝胶的FT-IR谱图
3.2.2 溶胀率水凝胶作为一种理想的创面敷料材料,其吸收和保存液体的能力是评价其效果的一个重要方面,凝胶的溶胀率是评价凝胶吸收液体能力的重要指标。PRPP在PBS与去离子水中的溶胀率见表2。结果显示,PRPP在PBS缓冲溶液的溶胀率为(1 224.6±74.0)%~(1 900.7±145.3)%,在去离子水中的溶胀率为(2 495.4±423.0)%~(4 597.0±278.1)%,说明PRPP凝胶具有很好的吸水性;PRPP凝胶在PBS缓冲溶液中的溶胀率小于在去离子水中的溶胀率,这是PBS缓冲溶液中多种离子对其造成的影响;此外,随着PEGDGE的增加,PRPP凝胶的溶胀率逐步减小,这是因为PEGDGE与PPL形成的氢键增加,导致其交联程度升高,从而使溶胀率下降。
表2 PRPP在PBS与去离子水中的溶胀率(±s,n=3)

表2 PRPP在PBS与去离子水中的溶胀率(±s,n=3)
溶剂 PRPP1 PRPP2 PBS 1 900.7±145.3 1 224.6±74.0去离子水 4 597.0±278.1 2 495.4±423.0
3.2.3 PRPP显色反应2种PRPP凝胶在不同pH值下的颜色变化如图2所示。不同pH值下PRPP凝胶颜色发生显着变化,当pH值=5或6时,PRPP凝胶显示黄色,当pH值=7时,PRPP凝胶显示橙色,当pH值=8或9时,PRPP凝胶显示紫红色。正常人体皮肤呈酸性(pH值=4~6),慢性、感染性伤口微环境pH值呈碱性(pH值〉7.3),PRPP凝胶的变色范围涵盖人体皮肤受伤前后的pH值变化,提示PRPP凝胶能很好地反映伤口的愈合情况。
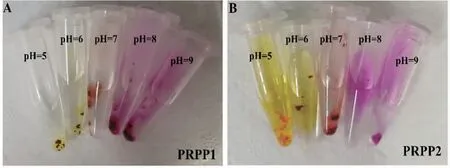
图2 PRPP显色反应
3.2.4 生物相容性2种PRPP凝胶的浸提液对HUVEC-CS和L929的细胞毒性见图3。结果显示,2种PRPP凝胶的浸提液在12、24和48 h内对HUVEC-CS和L929基本无细胞毒性,除PRPP1外,PRPP2对两种细胞的增殖还具有很好的促进作用,提示PRPP凝胶能促进伤口愈合,加速患者伤口恢复。

图3 PRPP浸提液对HUVEC-CS和L929的细胞毒性
3.3 中药活性成分配伍PRPP凝胶剂性状中药活性成分中,黄连碱和黄芩苷均具有一定的颜色,在不同pH值条件下,对PRPP凝胶的颜色变化有一定的干扰,使其颜色变化不显着,容易影响对伤口愈合程度的判断;此外,黄连碱和黄芩苷在水中的溶解度极低,在PRPP凝胶中有部分析出,导致凝胶整体浑浊,影响其外观和使用;而绿原酸本身无色,同时溶解度较好,对PRPP的性质并无影响,能很好地协调起效,故中药活性成分选取绿原酸。
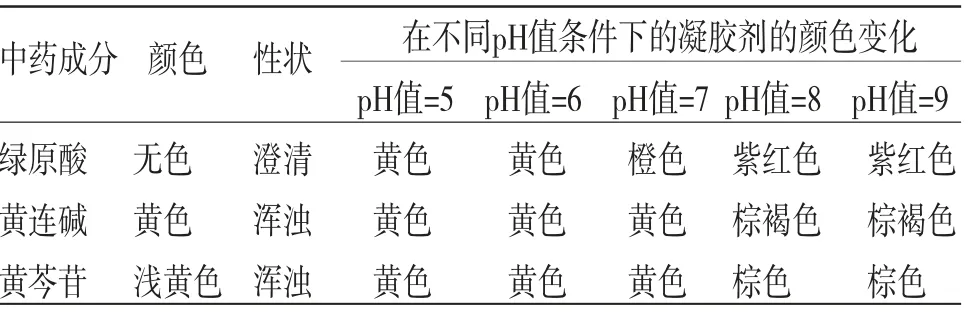
表3 中药活性成分配伍PRPP制得凝胶敷料的基本信息
3.4 体外抗菌活性绿原酸、PRPP1及PRPP2对S.aurues的抑菌率如图4所示。未联用PRPP时,1、2、4 mg/mL绿原酸溶液抗菌率分别为(88.7±4.0)%、(90.4±2.5)%、(93.6±1.4)%。PRPP的抗菌率均在99%以上,说明PRPP凝胶具有较好的抑菌效果。当PRPP2配伍2、4 mg/mL绿原酸时,抗菌率较单用PRPP2显着提高(P〈0.01)。说明中药活性成分配伍PRPP凝胶能更好地抑制伤口细菌生长,对伤口愈合有重要作用。
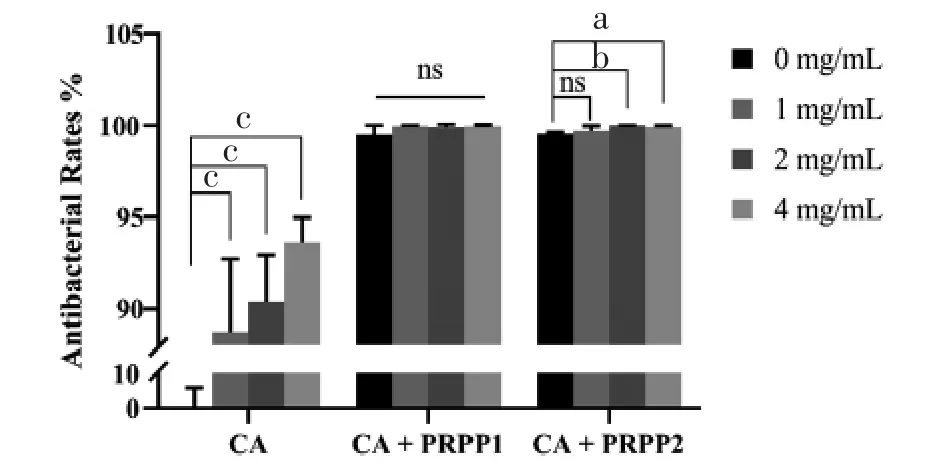
图4 PRPP联合绿原酸抗菌率(aP〈0.01,bP〈0.001,cP〈0.001)
4 讨 论
本研究合成了pH值指示比色PLL/PEGDGE水凝胶复合物,在此基础上,与中药活性物质配伍,开发一款用于创面抗菌消炎和监控伤口微环境pH值变化的凝胶敷料。其中,PLL是一种链霉菌合成的抗菌肽,可通过发酵工程大量制备,其抗菌谱广,对革兰氏阳性菌和革兰氏阴性菌均有杀伤作用[11]。同时,作为阳离子杀菌剂,PLL对细菌细胞膜和动物细胞膜具有高度的选择性,在质量浓度为2 mg/mL时对人真皮成纤维细胞无毒性[12],生物相容性佳。在2003年和2014年,国家食品药品监督管理局和国家卫生健康委员会已经批准使用PLL作为食品添加剂[13]。研究发现具有双环氧功能团的甘油醚类具有促进蛋白质交联的作用效果,双环氧交联剂能够通过与酶和载体的氨基等反应形成共价键,辅助酶固定化[14]。徐珊等[15]利用乙二醇缩水甘油醚进行包埋固定化脂肪酶,得到的固定化酶最适反应温度和最适pH值均有提高;钱明华等[16]利用PEGDGE交联大孔树脂HPD750固定化脂肪酶,在60℃保温7 h,固定化酶活力保留约72%,保存稳定性也表现优异。本实验利用PEGDGE通过共价键交联具有氨基的PLL,制成PEGDGE交联PLL的复合物PP凝胶颗粒,提高PLL的稳定性和疗效的发挥。PR是一种常用的酸碱指示剂,在临床上,常用于尿路感染、胃黏膜幽门螺杆菌感染、泪液分泌等相关检测[17-20],根据酚红在不同pH值条件下,颜色发生变化(pH值〈6.6显黄色,pH值为6.6~8.0显橙色,pH值为8.4显红色),在一定生理pH值条件下呈负电性等性质,通过静电吸附,将PR加入带正电荷的PP中,制成PRPP复合物,不仅可以发挥PLL的抗菌活性,也可有效固定PR。同时,酚红颜色变化与慢性或感染伤口的pH值范围相匹配,通过PRPP复合物的颜色变化可直观地监测伤口愈合过程,以及细菌感染程度和治疗效果。
本实验在制得PRPP复合物凝胶的基础上,优选广谱抗菌中药金银花、黄连和黄芩,以各味药材中主要活性成分绿原酸、黄连碱和黄芩苷为研究对象,与PRPP复合物制成凝胶敷料,最终确定无颜色、水溶性较好的绿原酸为中药活性成分添加。与阳离子杀菌剂的抗菌原理不同,绿原酸通过改变膜电位从而影响细菌能量代谢并使其累积大量活性氧[21-22],因此绿原酸有望协同阳离子杀菌剂提高抗菌效果。体外抑菌实验显示,加入绿原酸可显着提高PRPP复合物的抗菌活性,能更好地抑制伤口细菌感染,促进伤口愈合。本实验制备的PRPP复合物凝胶具有结构多孔,力学性能优良,溶胀率高、保湿性强等优点。此外,中药活性成分的添加,提高了凝胶的抑菌能力,有利于伤口恢复,该中药活性成分协同PRPP复合物制备的抗菌凝胶有望作为一种理想的医用水凝胶敷料,用于慢性伤口的护理,同时为感染伤口的治疗和伤口愈合过程监测医用产品的开发提供了新思路。



