唐芳婷,王 红,张 靓,唐 萍,李跃军
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学附属省直中医医院,湖南 株洲 412000)
原发性肝细胞性肝癌(以下简称“肝癌”)是指原发于肝细胞或肝内胆管的恶性肿瘤,是肝癌的主要组织学类型,占总病例数的90%左右[1-2]。肝癌是癌症死亡的第三大主要原因[3]。全球发病率最高的地区是亚洲和非洲,其中我国是肝病大国。肝癌起病隐匿,早期症状不明显,出现症状时往往已经属于中晚期。这个时期治疗方式主要以化疗栓塞、局部消融、放疗、全身化疗、靶向治疗、免疫治疗等为主[4]。单一的治疗方式疗效有限,且存在一定的局限性,如不良反应多、易产生耐药性、患者经济负担重等。须整合多学科优势,进一步提高临床疗效,延长患者的生存时间。中医药在控制瘤体、减少毒副反应、延缓复发和转移、改善临床症状、提高生存质量、延长生存时间等方面具有一定的优势。
肝癌的病机演变复杂,而肝失疏泄为病机演变的中心环节[4]。肝体阴而用阳,肝主疏泄,肝主藏血。肝疏泄正常,则血行畅达,而后能滋养脏腑[5]。然邪毒内侵,气机郁滞,气为血之帅,气郁则血行瘀滞。《丹溪心法》言“气血冲和,百病不生”。研究发现,郁金行气作用强,姜黄祛瘀力强,故两者合用可加强行气祛瘀作用[6]。研究[7-8]发现,现代医学联合中医药治疗肝癌具有更高的总生存率和无进展生存率,能提高患者的生活质量,减少肿瘤复发。中医药成方药物繁杂,目前研究难以清晰地阐述姜黄、郁金药对治疗肝癌的作用机制,而网络药理学可以从多成分、多靶点、多途径揭示药物协同作用的机制。本研究通过网络药理学和分子对接的方法,探讨姜黄、郁金治疗肝癌的作用靶点及机制,旨在为筛选治疗肝癌的药物提供理论依据。
1 材料与方法
1.1 姜黄和郁金有效成分筛选及靶点的获取 在中药系统药理学数据库与分析平台[9](TCMSP,http://tcmspw.com/tcmsp.php)分别以“姜黄”“郁金”为关键词进行检索,以生物利用度(OB)≥30%,类药性(DL)≥0.18为条件进行筛选[10]、整理,分别得到姜黄、郁金的有效成分和潜在靶点。将获得的共同潜在靶点名称在UniProt数据库[11](https://www.uniprot.org/)中限定条件“ Reviewed”“ Homo sapiens”,从而获得靶点的官方名称。
1.2 肝癌相关靶点的获取 基于GeneCards[12](https://www.genecards.org)、OMIM[13](https://omim.org/)、PharmGKB[14](https://www.pharmgkb.org/)、TTD[15](https://db.idrblab.net/ttd/)、DrugBank[16](https://www.drugbank.ca/)数据库,以“ Liver cancer”“ Hepatocellular carcinoma”为关键词进行检索,整理获得肝癌的靶点。
1.3 药对作用于肝癌的靶点筛选 将“1.2”中获得的对应靶点,去除重复靶点后,绘制韦恩图,得到姜黄、郁金药对干预肝癌的共同潜在靶点。
1.4 药对-疾病-有效成分-靶点中药复方调控网络构建 借助Cytoscape 3.8.0[17]软件进行可视化处理,构建药对-疾病-有效成分-靶点中药复方调控网络。
1.5 蛋白相互作用网络图(protein-protein interaction,PPI)构建及核心靶点筛选 借助STRING数据库[18](http://cn.string-db.org/)查看基因之间是否存在蛋白互作关系,设置物种选择为“ Homo sapiens”,交互分数>0.4,并去除单一蛋白,得到PPI网络图。在Cytoscape 3.8.0软件中使用CytoNCA插件Centralities原则里的6个维度(BC、CC、DC、EC、LAC、NC)进行两次打分过滤,将每个维度中大于中位值的核心靶点筛选出来。
1.6 药物有效成分与疾病交集基因功能及通路的富集分析 利用R语言(Version 4.0.2)中的“ Bioconduct”包对有效成分和疾病交集基因进行GO和KEGG富集分析[19-21],通过生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)3个模块对基因功能进行分析。过滤条件:P值、Q值均≤0.05,输出分析结果。
1.7 免疫细胞浸润丰度分析 基于TIMER公开数据库[22](https://cistrome.shinyapps.io/timer/)Gene模块,对姜黄、郁金核心靶点的表达水平和不同免疫细胞浸润丰度之间的相关性进行分析,并获取统计学P值。
1.8 核心靶点在肿瘤组织和癌旁组织的表达差异以及总生存期相关分析 基于GEPIA数据库[23]Expression DIY模块中的Boxplot及Survival模块中的Survival Plots,通过TCGA数据库中的肝癌样本的表达谱,分析姜黄、郁金核心靶点在肿瘤组织和癌旁组织的表达差异及生存曲线相关分析(P≤0.05)。
1.9 分子对接
1.9.1 配体的筛选 将获得的药物活性成分网络按照靶点数目活性成分最多的作为配体,从PubChem数据库[24](http://pubchem.ncbi.nlm.nih.gov/)获取配体对应的2D结构,使用ChemBio3D UItra 14.0软件转换为最小自由能的3D空间构象并进行结构优化。
1.9.2 靶点蛋白受体准备 选取PPI网络中核心靶点作为受体,先从Uniprot数据库中搜索靶点对应的蛋白名称,然后从蛋白质数据库(protein data bank,PDB)(http://www.rcsb.org/)中获取该蛋白的三维结构,导入PyMOL 2.5.2软件中去除水分子和小分子配体,使用AutoDockTools 1.5.7软件对受体进行加氢并确定活性口袋,最后将准备好的配体与受体导入PyMOL 2.5.2软件进行分子对接,获得相互作用图[25]。
2 结果
2.1 姜黄和郁金有效成分筛选结果 将姜黄和郁金这两味中药通过TCMSP数据库共初筛出18个有效成分,其中姜黄有效成分3个,郁金有效成分15个;再将有效成分潜在的作用靶点通过筛选和收集,其中姜黄潜在靶点356个,郁金潜在靶点1 370个,继续筛选得到姜黄有效成分对应的有效靶点41个,郁金有效成分对应的有效靶点78个。通过在Uniprot数据库中限定条件“ Reviewed”“ Homo sapiens”以获取最新的注释文件,然后将基因全称通过Strawberry Perl转换为基因简称,最终通过筛选去重后得到姜黄有效靶点35个,郁金有效靶点66个。根据OB值列举出姜黄和郁金的有效成分。(见表1)

表1 姜黄、郁金有效成分信息表
2.2 肝癌靶点的获取 根据“1.2”的研究方法去除重复靶点后共获得肝癌靶点14 187个,绘制韦恩图,不同的颜色代表不同的数据库,数字代表靶点数,重叠部分的数字代表各数据库间重复靶点。(见图1)
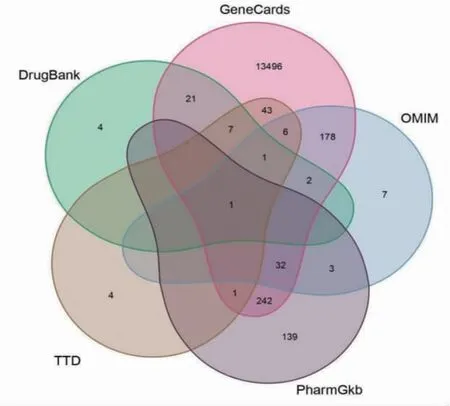
图1 各个数据库肝癌疾病靶点的交集韦恩图
2.3 药对-疾病作用靶点的交集 将药对-疾病的作用靶点用R 4.0.2软件选取交集并且绘制韦恩图,获得交集靶点70个,绿色圈代表姜黄、郁金的靶点,粉色圈代表肝癌的靶点,数字代表其对应部分的靶点数。(见图2)
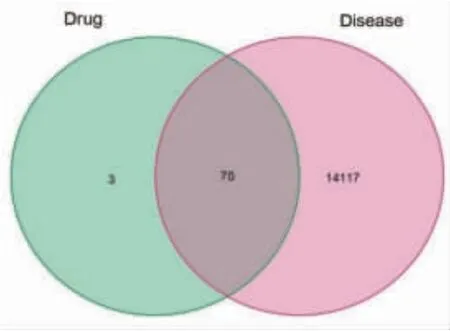
图2 药对靶点与疾病靶点的交集靶点韦恩图
2.4 药对-疾病-有效成分-靶点中药复方调控网络分析结果共有70个节点,98条边,6个药物有效成分,70个相关靶点。说明姜黄、郁金药对治疗肝癌是通过这6个有效成分和70个靶点发挥作用的。节点用3种不同颜色分别表示两种药物的有效成分和潜在靶点,蓝色节点代表靶点,粉色节点为姜黄,紫色节点为郁金。节点的大小代表与基因相连的成分的数目,节点越大表示与该基因相关的成分越多,按照度值排序,排前3的有效成分是柚皮素、β-谷甾醇、豆甾醇。(见图3)
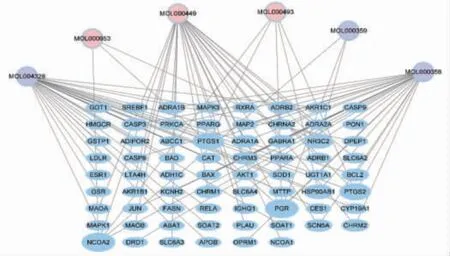
图3 姜黄、郁金有效成分与肝癌靶基因的网络关系图
2.5 PPI网络图构建及核心靶点筛选结果 图中显示的是蛋白互作关系,节点表示蛋白质,节点中间是已知的该蛋白的3D结构,连线表示功能关系,连线的粗细程度反映置信度高低。(见图4)
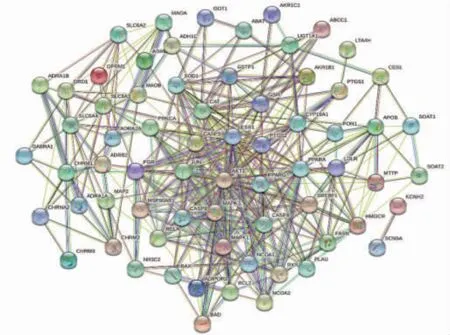
图4 姜黄、郁金与肝癌交集靶点PPI 网络核心图
将PPI网络图导入Cytoscape 3.8.0软件,按CytoNCA插件中的6个维度进行评分,经过中位值过滤后最终获得7个核心靶点,即ESR1、CASP3、PTGS2、JUN、AKT1、MAPK3、CAT。(见图5)
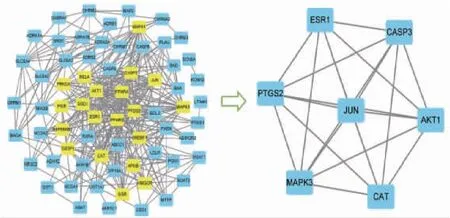
图5 PPI 核心靶点筛选流程
2.6 药物成分-疾病交集基因功能及通路的富集分析
2.6.1 GO富集分析结果 将姜黄、郁金治疗肝癌的作用靶点进行GO注释及KEGG通路富集分析。结果显示:GO注释中,与生物过程(biological process,BP)相关的条目共有1485个,与细胞组分(cellular component,CC)相关的条目共有87个,与分子功能(molecular function,MF)相关的条目共有133个。分别选取前10个富集最相关的条目生成条形图。结果表明姜黄、郁金药对治疗肝癌作用涉及多个生物途径和通路。其中BP主要涉及细胞对营养水平的反应、细胞对药物的反应、细胞对有机羟基化合物运输、细胞对类固醇激素的反应、细胞对膜电位调节、细胞对金属离子的响应等方面;CC主要涉及膜筏、膜微域、膜区等方面;MF主要涉及与酰胺结合、与药物结合、与磷酸酶结合、G蛋白-偶联胺受体活性等方面。图中横坐标表示富集数目,纵坐标表示富集的条目。(见图6)
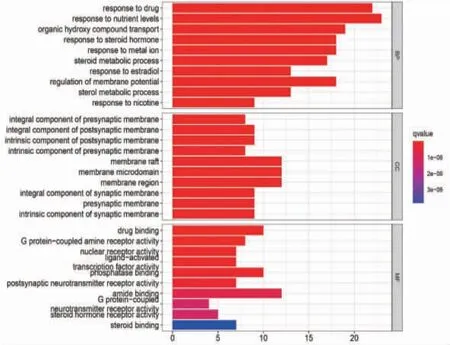
图6 姜黄、郁金治疗肝癌靶基因的GO 富集分析条形图
2.6.2 KEGG富集分析结果 如图所示,对70个核心靶点进行KEGG通路富集分析后(P≤0.05)的通路共有163个,排序筛选出前20条通路。横坐标代表富集到此通路的基因数目,颜色代表q值,从蓝色到红色,表示q从小到大,富集越来越显着。结果显示姜黄、郁金药对治疗肝癌的机制涉及雌激素信号通路、甲状腺激素信号通路、cAMP信号通路、VEGF信号通路、脂质和动脉粥样硬化、人类免疫缺陷病毒1型感染、乙型肝炎、丙型肝炎等。图中横坐标表示富集的数目,纵坐标表示富集的通路类别。(见图7)图中红色表示姜黄、郁金对肝癌作用的靶基因。(见图8)
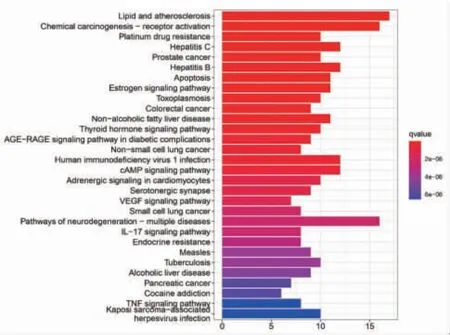
图7 姜黄、郁金治疗肝癌靶基因的KEGG 通路分析条形图
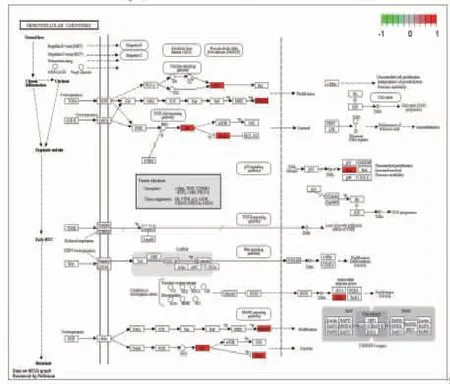
图8 肝癌信号转导通路
2.7 有效成分与关键靶点的分子对接 通过以上结果分析显示,柚皮素是预测靶点最多的有效成分,MAPK3、CASP3、JUN、AKT1、CAT、ESR1、PTGS2是PPI网络中的核心靶点,并且药对-疾病-有效成分-靶点中药复方调控网络分析结果显示柚皮素与MAPK3、CASP3、AKT1、CAT、ESR1、PTGS2存在相互作用关系。因此,为进一步研究其分子层面的相互作用位点,选取柚皮素与MAPK3、CASP3、AKT1、CAT、ESR1、PTGS2分别作为分子对接的配体和受体。结果显示,配体和受体对接结合能越低表示分子间结合越稳固,交互作用可能性越高。(见表2)分子对接结果显示,柚皮素能分别稳定地对接到MAPK3、CASP3、AKT1、CAT、ESR1、PTGS2的活性口袋中。(见图9)
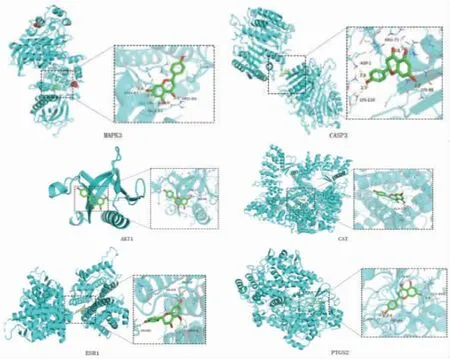
图9 柚皮素与关键靶点分子对接作用关系图

表2 柚皮素与关键靶点对接结合能 (kcal/moL)
2.8 关键靶点与免疫细胞浸润丰度相关性分析 本研究基于Timer数据库,通过对肝癌样本的表达谱进行分析,对关键靶点MAPK3、CASP3、AKT1、CAT、ESR1、PTGS2的表达水平和不同免疫细胞浸润丰度之间的相关性进行分析。结果表明,MAPK3、CASP3、AKT1、CAT、ESR1和PTGS2的表达水平至少与两种免疫细胞浸润丰度相关(P≤0.05),如MAPK3、CASP3、AKT1的表达水平与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、嗜中性粒细胞、树突状细胞等免疫浸润相关;PTGS2的表达水平与肝癌肿瘤纯度、B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、嗜中性粒细胞、树突状细胞等相关;CAT的表达水平与肝癌肿瘤纯度、B细胞、巨噬细胞、树突状细胞等相关;ESR1的表达水平与肝癌肿瘤纯度、B细胞、巨噬细胞等相关。(见图10)
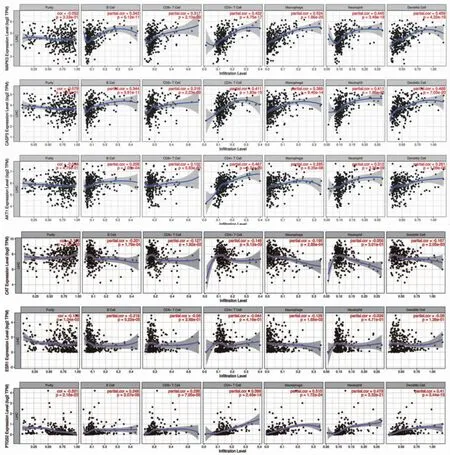
图10 关键靶点表达水平与免疫细胞浸润的相关性
2.9 核心靶点在肿瘤组织和癌旁组织的表达差异分析 基于GEPIA数据库,通过TCGA数据库中的肝癌样本的表达谱,对关键靶点在肿瘤组织和癌旁组织的表达差异分析。结果表明,MAPK3在肿瘤组织中的表达高于癌旁组织,提示该基因为癌基因;ESR1在肿瘤组织中的表达低于癌旁组织,提示该基因为抑癌基因。(见图11)

图11 关键靶点在肿瘤组织和癌旁组织中的表达差异
2.10 核心靶点与肝癌患者总生存期相关分析 基于GEPIA数据库,通过对TCGA数据库中的肝癌肿瘤样本的表达谱进行分析。结果显示,MAPK3、CAT、ESR1的表达与肝癌患者的总生存期相关(P≤0.05)。MAPK3表达水平高者,预后相对较差;CAT、ESR1表达水平高者,预后相对较好。结合差异表达结果提示MAPK3为癌基因,ESR1为抑癌基因,结果与上文相符。(见图12)
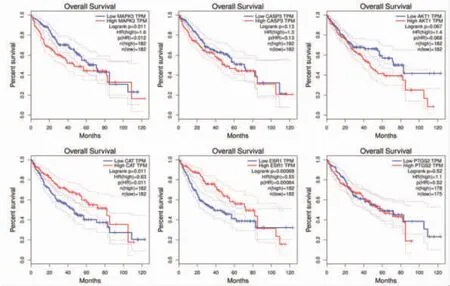
图12 关键靶点表达水平在肝癌患者总生存期中的预后价值
3 讨论
肝癌在中医学中属于“肝积”“症瘕”“积聚”“鼓胀”“黄疸”“痞气”“癖黄”等范畴,肝失疏泄为病机演变的中心环节。肝失疏泄则气血运行不畅,导致气滞、血瘀,从而出现胁痛、胁腹积块等症状[4]。姜黄、郁金均可化瘀血、消食积、去肿痛,且有行气止痛的功效。作为常用的活血化瘀药,姜黄、郁金多用于气血瘀滞所致症瘕痞块、胸胁刺痛、经闭腹痛等症状。现代药理研究[26-29]表明,姜黄、郁金不仅能抑制肿瘤生长,诱导细胞凋亡,缓解药物性肝损伤,还能通过作用于AKT1等关键靶点阻止肝纤维化,调控信号通路,逆转化疗耐药性,从而改善肝癌患者肝功能,保护肝脏,降低损害,提高免疫力。
本研究借助网络药理学相关研究方法,分析姜黄、郁金药对治疗肝癌作用靶点。结果显示柚皮素、β-谷甾醇、豆甾醇等是姜黄、郁金治疗肝癌的有效成分。研究[30]表明,柚皮素可上调肝癌细胞中的ULBP1、ULBP3等NKG2DL的表达,促进NK细胞的增殖,增加NK细胞对肝癌细胞的杀伤活性,从而达到抗肿瘤作用。β-谷甾醇可以通过PI3K/AKT途径下调细胞凋亡基因的表达,诱导细胞凋亡,并可以减缓酒精性肝损伤[31-32]。豆甾醇可以通过PI3K/AKT/mTOR和TGFβ/S信号通路促使细胞凋亡,抑制肝癌细胞的增殖和转移[33]。
富集分析结果提示,姜黄、郁金药对治疗肝癌通过雌激素信号通路、VEGF信号通路发挥抗肿瘤作用。研究[34-35]表明,雌激素通过新的雌激素受体Erα-36和雌激素相关受体γ(ERRγ)介导对肝癌的促进作用,而姜黄素可以通过下调雌激素生成代谢酶,从而改善体内高雌激素状态。研究[36]证实,VEGFR2/AKT/mTOR通路的失活可以抑制肿瘤的进展,减少肿瘤免疫逃逸。姜黄素可以抑制血管生成,降低VEGF的表达[37]。
基于TCGA临床病例的分析结果,姜黄、郁金抗肿瘤关键靶点MAPK3在肿瘤组织中的表达高于癌旁组织,ESR1在肿瘤组织中的表达低于癌旁组织。且MAPK3表达水平高者,生存预后相对较差;ESR1表达水平高者,生存预后相对较好。结果提示MAPK3为癌基因,ESR1为抑癌基因。且分子对接结果提示,姜黄、郁金有效成分柚皮素与相应靶点MAPK3和ESR1有结合潜能。研究结果表明,姜黄、郁金药对可通过调控相关靶点影响肿瘤患者预后,对相关临床研究分析具有潜在价值。
姜黄、郁金药对可能通过调控CASP3、AKT1和CAT等靶点发挥抗肿瘤作用。CASP3可抗细胞凋亡[38]并调节血管生成。AKT激酶可调节细胞增殖与存活等过程,参与肿瘤侵袭、转移和血管生成等重要过程[39-40]。CAT是构成氨基酸代谢的核心机制,能满足癌细胞的代谢要求,并且有助于癌细胞适应机体的缺氧微环境[41]。
综上所述,姜黄、郁金药对可通过多成分、多途径、多靶点协同发挥治疗肝癌的作用,且能通过调控相关靶点影响肿瘤患者预后,为进一步的实验和相关临床研究提供了新的思路。



