刘梅芳 杨光至 张霞辉 冯斯峰 徐连杰 周以皓 施静


摘要:目的 观察针灸对脑梗死大鼠HSP60、Caspase-3表达规律,初步探讨针灸对缺血性脑卒中大鼠神经细胞凋亡保护的作用机制。方法 采用大脑中动脉线栓诱导脑缺血再灌注损伤模型,随机假手术组、模型组、电针穴位组、电针非经非穴和艾灸穴位组。电针或艾灸干预后,术后0、12h评估大鼠的神经功能缺陷评分和姿势反射评分;荧光定量PCR检测HSP60和Caspase-3 mRNA的表达水平。结果 电针穴位组、艾灸穴位组大鼠神经功能均优于模型组,差异有统计学意义(P<0.05);与模型组比较,电针穴位组大鼠HSP60 mRNA显着增加,差异有显着性意义(P<0.05);而Caspase-3 mRNA表达无明显变化。结论 电针对大鼠脑缺血再灌注损伤神经功能有改善作用,其机制可能与上调脑组织中 HSP60表达,介导抗神经细胞凋亡有关。
关键词:缺血性脑卒中;HSP60;Caspase-3;神经细胞凋亡
中图分类号:R246 文献标志码:A 文章编号:1007-2349(2021)05-0069-04
【Abstract】Objective: To study the determination method of polysaccharides in Aconitum racemulosum and to establish a UV spectrophotometric method for the determination of polysaccharides from Aconitum Racemulosum, and to investigate the influence of different producing areas and different processing methods on the content of polysaccharides. Methods: The impurities such as reducing sugars were removed by 80% ethanol reflux and then the polysaccharides were extracted with hot water. The phenol-sulfuric acid colorimetry was used to measure absorbance value at 488 nm wavelength by ultraviolet-spectrophotometry to obtain the content of polysaccharides. . Results: The polysaccharide of Aconitum racemulosum was calculated as anhydrous glucose and showed a good linear relationship in the range of 0.003 to 0.015 mg/mL(R=0.9999), and the recovery rate was 99.35%-99.85%(n=6), and the RSD value was 0.18 %. Conclusion: This method is accurate, reliable, and reproducible, which is suitable for the determination of polysaccharide content in Aconitum racemulosum. There are certain differences in the polysaccharide content in different batches of medicinal materials from different origins. The processing method has no significant effect on the polysaccharide content of Aconitum racemulosum.
【Key words】Aconitum racemulosum; Polysaccharide; Ultraviolet Spectrophotometry; Producing Area; Processing
中风有着极高的发病率、患病率、死亡率、致残率和复发率。世界范围内,发病率平均为140~200/10万[1]。缺血性脑中风仍是当今疾病中主要的致残、致死原因,严重威胁人类的健康,并给家庭和社会带来了很大的负担,因此,探讨其发病机制,寻找有效的治疗方法一直是医学工作者研究的热点。缺血性脑损伤疾病发生与神经细胞凋亡密切相关,凋亡发生的重要原因之一是线粒体凋亡传导通路的激活。线粒体通路激活后,继而启动Caspase-9激活,继续激活Caspase-3,从而导致Caspase的级联反应,最终促使细胞凋亡的发生[2-3]。HSP60作为热休克蛋白家族中重要成员之一,在细胞凋亡过程中有其较强关联性[4]。
电针疗法是将针刺和电刺激相结合,通过脉冲电流作用于神经、肌肉引起神经兴奋性传导,消除神经纤维间水肿和神经滋养血管的痉挛,对脑卒中具有较好的临床疗效。本研究以线粒体通路引起凋亡为切入点,通过电针、艾灸刺激缺血性脑卒中大鼠,观察其对脑卒中大鼠的干预效应,初步探讨电针、艾灸对缺血性脑卒中大鼠神经细胞的保护机制,为临床针灸治疗脑缺血疾病的神经细胞保护提供依据。
1 材料与方法
1.1 实验动物 来源,种属,品系:SD大鼠,7~8周龄,体重180~200 g,雌性,昆明动物研究所实验动物中心提供,动物合格证号(SCXK(川)2015-030);动物饲养在SPF级动物房,实验动物至少饲养一周后使用。温度22±2℃,湿度55±5%,12 h光暗循环。饲料和水均在消毒后由动物自由摄取。所有实验均严格按照实验动物有关条例进行。
1.2 主要试剂 逆转录试剂盒、SYBR Premix Ex TaqⅡ购自大连Takara;Trizol裂解液购置天根生化(北京)科技有限公司;引物均由上海生物工程有限公司合成;艾条选用中国苏州市东方艾绒厂。
1.3 主要仪器 Veriti PCR扩增仪购自美国ABI公司;MX3000P核酸扩增荧光检测仪来自美国Aglient公司;Megafugel1.0R离心机购自德国Thermo Scientific Heraeus。6805-A电针仪购自广东省汕头市医用设备厂。
1.4 模型诱导、分组及干预 采用孟宜良的线栓法制作大鼠大脑中动脉局灶性脑缺血模型,并按照改良的Longa五点量表评分系统[5]对造模大鼠进行筛选。评分在 1~3 分为造模成功。以下2种情况为模型复制不成功,予以剔除:实验过程中大鼠死亡;规定时间处死动物取脑时见有蛛网膜下腔出血或颈内动脉分叉部出血。动物模型成功后,随机分为5组,每组5只,A组(假手术组);B组(模型组);C组(电针穴位组);D组(电针非经非穴);E组(艾灸穴位组)。待大鼠呼吸、心跳等生命体征稳定,按照不同的分组分别施以不同治疗,取穴和针刺手法参照华兴邦等研制的《大鼠穴位图谱》,选取“大椎”、“百会”、“人中”三穴进行针刺。针刺操作:“人中”向上刺lmm,“百会”向前斜刺2 mm,大椎直刺5 mm。针具选用佳健牌25号1寸一次性无菌针灸针;进针后捻转1 min,平补平泻,每次留针30 min。电针穴位组:将大鼠仰卧位束缚于鼠板上,针刺大椎、百会、人中穴,接电针,留针30 min;电针非经非穴组:将大鼠仰卧位束缚于鼠板上,针刺大椎、百会、人中穴的左侧约0.3cm的非经非穴点处,接电针,留针30 min;艾灸穴位组:将大鼠仰卧位束缚于鼠板上,艾灸大椎、百会、人中穴,灸30 min。电针仪选用广东省汕头市医用设备厂生产的6805-A 型,设定为疏密波,频率2H以针柄微微颤动为度,刺激30 min。
1.5 神经功能缺陷评分 使用改良的Longa五点量表评分系统[5]分别对各组大鼠进行造模前、治疗后12h神经功能缺陷评分和姿势反射评分。神经功能缺陷评分标准:无神经缺陷为0分;左肢体不能完全伸展为1分;行走时向右侧转圈为2分;行走时向右侧倾倒为3分;不能自发行走为4分;死亡为5分。姿势反射评分标准:两前肢完全伸展为0分(正常);左前肢贴在胸部,右前肢伸展为1分(轻度异常);左前肢贴在胸前,上半身卷曲为2分(严重异常)。
1.6 荧光定量PCR检测检测Caspase3和HSP-60 mRNA表达 称取约20 mg相同位置的脑组织,加入Trizol裂解液1 mL,组织匀浆,RNA提取试剂盒抽提细胞总RNA。按Takara逆转录试剂盒说明书操作进行逆转录合成cDNA。然后应用SYBR Green I嵌合荧光法在实时定量PCR仪胞Caspase3和HSP-60表达检测,相关引物由上海生物工程有限公司合成公司合成。在PCR反应程序结束后,进入仪器自带软件的数据分析界面,设置GAPDH为内参基因,仪器自动计算出各实验组基因表达差异倍数及标准差,即2-△△Ct±标准差值。特异基因引物系列如下:
Caspase3:(Forward Primer)5′-GTACAGAGCTGGACTGCGGTATTG-3′
(Reverse Primer)5′-AGTCGGCCTCCACTGGTATCTTC-3′
HSP-60:(Forward Primer)5′-CACCACTGCCACTGTTCTGG-3′
(Reverse Primer)5′-GCCAACATCACACCTCTCCG-3′
β-actin:(Forward Primer)5′-TCAGGTCATCACTATGGCAAT-3′-3′
(Reverse Primer)5′-AAAGAAAGGGTGTAAAACGCA-3′
1.7 统计学分析 本次研究采用 SPSS12.0 统计软件处理,实验数据用均数加减标准差表示,采用单因素方差分析,组间比较采用LSD检验,α=0.05为显着性检验性水准。
2 结果
2.1 针刺对脑梗死大鼠神经功能的影响 采用改良的Longa五点量表评分系统,评定动物神经功能缺损。每次评分3次,取平均值。分值越高,动物的行为障碍越严重。结果显示,干预12h,电针非经非穴组、电针穴位组、艾灸穴位组大鼠神经功能均低于模型组,差异有统计学意义。见表1。
2.2 针刺对脑梗死大鼠HSP60 mRNA基因表达水平的影响 荧光定量PCR检测结果显示,与假手术组比较,模型组HSP60 mRNA表达显着降低,与模型组比较,电针穴位组大鼠HSP60 mRNA显着增加,差异有显着性意义(P<0.05)。而电针非经非穴组和艾灸穴位组无显着的变化(P>0.05)。见表2。
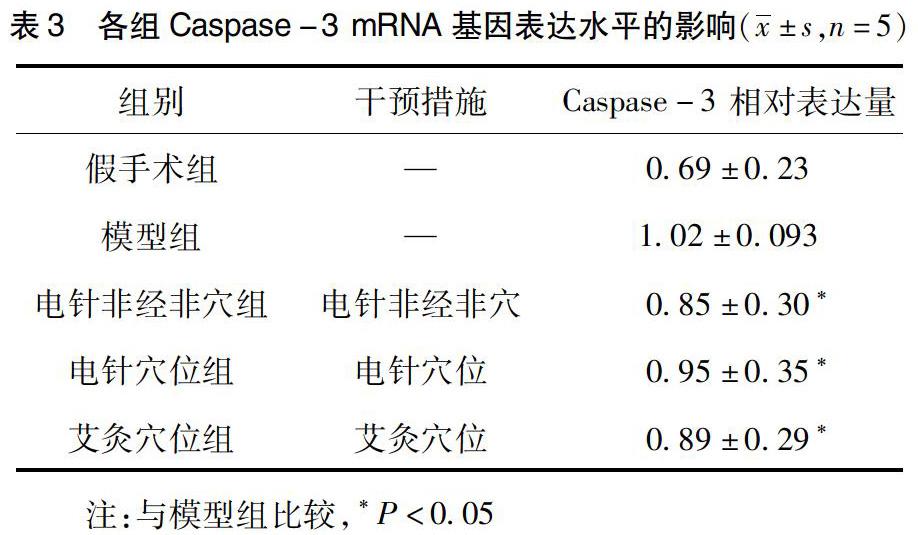
2.3 针刺对脑梗死大鼠Caspase-3 mRNA基因表达水平的影响 检测结果显示,与假手术组比较,模型组Caspase-3 mRNA基因表达水平上升。与模型组比较,电针非经非穴组、电针穴位组、艾灸穴位组大鼠Caspase-3 mRNA基因表达水平无明显变化(P>0.05)。见表3。
3 讨论
缺血性脑中风(脑梗死)仍是当今疾病中主要的致残、致死原因,严重威胁人类的健康,并给家庭和社会带来了很大的负担。近年来,越来越多的患者认可针刺治疗脑梗死的疗效,其治疗的机制也成为研究热点。针刺疗法是中国传统医学中一颗璀璨的明珠,有着悠久的历史,黄帝内经、针灸甲乙经等经典对针刺治疗脑中风均有记载,已有实验研究提示针刺可减少兴奋性氨基酸释放、增加脑血流、升高超氧化物歧化酶(SOD),同时降低血清脂质过氧化物(LPO)、加速清除自由基和脑细胞功能的修复等作用[3-4]。本研究结果显示电针干预12h,电针干预组大鼠神经功能均低于模型组,提示电针对脑中动脉线栓诱导脑缺血再灌注损伤模型具有较好的治疗作用,其相关的作用机制值得进一步研究。
神经细胞凋亡的重要原因之一是线粒体凋亡传导通路的激活,其与缺血性脑卒中疾病的发生密切相关[6]。目前抗神经细胞凋亡实验研究的靶点主要是保护线粒体结构和功能。脑中风(脑梗死)发病的特点是起病早,兴奋性氨基酸毒性引起神经元损伤。细胞死亡的早期阶段触发炎症反应,通过凋亡机制加重神经元损伤。Caspase-3介导的细胞死亡以及Caspase 无关的凋亡信号通路可由MCAO激活,导致梗死核心坏死,加重神经元损伤[7],其与缺血性脑卒中疾病的发生密切相关。
目前抗神经细胞凋亡实验研究的靶点主要是保护线粒体结构和功能。细胞凋亡的重要途径之一是线粒体凋亡通路,线粒体释放促凋亡因子进入胞浆随即线粒体凋亡通路启动,当线粒体释放细胞色素C到细胞浆后,线粒体通路激活后,继而启动Caspase-9激活,继续激活Caspase-3,从而导致Caspase的级联反应,最终促使细胞凋亡的发生[2-3]。热休克蛋白在细胞凋亡中具有复杂的作用,但主要是抗凋亡[8],它们的抗凋亡作用的统一特征是抑制蛋白水解成熟和/或胱天蛋白酶的活性,以及裂解其靶底物,包括粘着斑激酶(FAK)和PARP有研究指出:HSP60作为热休克蛋白家族中重要成员之一,在细胞凋亡过程中有其较强关联性[4]。研究表明,HSP60表达的减少会促进细胞凋亡,但不会改变线粒体功能。
本研究通过荧光定量PCR检测HSP60表达情况。结果显示,电针穴位组大鼠HSP60 mRNA显着增加,提示电针可能通过增加HSP mRNA表达,发挥HSP抗凋亡的作用,抑制神经细胞发生凋亡,从而发挥缺血性脑损伤的保护作用。为进一步研究HSP60对凋亡信号通路干预环节,我们进一步研究检测Caspase-3 mRNA表达。结果显示,电针对脑梗死大鼠Caspase-3 mRNA基因表达水平无明显变化,提示电针可能不作用在Caspase级联反应,推测可能结合胞质中Bax、Bak或Bcl2家族,形成复合物从而发挥抗凋亡效应,确切的作用机制有待进一步研究。
参考文献:
[1]王定坤.我国脑血管病的流行病学分析与防治对策[J].中医药管理杂志,2014,18(6):830-831.
[2]Szabo S J,Kim S T,Costa G L,et al.A novel transcription factor,T-bet,directs Th1 lineage commitment[J].Cell,2000,100(6):655-669.
[3]Wurster A L,Tanaka T,Grusby M J.The biology of Stat4 And Stat6[J].Oncogene,2000,19(21):2577-2584.
[4]曹智,马骏,袁文俊,等.热休克蛋白60与细胞凋亡[J].生理科学进展,2008,21(3):267-270.
[5]BEDERSON JB,PITTS LH,TSUJI M,et al.Rat middle cerebral artery occlusion evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[6]Jolly C,Morimoto R.I.Role of the heat shock response and molecular chaperones in oncogenesis and cell death[J].J.Nat.Can.Inst,2000,92(8):1564-1572.
[7]Guo WP,Wang J,Li RX,et al.Neuroprotective effects of neuregulin-1in rat models of focal cerebral ischemia[J].Brain Research,2006,1087(1):180-185.
[8]Samali A,Cotter T.G.Heat shock proteins increase resistance to apoptosis[J].Ex.l Cell Res,1996,22(3):163-170.



