刘鑫禹 张东伟


*基金项目:2019全国中医临床特色技术传承骨干人才培训项目(国中医药人教函[2019]36号)
第一作者简介:刘鑫禹(1999-),女,硕士研究生,研究方向:中西医结合防治恶性肿瘤。
△通信作者:张东伟,E-mail:zdw138667@163.com
摘要:目的 基于网络药理学探究柴胡桂枝汤治疗胆管癌的主要活性成分及潜在的作用机制。方法 利用TCMSP数据库筛选出柴胡桂枝汤中的有效成分及对应的靶点蛋白,与Uniprot数据库中人类基因名称匹配后对作用靶点规范化处理;基于Genecard、Disgenet等数据库筛选出胆管癌疾病靶点,并与中药靶点蛋白匹配得到共同靶点;将共同靶点信息导入String数据平台进行PPI网络分析,并通过Metascape数据平台完成GO功能注释和KEGG富集。结果 获取柴胡桂枝汤治疗胆管癌的96个有效靶点,其中核心靶点8个。GO注释共得出1784条目,KEGG富集通路为179条。结论 柴胡桂枝汤可能通过各种癌症信号通路、内分泌抵抗、EGFR TKI耐药性、铂耐药性、IL-17信号通路、p53信号通路等途径发挥治疗作用,为胆管癌的诊治提供了参考依据。
关键词:柴胡桂枝汤;胆管癌;网络药理学;作用机制
中图分类号:R730.5 文献标志码:A 文章编号:1007-2349(2024)05-0067-06
胆管癌(cholangiocarcinoma,CC)是一种源自胆管上皮的恶性肿瘤,发病率在世界范围内逐年上升[1],是世界上第二大常见的肝脏系统恶性肿瘤,仅次于肝细胞性肝癌。约40%~70% 发生在肝外胆管,5%~20%的CC发生在肝脏内[2]。其发病隐匿,所有病例在40岁之前很少被诊断出来,男性较女性多见[3]。CC的发生与原发性硬化性胆管炎、肝硬化、非酒精性脂肪性肝病、胆管结石、HBV/HCV感染以及肝吸虫病等密切相关[4]。作为一种恶性侵袭性疾病,胆管癌更易向胆管壁浸润并侵犯周围肝组织、周围血管、神经及淋巴,手术切除率低[5],且对化疗敏感性差,保守治疗的效果也不够理想,预后不佳。统计结果显示,其5年生存率低于23.7%,存活率一般<2年[6]。
胆管癌在中医古籍中无明确病名,多分散于“积聚”、“胁痛”、“黄疸”等门类中。《灵枢·胀论》曰:“胆胀者,胁下胀痛”。中医学认为胆为“中精之腑”,与肝相表里,主储胆汁而传化水谷与糟粕,以通降下行为顺。凡外感湿邪、情志不舒、饮食失节或虫积等,均可导致肝失条达,气机不畅,运化枢机不利,气血停滞郁于胁下,久而化瘀;肝木乘土,脾气不足,无力推动津液输布,水液停聚,久而伏热酝酿生痰,痰热与瘀血相搏,积于胆腑,发为此病[7]。柴胡桂枝汤(CHGZD)源自《伤寒杂病论》,由小柴胡汤和桂枝汤各半合方而成,主要组成包括柴胡、桂枝、黄芩、白芍、人参、半夏、甘草、生姜、大枣。现临床上人参多用太子参代替。方中柴胡与桂枝相伍,条达肝气、宣通发散,使清阳上升;黄芩、半夏苦降直折,疏肝降逆,气机调畅则脉道通利,津液得泄,瘀血顽痰则有出处;芍药敛阴柔肝,平肝木、清虚火,桂芍相伍又可调和营卫,温通脉络,引血归经;参、姜、草、枣建中补虚,使气血生化有源。酸甘化阴、辛甘化阳,阴阳同补,生生不息。全方散中有收、补中有泻、降中有升,寒热平调,使阴阳相生,气血调和,气机升降有常,正气得复则邪自去。长期以来,柴胡桂枝汤在肝胆系统肿瘤的治疗中疗效确切,但对其治疗胆管癌的作用机理尚无系统性研究。本研究在此基础上,应用网络药理学理论,聚焦柴胡桂枝汤在胆管癌中的治疗作用,探索中医复方中的有效成分、关键信号通路及靶点,构建相关网络,分析其治疗胆管癌可能的作用机制,为后期的临床研究提供一定的理论基础。
1 资料与方法
1.1 CHDZD有效成分筛选 利用中药系统药理学分析平台数据库(TCMSP,https://tcmsp-e.com/)分别搜索柴胡、桂枝、黄芩、太子参、甘草、半夏、白芍、生姜、大枣的主要化学成分。以口服生物利用度(OB)≥30%,药物相似性(DL)≥0.18作为筛选标准,最终得到193个有高度活性的关键化合物成分。
1.2 中药靶点预测及生物活性成分-靶点网络构建 继续以TCMSP为平台,查找193个关键化合物对应的蛋白靶点,再使用Uniprot数据库(https://www.uniprot.org/)查询人类基因名称并与之匹配,得到CHGZD的潜在作用靶点。利用网络绘图软件Cytoscape 3.7.1[8]构建CHGZD主要生物活性成分-靶点之间的作用网络。
1.3 胆管癌靶点筛选 在Genecards(https://www.genecards.org/)、Disgenet(https://www.disgenet.org/)、TTD(https://db.idrblab.net/)、OMIM(https://omim.org/)、Uniprot疾病基因数据库中分别以“Cholangiocarcinoma”为关键词检索胆管癌的疾病作用靶点,整合所有数据库搜索到的信息,删除重复项后最终得到靶点1833个。
1.4 PPI网络构建 将药物靶点与疾病靶点导入Venny2.1.0[9],绘制CHGZD-CC交集基因的韦恩图,得到交集基因96个。通过蛋白质互作网络分析数据平台String(https://cn.string-db.org/)对交集基因进行互作分析,以相互作用评分≥0.700为筛选条件,构建CHGZD治疗CC的PPI网络图。将PPI网络数据导入Cytoscape 3.7.1,以度值(degree)、介数中心性(Betweenness Centrality,BC)、亲近中心性(Closeness Centrality,CC)作为标准,三轮中位数筛选后得到核心靶点8个。
1.5 GO富集和KEGG通路富集 为了进一步分析CHGZD作用于CC的生物学过程和信号通路传导过程,将网络中的靶点导入基因富集分析平台Metascape(https://metascape.org/),进行GO富集和KEGG通路富集。取P<0.01且排名前10的GO条目构图并对比分析。基于富集分数(Enrichment Score,ES)排名前20的GO条目和信号通路分别绘制气泡图、条形图。
2 结果
2.1 CHGZD有效成分筛选 基于TCMSP数据平台分别检索CHGZD中九种中药的成分信息,分别筛选出柴胡成分17项,桂枝成分8项,黄芩成分36项,白芍成分13项,半夏成分13项,太子参成分8项,生姜成分5项,大枣成分29项,甘草成分92项,去重后得到193种化合物。有效成分详见图1。
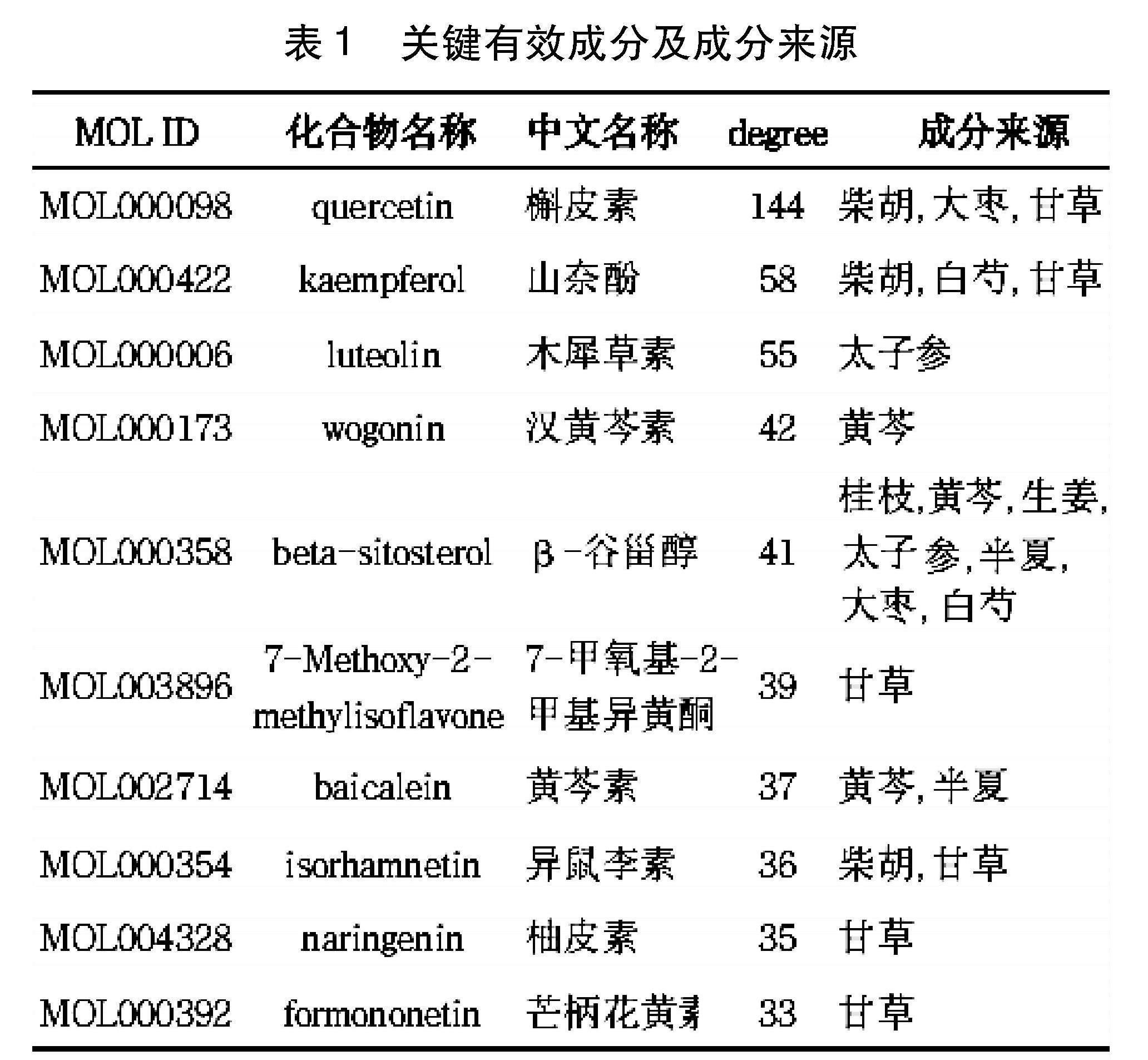
2.2 有效成分靶点预测及生物活性成分-靶点网络构建 通过TCMSP数据库继续检索193种有效成分相对应的靶点蛋白信息。在Uniprot数据库中检索人类基因名称及其对应蛋白,匹配后得到CHGZD有效成分可能的作用靶点共278个。利用Cytoscape 3.7.1制作生物活性成分靶点之间的作用网络图,共获得2403对生物活性成分与对应作用靶点,见图2。图中节点尺寸越大/透明度越低表明度值(degree)越大。槲皮素、山奈酚、木犀草素、汉黄芩素、β-谷甾醇等化合物能与多个靶点结合发挥作用,见表1。PPARG、TOP2A、PTGS2、MAPK14等靶点能与多个成分形成作用关系。
2.3 CC靶点筛选及药物-疾病靶点交集 在多个疾病基因数据库中搜索CC相关靶点信息,最后得出Uniprot 10项、Disgenet 877项、TTD 14项、OMIM 23项、Genecards 1186项(筛选分1.5)。去重后的CC疾病靶点共1833个。将药物靶点与疾病靶点相匹配,最终得出交集基因96个。使用韦恩图表示结果,见图3。
2.4 PPI网络构建 将交集基因导入String平台,以相互作用评分≥0.700筛选,删除无连接节点后,共得出93个节点,794条边,平均节点度值为16.5。见图4。其中节点对应各基因靶点,边对应两靶点间存在的相互作用关系。将后台数据导出至Cytoscape 3.7.1,基于degree、BC、CC排序,各用中位数筛选3次,最终以degree≥32.5,BC≥247.89,CC≥0.5878为标准,得到核心靶点8个:TP53、STAT3、AKT1、CASP3、JUN、HSP90AA1、EGFR、MAPK3。
2.5 GO分析和KEGG富集结果 对96个交集基因进行GO及KEGG富集分析,共得出GO条目1784项,KEGG富集通路179条。GO分析中包括:生物学过程(biological process,BP)1594项,细胞组分(cellular component,CC)70项,分子功能(molecular function,MF)120项。GOBP、GOCC、GOMF各选取P值排名前10项信息绘制条状图,见图6。分析可知潜在作用靶点的生物学过程主要涉及对激素反应、对异物刺激反应、对活性氧反应、对氧气水平反应、对细胞群增殖的负向调节等;细胞组分主要涉及转录调节器复合物、膜筏、囊泡腔、膜微域、细胞质囊泡腔等;分子功能主要涉及转录因子结合、激酶结合、泛素类蛋白连接酶结合、蛋白激酶活性、信号受体调节器活性等。根据富集指数(ES)排名取前20项绘制气泡图,见图7。KEGG富集主要涉及的通路包括各种癌症信号通路、内分泌抵抗、EGFR酪氨酸激酶抑制剂耐药性、铂类药物耐药性、IL-17信号通路、p53信号通路、催乳素信号通路、多种类细胞凋亡信号通路等,见图8。
3 讨论
目前胆管癌的治疗仍以手术为主,同步放化疗在晚期不可切除的胆管癌治疗中也有一定获益[10]。对于CC的发病机制仍在不断深入探索中,分子靶向治疗近年来也取得了重大突破,但由于其高度分子多样性和基因异质性的特征,个体差异较大,对临床指导有一定局限性。免疫治疗前景广阔,单药治疗的安全性和有效性已得到初步验证,但在临床实践中疗效往往不达预期。
对于胆管癌的治疗,中医多责之肝失疏泄,中焦枢转不利,有形之邪郁积胆腑。治宜疏肝和营,通利胆腑,同时注意顾护正气,健脾和胃,益气养血,以期祛邪而不伤正。柴胡桂枝汤作为经方,临床常作为胆管癌治疗的底方加减,现广泛应用于恶性肿瘤及其并发症的治疗中。方雨潇等[11]发现CHGZD联合卡培他滨可能通过抑制IL-6/STAT3信号通路诱导细胞凋亡,抑制三阴性乳腺癌裸鼠体内肿瘤的生长。江恒等[12]以CHGZD联合盐酸羟考酮缓释片治疗癌痛,结果显示爆发痛及不良反应发生率显着降低。
本研究通过网络药理学理论探索柴胡桂枝汤治疗胆管癌的潜在作用机制。对柴胡、桂枝、黄芩、白芍等九味药物有效成分进行筛查,最终得出柴胡桂枝汤的关键有效成分5种:槲皮素、山奈酚、木犀草素、汉黄芩素、β-谷甾醇。槲皮素是一种乙酰胆碱酯酶抑制剂,可通过抗氧化、抑制细胞增殖、促进细胞凋亡、调节炎症反应等发挥抗肿瘤作用,一般在肺、肝、肾和小肠中积累[13]。近期研究发现槲皮素能够通过抑制胆管癌细胞的上皮间充质转化过程逆转细胞毒性抗肿瘤药物的耐药性[14],上调其对癌细胞的杀伤作用。山奈酚存在于多种姜科植物、蔬菜及茶类中,具有抗氧化、抑制T细胞过度活化、抗肿瘤、抗炎等作用[15],还可通过抑制PI3K/AKT/GSK-3β信号通路,下调P13K、AKT磷酸化水平,从而诱导细胞凋亡[16]。木犀草素为黄酮类化合物,可通过抗血管生成、抗炎效应等发挥抑癌作用。汉黄芩素、β-谷甾醇亦被证实具有抗氧化、抗炎等活性[17]。对柴胡桂枝汤和胆管癌的96个交集基因进行PPI网络分析最终得到8个核心靶点,分别是TP53、STAT3、AKT1、CASP3、JUN、HSP90AA1、EGFR、MAPK3,主要参与细胞周期调节、炎症反应、免疫应答、细胞凋亡等过程。
KEGG富集结果表明,各种癌症信号通路、内分泌抵抗、EGFR TKI耐药性、铂耐药性、IL-17信号通路、p53信号通路可能是柴胡桂枝汤治疗胆管癌的主要作用途径。EGFR是一种酪氨酸激酶,可参与调节细胞的平衡,刺激肿瘤生长。EGFR基因突变和蛋白过表达,都会激活下游途径,与肺癌关系密切[18]。酪氨酸激酶抑制剂(TKI)在临床应用广泛,但其耐药情况也变得更加常见,常见的突变机制包括T790M、c-Met、HGF、K-RAS突变、PTEN缺失等[19]。铂类药物如顺铂、卡铂和奥沙利铂广泛用于恶性肿瘤的治疗中,有研究表明[20],铂耐药性可能源于药物流入减少/流出增加、谷胱甘肽等细胞内排毒、DNA修复增加、错配修复减少、细胞凋亡缺陷和肿瘤基因表达的改变。白细胞介素17(IL-17)家族是由IL-17A-F组成的细胞因子子集,在急性和慢性炎症反应中都起着关键作用[21]。IL-17驱动的代谢途径为组织稳态传递重要信号。IL-17 通过不同的 TRAF 蛋白激活下游信号通路,如 IκBζ、NF-κB、C/EBP 和 MAPK 通路等,以诱导细胞的增殖、分化或凋亡[22]。IL-17在肝内胆管癌中的表达已得到证实[23],IL-17RA可直接作用于肿瘤细胞以诱导炎症反应。p53蛋白被用作p53调节基因的转录激活剂,可被DNA损伤、氧化应激和激活的致癌基因等多种应激信号诱导激活[24],同时作为上游激活剂,p53蛋白通过激活多种信号通路并与之相互作用来发挥其生长抑制活性。主要参与细胞周期停滞、细胞衰老或凋亡。目前有研究表明[25],p53可通过诱导 microRNA 34a下调 PD-L1表达,从而在免疫检查点调节中发挥作用。
综上,本研究发现柴胡桂枝汤在胆管癌的治疗中具有多成分、多靶点、多途径的作用优势。柴胡桂枝汤主要通过槲皮素、山奈酚、木犀草素等有效成分发挥调节细胞周期、诱导肿瘤细胞凋亡、抗炎症等作用,参与各种癌症信号通路、p53信号通路、IL-17信号通路等,以及对铂类药物、EGFR-TKI耐药性的调控达到治疗目的。本研究通过网络药理学理论对柴胡桂枝汤治疗胆管癌的作用机制进行了初步探讨,后续有待体外试验和临床研究进一步揭示其原理,为胆管癌协同诊治提供更大的参考价值。
参考文献:
[1]Saha SK,Zhu AX,Fuchs CS,et al.Forty-year trends in cholangiocarcinoma incidence in the U.S.:Intrahepatic disease on the rise[J].Oncologist,2016,21(5):594-599.
[2]Sirica A E.Cholangiocarcinoma:Molecular targeting strategies for chemoprevention and Therapy[J].Hepatology,2004,41(1):5-15.
[3]Marcano-Bonilla L,Mohamed E A,Mounajjed T,et al. Biliary tract cancers:Epidemiology,molecular pathogenesis and genetic risk Associations[Z].AME Publishing Company,2016:61-61(2016).
[4]Choi J,Ghoz HM,Peeraphatdit T,et al.Aspirin use and the risk of Cholangiocarcinoma[J].Hepatology,2016,64(3):785-796.
[5]张文杰,孙倍成.胆管癌的治疗进展[J].肝胆胰外科杂志,2020,32(6):326-330.
[6]Wang Y,Yang H,Shen C,et al.Surgical procedure and longterm survival of hilar cholangiocarcinoma[J].Int J Clin Exp Med,2015,8(1):1122-1128.
[7]赵治龙,耿耘.中医治疗胆管癌的探讨[J].中华中医药学刊,2014,32(2):262-263.
[8]Shannon P.et al.,Cytoscape:a software environment for integrated models of biomolecular interaction networks.Genome Res(2003)11:2498-2504.
[9]Oliveros,J.C.(2007-2015)Venny.An interactive tool for comparing lists with Venns diagrams.https://bioinfogp. cnb. csic.es/tools/venny/index.html.
[10]Hammad A Y,Berger N G,Eastwood D,et al.Is Radiotherapy Warranted Following Intrahepatic Cholangiocarcinoma Resection? The Impact of Surgical Margins and Lymph Node Status on Survival[Z].Springer Science and Business Media LLC,2016:912-920(2016).
[11]方雨潇,王淑美,杨倩,等.柴胡桂枝汤加减方联合卡培他滨抑制三阴性乳腺癌裸鼠皮下移植瘤的生长:基于抑制IL-6/STAT3信号通路[J].南方医科大学学报,2022,42(6):905-912.
[12]江恒,原薇薇,廖皓,等.柴胡桂枝汤联合盐酸羟考酮缓释片治疗癌性疼痛的临床疗效观察[J].现代肿瘤医学,2020,28(14):2517-2519.
[13]Batiha G E-S,Beshbishy A M,Ikram M,et al.The Pharmacological Activity,Biochemical Properties,and Pharmacokinetics of the Major Natural Polyphenolic Flavonoid:Quercetin[J].Foods,2020,9(3):374.
[14]王艳丽,唐滋贵.槲皮素抑制胆管细胞癌HCCC-9810细胞上皮-间质转化并上调抗肿瘤药物对其杀伤作用[J].科学技术与工程,2017,17(19):108-111.
[15]慕静静,曾耀英,黄秀艳,等.山奈酚对小鼠T淋巴细胞体外活化、增殖和细胞周期的影响[J].细胞与分子免疫学杂志,2009,25(12):1106-1108+1111.
[16]赵明智,张磊,周丹,等.山奈酚调控PI3K/AKT/GSK-3β信号通路促进人炎性乳腺癌SUM190细胞株凋亡的研究[J].广西医科大学学报,2019,36(6):872-877.
[17]Zheng Z,Zhu W,Lei L,et al.<;p>;Wogonin Ameliorates Renal Inflammation and Fibrosis by Inhibiting NF-κB and TGF-β1/Smad3 Signaling Pathways in Diabetic Nephropa-thy<;/P>;[Z].Informa UK Limited,2020:4135-4148(2020).
[18]Huang L,Fu L.Mechanisms of resistance to EGFR tyrosine kinase inhibitors[J].Acta Pharmaceutica Sinica B,2015,5(5):390-401.
[19]Ahsan A.Mechanisms of Resistance to EGFR Tyrosine Kinase Inhibitors and Therapeutic Approaches:An Update[M].Cham:Springer International Publishing,2015:137-153.
[20]Zhou J,Kang Y,Chen L,et al.The Drug-Resistance Mechanisms of Five Platinum-Based Antitumor Agents[J].Frontiers in Pharmacology,2020,11.
[21]Song X,Qian Y.IL-17 family cytokines mediated signaling in the pathogenesis of inflammatory diseases[J].Cellular signalling,2013,25(12):2335-2347.
[22]Bechara R,McGeachy M J,Gaffen S L.The Metabolism-modulating activity of IL-17 signaling in health and Disease[J].Journal of Experimental Medicine,2021,218(5).
[23]Asukai K,Kawamoto K,Eguchi H,et al.Prognostic Impact of Peritumoral IL-17-Positive Cells and IL-17 Axis in Patients with Intrahepatic Cholangiocarcinoma[J].Annals of Surgical Oncology,2015,22(S3):1524-1531.
[24]Wu G S.The functional Interactions Between the MAPK and p53 Signaling Pathways[J].Cancer Biology & Therapy,2004,3(2):156-161.
[25]Huang J.Current developments of targeting the p53 signaling pathway for cancer Treatment[J].Pharmacology & Therapeutics,2020:107720.
(收稿日期:2023-07-10)



