郑奇辉,王迎斌,刘 伟,王书宝,黄生辉
兰州大学第二医院麻醉科,甘肃 兰州 730030
神经病理性疼痛是一种外周或中枢神经系统受到结构损伤或功能紊乱而出现的慢性疼痛,临床常表现为长期慢性自发疼痛、感觉异常、痛觉超敏、异常疼痛,持续数天、数月甚至数年,是一种持续顽固性疼痛疾病[1]。目前多采用阿片类镇痛药、非甾体抗炎药类和抗抑郁类药,但总体治疗效果不佳,副反应较多。故新型镇痛药的开发和需求显得越来越重要。梓醇是中药熟地黄的有效成分,具有有效的抗炎、抗糖尿病和神经保护作用[2-3],本研究采用大鼠慢性挤压神经损伤模型探讨梓醇对神经性疼痛的治疗效果及其机理,现将结果报道如下:
1 材料与方法
1.1 动物选择及模型制作 选用SPF级SD大鼠,实验动物合格证号:SYXK(甘)2011-0001,雄性,体质量180~200 g。坐骨神经结扎(CCI)模型按照文献[4-6]方法制作,腹腔注射10%水合氯醛溶液麻醉(400 mg/kg腹腔给药),达到麻醉效果后大鼠取俯卧位四肢固定,左侧后肢未行手术,右侧后肢实施手术,剃毛,无菌消毒后切开,分离皮下组织及肌肉组织,在大腿中部水平暴露坐骨神经,并用4-铬肠线按1 mm间距松弛结扎神经,共结扎4根,无菌手术线缝合伤口。在结扎的坐骨神经旁埋置一根聚乙烯导管以预防坐骨神经周围局部麻醉中经皮注射或者手术暴露后注射中发生的麻醉起效时间不足等问题。假手术组不做神经结扎,其余实验操作与此相同。所有动物术后3天伤口恢复,不进行任何被动运动和行为学测试,适量给予抗生素抗感染治疗。
1.2 行为学实验 所有实验大鼠均在术前及术后给药前、给药后第1~7天使用电子触觉测试装置,按照Mitrirattanakul等[7]的方法,通过向上移动触觉测试长丝刺激至后爪中心,直到出现缩足反射,测定并自动记录机械缩足反射阈值(MWT)。梓醇对炎性痛觉过敏的抑制率用最大镇痛效应百分率(maximal possible effect,MPE%)表示,MPE%=(给药后阈值-给药前阈值)/(基线阈值-给药前阈值)×100。行为测试时间为 09∶30 至 18∶00 之间。
1.3 动物分组 对所有实验老鼠进行编号,用随机软件抽取编号进行分组,分为假手术组(sham group)、溶剂组(vehicle group)、阳性药物组(巴喷丁,gabapentin group)、梓醇组(catalpol 1、5、25、125 mg/kg),行为测试前动物习惯测试房间至少30分钟。
1.4 给药方案 术后4日起,各组分别用溶剂(生理盐水)、巴喷丁(50 mg/kg,购自 Sigma,批号:24271605)、梓醇(购自成都德思特生物,批号:110808201510)1、5、25、125 mg/kg腹腔给药,1次 /d,连续7天。其他试剂均购自国产分析纯。
1.5 统计学方法 应用SPSS 20.0统计软件分析数据,计量资料以(±s)表示,组内比较用配对t检验,组间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 CCI模型中MWT值变化情况 术前及术后假手术组大鼠MWT值曲线无明显变化,其他各组大鼠经坐骨神经结扎术后,与假手术组比较MWT值显着下降(P<0.001)。术后第4日开始每天腹腔内分别注射1次溶剂生理盐水、巴喷丁50mg/kg及梓醇1、5、25、125 mg/kg 后,发现梓醇和巴喷丁能明显提升 CCI大鼠的 MWT值,并且梓醇(1、5、25、125 mg/kg)组及阳性药物组MWT与溶剂组比较具有显着性差异(P<0.001);发现随着治疗时间的延长,大鼠的MWT值逐渐回升,在治疗第7天达到最大值。并且随着梓醇治疗剂量的增加,MWT值也明显升高,呈剂量依赖性,以梓醇125 mg/kg最为明显,见图1。
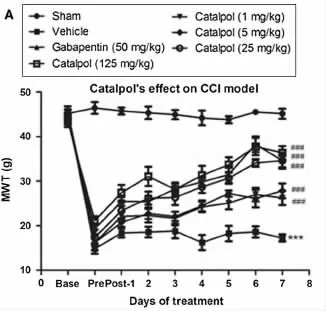
图1 各组CCI大鼠MWT值变化情况
2.2 CCI大鼠MPE值的变化 巴喷丁(50 mg/kg)和梓醇(1、5、25、125 mg/kg)连续 7 天腹腔注射治疗,第 7 天 MPE 值分别为(61.19±6.18)%、(31.94±5.64)%、(38.06±5.78)%、(61.94±5.14)%和(69.13±5.12)%,治疗剂量越大,MPE值越高。并且梓醇各剂量组和阳性药物组与溶剂组比较差异有统计学意义(P<0.05),对CCI大鼠均有明显的痛觉抑制效果,梓醇剂量为25 mg/kg时MPE与阳性药物组比较差异无统计学意义(P>0.05),梓醇剂量为125 mg/kg时的镇痛效果优于阳性药物(P<0.001),见图 2。
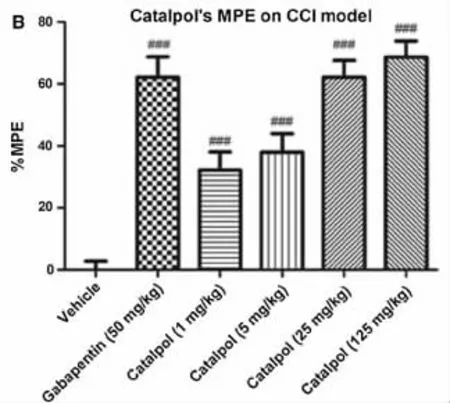
图2 CCI大鼠用药后各组MPE值比较
3 讨论
CCI模型是通过适度的结扎坐骨神经,选择性损伤有髓鞘的粗纤维,保留大部分传递痛觉的C类纤维来研究神经病理性疼痛的常用模型。本研究发现术后手术侧后肢MWT降低,非手术侧MWT无变化,说明手术模型建立成功。手术后第4天开始给予巴喷丁、梓醇治疗 CCI,MWT值逐渐升高,炎性疼痛的抑制率(MPE)逐步回升,机械痛得到逆转,同时梓醇的治疗效果具有时间累积效应和剂量依赖性,治疗时间越长,疼痛抑制率越高;药物剂量越高(25、125 mg/kg),镇痛效果越好;且治疗中未发现耐受性。表明梓醇可有效减少CCI模型大鼠的神经性疼痛。
既往研究[8]表明神经病理性疼痛与组织外周神经免疫细胞关系密切,当外周组织受到损伤,损伤部位的中性粒细胞、巨噬细胞、肥大细胞等大量聚集,释放各种炎性介质、趋化因子和防御素等,使肥大细胞具有趋化性,也使传导疼痛刺激的伤害性感受器发生敏化,增加了痛觉过敏。小胶质细胞的异常激活在神经病理性疼痛中也发挥着重要作用,发现大脑和脊髓中大量分布的小胶质细胞,在神经损伤后的数小时内即可被激活,并产生级联反应,释放大量的炎性细胞因子如IL-6、TNF-α及细胞因子等活性物质[9]。该活性物质又作用于周围的胶质细胞产生级联反应或作用于痛觉神经元上对应的受体或信号级联通路,导致脊髓中枢敏化,促进神经病理性疼痛[10-11]。既往研究[3,12]证实梓醇可通过清除自由基,提高抗氧化酶活力,抑制小胶质细胞的增殖和星形胶质细胞的活化,降低肿瘤坏死因子、白介素等炎症因子的过量表达,在抗氧化、抗炎症和提高神经可塑性等方面起重要作用,这可能是逆转CCI大鼠神经病理性疼痛的机理,但具体发生机制还需进一步实验研究。
总之,梓醇对CCI模型大鼠神经病理性疼痛有一定的镇痛作用,并且随着治疗时间的延长和治疗剂量的加大,治疗效果越明显。
[1]Attal N,Bouhassira D.Neuropathic pain:experimental advances and clinical applications[J].Rev Neurol(Paris),2004,160(2):199-203.
[2]Li DQ,Duan YL,Bao YM,et al.Neuroprotection of catalpol in transient global ischemia in gerbils[J].Neurosci Res,2004,50(2):169-177.
[3]Jiang B,Du J,Liu JH,et al.Catalpol attenuates the neurotoxicity induced by β-amyloid(1-42)in cortical neuron-glia cultures[J].Brain Res,2008(1188):139-147.
[4]Bennett J,Xie K.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33:87-107.
[5]Xu Y,Qiu HQ,Liu H,et al.Effects of koumine,an alkaloid of Gelsemium elegans Benth,on inflammatory and neuropathic pain models and possible mechanism with allopregnanolone[J].Pharmacology Biochemistry and Behavior,2012,101(3):504-514.
[6]牛晓光.复方盐酸利多卡因对大鼠坐骨神经病理性疼痛的神经阻滞作用[D].石家庄:河北医科大学,2012.
[7]Mitrirattanakul S,Ramakul N,Guerrero,AV,et al.Sitespecific increases in peripheral cannabinoid receptors and their endogenous ligands in a model of neuropathic pain[J].Pain,2006,126(1/3):102-114.
[8]Scapini P,Lapinet-vera JA,Gasperini S,et al.The neutrophil as cellular source of chemokines[J].Immunol Rev,2000,177(1):195-203.
[9]Watkins LR,Milligan ED,Maier SF.Glial activation:a driving force for pathological pain[J].Trends Neurosci,2001,24(8):450-455.
[10]Meulders A,Vlaeyen JW.Fear reduction in subacute whiplash-associated disorders:the royal road to recovery?[J].Pain,2013,154(3):330-331.
[11]Gao Y,Liu H,Deng L,et al.Effect of emodin on neuropathic pain transmission mediated by P2X2/3 receptor of primary sensory neurons[J].Brain Res Bull,2011,84(6):406-413.
[12]BiJ,Jiang B,ZornA,etal.CatalpolinhibitsLPS plus IFN-gamma-induced inflammatory response in astrocytes primary cultures[J].Toxicology in Vitro,2013,27(2):543-550.



