秦继勇,李文辉△,徐进彦,刘建波,王曙光,王承红,常 莉
(1.昆明医科大学第三附属医院(云南省肿瘤医院)肿瘤放射治疗中心,昆明 650118;2.云南省肿瘤研究所肿瘤放射治疗研究中心,昆明 650118;3.云南省中医药研究所,昆明 650118)
山楂为蔷薇科植物山里红(Crataegus pinnatifida Bge.var.major N.E.Br.或山楂 C.pinnatifuta Bge)的干燥成熟果实,性味酸、甘、微温,归脾、胃、肝经,具行气散瘀、止痛、消食化积功能。作为常用的中药材,急、慢性毒理试验证明,其药用安全可靠,无任何毒副作用[1]。本文主要研究山楂醇提物灌胃对辐射损伤小鼠造血系统的保护作用。
1 材料
1.1 试剂与仪器
RPMI-1640(GIBCO公司生产,批号1296119)、高氯酸(高天津鑫源化工厂,批号20041208)、苦味酸(广东合山化工厂,批号20041105)、氯化钙(成都金山化工试剂厂,批号040326)、冰醋酸(重庆川江化学试剂厂,批号20040407)、福尔马林(成都金山化工试剂厂,批号900704)、瓦里安直线加速器(型号2100C)、离心机(国产,型号TGL-168)、普通光学显微镜(Olympus公司,型号CX-31)、血细胞计数仪(Sysmex公司,型号 KX-21N)、分光光度计(Kyoto公司,型号 UV-190)、电子天平(Sartorius公司,型号BP3100S)、烘箱(国产,型号2002020001)等。
1.2 动物
健康SPF级昆明种雄性小鼠,体质量20±2g,6~8周龄,由昆明医学院动物实验部提供。
1.3 药物
山楂由云南省中医中药研究所提供(产地河北),在云南大学天然药物教研室进行提取:将1000克成熟带皮山楂在高温下干燥,然后研成粉末,浸泡于4000ml75%水合甲醇溶液中并进行振荡1h,随后在室温下放置72h后进行过滤,将滤液在40℃条件下减压干燥,得到山楂醇提物中有效活性成分的水合物,然后在低温条件下进行冻干,得到粉状提取物,制成含生药浓度为0.5g/ml的醇提液,置于4℃冰箱保存待用。
2 方法
2.1 动物分组
将50只小鼠按体重分层随机抽样分成5组,即:正常对照组(control组)、单纯照射组(IR组)、低剂量给药+照射组(LD+IR组)、中剂量给药 +照射组(MD+IR组)、高剂量给药 +照射组(HD+IR组),每组各10只。
2.2 给药剂量及方式
山楂醇提物按小鼠体重将实验药物分别给予HD5g/kg(用生理盐水稀释为0.2ml,灌胃给药,下同)+IR组、MD组2.5g/kg+IR、LD组1.25g/kg+IR,control组和IR组分别灌0.2ml的生理盐水。
2.3 实验流程
第1天将50只小鼠称重、标记,然后以相应浓度溶液灌胃(control组和IR组灌生理盐水,LD+IR组、MD+IR组、HD+IR组分别灌相应浓度受试药物),连续灌胃12d;分别在第6、12天将各组小鼠称重后断尾取血送检,第6天取血1h后所有小鼠送云南省肿瘤医院放疗中心一次性全身照射6Gy的X射线(加速器输出剂量率600mu/min);在第18天将各组小鼠称重后股静脉取血送检,然后颈椎脱臼处死小鼠,取骨髓测定骨髓DNA含量、骨髓有核细胞数。
2.4 观察指标
2.4.1 体重 所有小鼠采用电子天平称重并记录结果。
2.4.2 血象分析 每次取血约250μL,滴入抗凝管中,送云南省肿瘤医院检验科,测定静血中的RBC、WBC、PLT、血红蛋白含量。
2.4.3 骨髓DNA含量测定 颈椎脱臼处死小鼠,解剖小鼠取左侧股骨,除净肌肉组织,用5mmol/L CaCl210ml将全部骨髓冲入离心管中,4℃冰箱放置30min,然后 2500r/min离心 15min,弃上清液。沉淀中加入5ml 0.2mol/L HClO4,将沉淀物充分混匀,90℃水浴加热15min,冷却过滤,滤液用 UV-190型分光光度计在268nm处测定吸光度A值[2],按下列公式计算每根股骨所含DNA(ug):DNA(ug)=40×50×A268。
2.4.4 骨髓有核细胞计数 颈椎脱臼处死小鼠,解剖小鼠取右侧股骨,除净肌肉组织,用7号针头刺穿股骨末端,再用10mlRPMI-1640液冲洗骨髓,直至股骨冲为白色为止(10遍以上),将冲出的骨髓液通过4号针头过滤待用,取0.5ml4%乙酸及0.5ml骨髓液于另一试管中混匀,放置2min再次混匀,然后取少许滴入计数板,在显微镜下常规计数有核细胞[3],有核细胞数(ml)=4个大方格有核细胞总数/4×104×稀释倍数。
2.5 辐射条件及剂量 云南省肿瘤医院放疗中心瓦里安直线加速器6MV-X射线,给予各照射组小鼠一次全身照射剂量6Gy。
3 结果
3.1 山楂醇提物对辐射损伤小鼠体重影响
表1显示,给药前各组体重差异无统计学意义(P>0.05)。给药5d后,各组体重均有不同程度的增加,但差异无统计学意义(P>0.05);给药 +照射5d后,control组体重继续增加,而各照射组体重较前下降,IR组与 control组比较明显下降(P<0.05),但各给药+IR组与IR组差异无统计学意义(P>0.05)。照射12d后,control组体重继续增加,IR组体重变化不大,各给药+IR组体重出现明显回升,其中以HD+IR组最为明显;IR组与 control组比较明显下降(P<0.05),各给药+IR组与IR组比较明显上升(P<0.05)。
表1 不同时间段各组体重变化(±s,g)
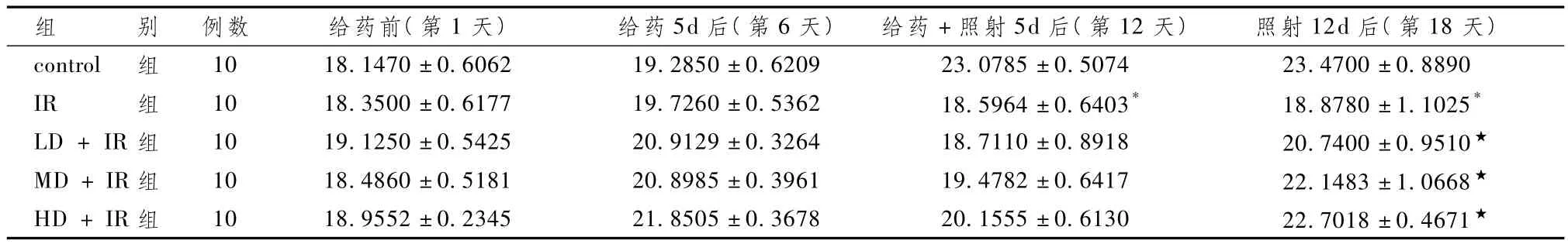
表1 不同时间段各组体重变化(±s,g)
注:与control组比较:*P<0.05;与IR组比较:★P<0.05
组 别 例数 给药前(第1天)给药5d后(第6天)给药+照射5d后(第12天)照射12d后(第18天).5074 23.4700±0.8890 IR 组 10 18.3500±0.6177 19.7260±0.5362 18.5964±0.6403* 18.8780±1.1025*LD+IR组 10 19.1250±0.5425 20.9129±0.3264 18.7110±0.8918 20.7400±0.9510★MD+IR组 10 18.4860±0.5181 20.8985±0.3961 19.4782±0.6417 22.1483±1.0668★HD+IR组 10 18.9552±0.2345 21.8505±0.3678 20.1555±0.6130 22.7018±0.4671 control 组 10 18.1470±0.6062 19.2850±0.6209 23.0785±0★
3.2 山楂醇提物对辐射损伤小鼠白细胞影响
表2显示,给药前各组白细胞差异无统计学意义(P>0.05)。给药5d后,各组白细胞均有不同程度的增加,但亦差异无统计学意义(P>0.05);给药+照射5d后,control组白细胞无明显变化,而各照射组白细胞较前急剧下降,IR组与control组比较显着下降(P<0.01),但各给药+IR组与IR组下降差异无统计学意义(P>0.05);照射12d后,control组白细胞仍无明显变化,IR组白细胞较前继续下降,各给药+IR组白细胞较前亦继续下降,但程度较IR组趋缓,其中以HD+IR组降幅最小,IR组与control组比较显着下降(P<0.01),但各IR+给药组与 IR组下降比较差异无统计学意义(P>0.05)。
表2 不同时间段各组白细胞变化(±s,×109/L)
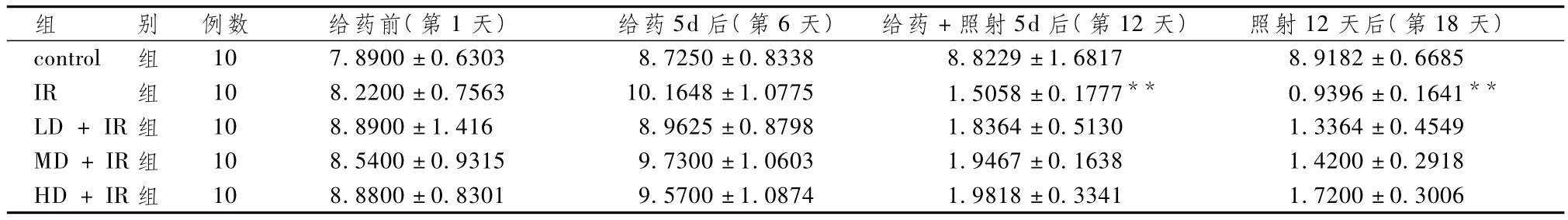
表2 不同时间段各组白细胞变化(±s,×109/L)
注:与 control组比较:**P <0.01
组 别 例数 给药前(第1天)给药5d后(第6天)给药+照射5d后(第12天)照射12天后(第18天)control 组 10 7.8900±0.6303 8.7250±0.8338 8.8229±1.68 41 1.7200±0.3006 17 8.9182±0.6685 IR 组 10 8.2200±0.7563 10.1648±1.0775 1.5058±0.1777** 0.9396±0.1641**LD+IR组 10 8.8900±1.416 8.9625±0.8798 1.8364±0.5130 1.3364±0.4549 MD+IR组 10 8.5400±0.9315 9.7300±1.0603 1.9467±0.1638 1.4200±0.2918 HD+IR组 10 8.8800±0.8301 9.5700±1.0874 1.9818±0.33
3.3 山楂醇提物对辐射损伤小鼠红细胞的影响
表3显示,给药前各组红细胞差异无统计学意义(P>0.05)。给药5d后,各组红细胞均有不同程度的增加,但差异无统计学意义(P>0.05);给药+照射5d后,control组红细胞继续增加,而各照射组红细胞较前下降,IR组与 control组比较明显下降(P<0.05),但各给药+IR组与IR组下降差异无统计学意义(P>0.05);照射12d后,control组红细胞无明显变化,IR组红细胞较前继续下降,各给药+IR组红细胞较前亦继续下降,但程度较IR组趋缓,其中以HD+IR组降幅最小,IR组与control组比较明显下降(P<0.05),但各给药+IR组与IR组下降比较差异无统计学意义(P>0.05)。
表3 不同时间段各组红细胞变化(±s,×1012/L)

表3 不同时间段各组红细胞变化(±s,×1012/L)
注:与 control组比较:*P<0.05
组 别 例数 给药前(第1天)给药5d后(第6天)给药+照射5d后(第12天)照射12天后(第18天)control 组 10 7.9270±0.3156 9.2862±0.2695 10.2850±0.3 86 7.4582±0.3960 237 10.4691±0.2418 IR 组 10 8.3200±0.3472 9.1863±0.2525 8.2500±0.3899* 6.7062±0.3816*LD+IR组 10 7.2960±0.3189 9.2587±0.1939 8.2620±0.4788 6.7460±0.4134 MD+IR组 10 7.9040±0.4268 9.2680±0.2410 8.3373±0.2347 7.1655±0.3925 HD+IR组 10 8.0700±0.5078 9.2280±0.2086 8.3836±0.51
3.4 山楂醇提物对辐射损伤小鼠血小板影响
表4显示,给药前各组血小板差异无统计学意义(P>0.05)。给药5d后,各组血小板数较前均增加,但差异无统计学意义(P>0.05);给药+照射5d后,control组血小板继续增加,而各照射组血小板较前下降,IR组与control组比较明显下降(P<0.05),但各给药+IR组与IR组差异无统计学意义(P>0.05);照射12d后,control组血小板无明显变化,各照射组血小板较前继续下降,但各给药+IR组血小板下降程度较IR组趋缓,其中以HD+IR组降幅最小,IR组与control组比较显着下降(P<0.01),而各给药+IR组与IR组下降比较,差异无统计学意义(P>0.05)。
表4 不同时间段各组血小板变化(±s,×109/L)
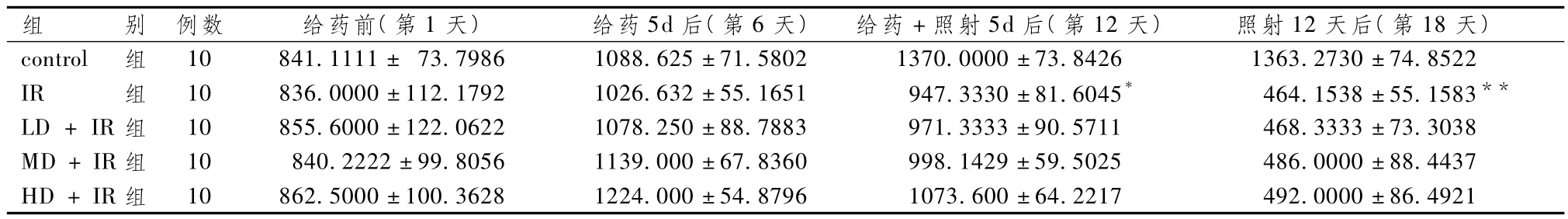
表4 不同时间段各组血小板变化(±s,×109/L)
注:与 control组比较:*P <0.05,**P<0.01
组 别 例数 给药前(第1天)给药5d后(第6天)给药+照射5d后(第12天)照射12天后(第18天)control 组 10 841.1111± 73.7986 1088.625±71.5802 1370..600±64.2217 492.0000±86.4921 0000±73.8426 1363.2730±74.8522 IR 组 10 836.0000±112.1792 1026.632±55.1651 947.3330±81.6045* 464.1538±55.1583**LD+IR组 10 855.6000±122.0622 1078.250±88.7883 971.3333±90.5711 468.3333±73.3038 MD+IR组 10 840.2222±99.8056 1139.000±67.8360 998.1429±59.5025 486.0000±88.4437 HD+IR组 10 862.5000±100.3628 1224.000±54.8796 1073
3.5 山楂醇提物对辐射损伤小鼠血红蛋白含量的影响
表5显示,给药前各组血红蛋白含量差异无统计学意义(P>0.05)。给药5d后,各组血红蛋白含量均有不同程度的增加,但亦差异无统计学意义(P>0.05);给药 +照射5d后,control组血红蛋白含量变化不明显,而各照射组血红蛋白含量较前急剧下降,其中以IR组血红蛋白含量下降最为明显,IR组与control组比较显着下降(P<0.01),LD+IR组与IR组下降差异无统计学意义(P>0.05),但 MD+IR组和HD+IR组与IR组比较明显上升(P<0.05);照射12d后,control组血红蛋白含量仍无明显变化,各照射组血红蛋白含量较前有所回升,其中以HD+IR组最为明显,IR组与control组比较显着下降(P<0.01),LD+IR组与 IR组比较差异无统计学意义(P>0.05),但MD+IR组和HD+IR组与IR组比较明显上升(P<0.05)。
3.6 山楂醇提物对辐射损伤小鼠骨髓DNA含量、骨髓有核细胞数的影响
表6显示,照射12d后,IR组骨髓 DNA含量与control组比较明显下降(P<0.05),各给药+IR组骨髓DNA含量与IR组比较明显上升(P<0.05)。照射12d后,IR组骨髓有核细胞数与control组比较明显下降(P<0.05),LD+IR组骨髓有核细胞数与IR组比较差异无统计学意义(P>0.05),但MD+IR组和HD+IR组与IR组比较明显上升(P<0.05)。
表5 不同时间段各组血红蛋白含量变化(±s,g/L)

表5 不同时间段各组血红蛋白含量变化(±s,g/L)
注:与 control组比较:**P<0.01;与 IR组比较:★P<0.05
组 别 例数 给药前(第1天)给药5d后(第6天)给药+照射5d后(第12天)照射12天后(第18天)control 组 10 138.6000±5.7295 159.0000±4.4234 158.0000±4.1763 156.5455± 2.9057 IR 组 10 143.4000±5.2328 158.4211±4.5642 93.8000±5.9345** 95.2000± 5.4259**LD+IR组 10 126.8000±4.9008 160.8750±3.4252 99.0000±4.4240 104.0000±11.3666 MD+IR组 10 138.2000±7.7371 158.3000±3.7396 119.5714±2.4556★ 124.0000± 6.3509★HD+IR组 10 137.2000±6.9167 160.2000±3.6213 123.1111±7.2274★ 129.7778± 8.1816★
表6 不同剂量组照射12天后骨髓DNA含量、有核细胞计数比较(±s)
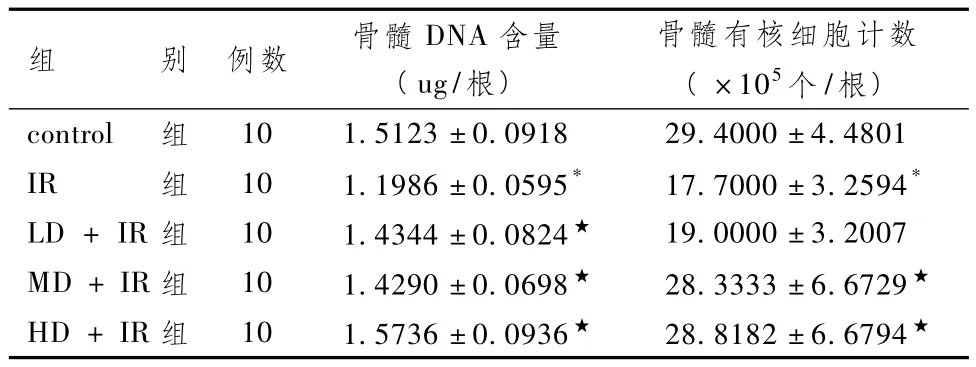
表6 不同剂量组照射12天后骨髓DNA含量、有核细胞计数比较(±s)
注:与control组比较:*P<0.05;与IR组比较:★P<0.05
组 别 例数 骨髓DNA含量(ug/根)骨髓有核细胞计数( ×105个/根)control 组10 1.5123±0.0918 29.4000±4.4801 IR 组 10 1.1986±0.0595* 17.7000±3.2594*LD+IR组 10 1.4344±0.0824★ 19.0000±3.2007 MD+IR组 10 1.4290±0.0698★ 28.3333±6.6729★HD+IR组 10 1.5736±0.0936★ 28.8182±6.6794★
4 讨论
国内对于中药作为放射防护剂的研究,从20世纪50年代后期开始。中草药具有药源广、毒性低等优点,许多中草药具有抑制自由基的产生、增强自身的抗氧化能力、提高机体的免疫功能、保护造血系统、减轻DNA损伤、增强DNA修复等功能。特别是日本和韩国在开发抗辐射天然药物方面取得了可喜的成绩,如人参、灵芝、当归、白芍药、川芎、四物汤等,由于疗效确切、无毒且能增强人体免疫力,有较好的实际应用前景。
近代药理研究发现[4,5],山楂提取物中含有多种黄酮类和三萜类(山楂酸、熊果酸、齐敦果酸、苦杏仁甙、槲皮素、皂甙等)活性成分,还有苹果酸、柠檬酸等多种果酸及较多维生素成分,其中大部分成分具有抗氧化作用。其中黄酮能促进超氧化物歧化酶(SOD)活性,降低细胞脂质过氧化物的生成,对羟自由基所致的多种细胞损伤都有不同程度的保护作用[6];三萜类活性成分中的皂甙能抑制钙通道,显着抑制黄嘌呤,即次黄嘌呤氧化酶所致的自由基增多,还能明显抑制血清及肾皮质的脂质过氧化,并提高两者的 SOD和谷胱苷肽过氧化物酶活性[7,8];槲皮素有清除O2、OH和单线态氧等活性氧的能力,能有效保护生物膜免受自由基的损害[9]。
本研究采用经典动物模型实验,对昆明种小鼠在天然药物山楂醇提物低剂量1.25g/kg/d、中剂量2.5g/kg/d、高剂量5g/kg/d灌胃下,接受 6Gy的 X射线一次全身照射后,观察受试药物不同剂量对照射小鼠的体重、外周血象、骨髓DNA含量及有核细胞计数、脾集落形成和胸腺、脾指数的影响;发现不同剂量的山楂醇提物组与IR组比较,各给药+照射组的体重、血红蛋白、骨髓DNA含量、骨髓有核细胞数明显升高,2组存在统计学差异,其中均以HD(高剂量)+IR组升高最为明显;外周血中 RBC、WBC、PLT比较,各照射组之间差异无统计学意义,但随给药剂量的增加,各给药+照射组的上述指标较IR组均有递增趋势。实验结果表明,山楂醇提物具有增加辐射损伤小鼠体重、显着升高照射后小鼠血红蛋白、骨髓DNA含量、骨髓有核细胞数的作用。本研究与国内外报道[10,11]山楂提取物注入小鼠腹腔能有效保护辐射后小鼠的骨髓损伤,促进外周血白细胞、血小板数的恢复有类似的研究结果。这与山楂的健脾、开胃及其成分中的抗氧化活性物质能有效清除辐射产生的各种自由基、保护细胞生物膜的正常代谢作用有关。在本实验各照射组之间的外周血象差异无统计学意义,这可能与小鼠所受照射剂量及剂量率过大、成熟血细胞破坏后造血干细胞分裂延迟、释放减少有关。但各剂量+照射组亦有随剂量增加而血细胞增多的趋势,其中以大剂量组效果最为明显。有关山楂醇提物对辐射保护的作用机制、作用靶点、有效成分、剂量及用药最佳时机都有待进一步深入研究。
[1]国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2005:22.
[2]王舟,曾令福,肖元梅,等.绿茶抗辐射损伤作用研究[J].四川大学学报(医学版),2003,34(2):303-305.
[3]Nunia V,Goyal P K.Prevention of gamma radiation induced anaemia in mice by diltiazem[J].J Radiat Res,2004,45(1):11-17.
[4]孙敬勇,杨书斌,谢鸿霞,等.山楂化学成分研究[J].中草药,2002,33(6):483-486.
[5]Flavaban NA.Atherosclerosis or lipoprotein induced-endothelial dysfunction[J].Circulation,1992,927-938.
[6]汪德清,沈文梅,田亚平,等.黄芪总黄酮对羟自由基所致哺乳动物细胞损伤的防护作用[J].中国中药杂志,1995,20(4):240-244.
[7]王晓明,孙成文.人参皂甙对心肌作用的单钙通道分析及ESR 谱研究[J].中国中药杂志,1994,19(104):621-624.
[8]潘鑫鑫,郑卫红,傅万玉,等.人参皂甙抗衰老作用的实验研究[J].中国老年学杂志,1995,15(5):288-290.
[9]方若莹,方国明,俞越汉,等.茶多酚和槲皮素对全血吞噬细胞产生活性氧的抑制作用[J].浙江大学学报,1998,32(2):163-167.
[10]Seyed Jalal H,and Mohammad A.(2007)Radioprotective effects of hawthorn fruit extract against gamma irradiation in mouse bone marrow cells[J].Radiat Res,48:63-68.
[11]刘建波,李文辉,徐进彦,等.山楂醇提物腹腔注射对辐射损伤小鼠保护作用的研究[J].中国辐射卫生,2009,18(1):22-23.



