武双平,贺治青,袁国强,王永恒,梁 春
(1.河北以岭医院,石家庄 050091;2.第二军医大学附属上海长征医院,上海 200003)
内皮祖细胞(human endothelial progenitor cells, hEPCs)作为内源性血管修复的重要介导细胞[1, 2],其作用和调控分化等生理特性一直是人们研究的热点,从他汀类药物的促hEPCs动员到在体捕获hEPCs促进支架内再内皮化的新型支架系统的问世[3],无不彰显hEPCs在动脉粥样硬化相关血管病变损伤后修复的重要作用,但在糖尿病等病理环境中hEPCs的功能和状态发生改变。我们前期的研究证实,糖尿病的重要致病因素——晚期糖基化终产物(advanced glycation end products, AGEs)可通过激活RAGE-MAPK信号通路导致hEPCs功能异常,上述病理作用可部分被通心络(tongxinluo, TXL)所阻断。而现有大量研究证据提示,除了自身增殖、迁移和分泌功能,内皮分化是其hEPCs介导内源性血管修复的另一重要生理基础[4]。因此,本研究旨在观察TXL对AGEs诱导的hEPCs内皮分化异常的保护作用及其相关分子机制。
1 材料与方法
1.1 主要试剂和材料
通心络超微粉由石家庄以岭药业公司提供;淋巴细胞分离液、FITC标记荆豆凝集素(FITC-UEA-1)及MAPK信号通路激动剂购自美国Sigma公司;蛇皮透析膜、超滤管、Accutase酶和人纤连蛋白均购自美国Millipore公司;RAGE抗体、Taqman荧光探针、定量PCR试剂、胎牛血清和Dil标记的乙酰化低密度脂蛋白(Dil-acLDL)购自美国Life公司;内毒素检测鲎试剂购自厦门市鲎试剂实验厂有限公司;流式细胞抗体购自美国Biolegend公司;EGM-2培养基及核电转试剂购自德国Lonza公司。
1.2 外周血hEPCs的分离培养和鉴定
取健康志愿者外周血50 ml,经密度差异离心分离外周血单个核细胞,种植于预先包被人纤连蛋白的10 cm大皿中,给予EGM2培养基培养,培养21 d后可见hEPCs呈鹅软石样增殖,分别通过FITC标记荆豆凝集素Ⅰ(FITC-UEA-Ⅰ)和Dil标记的乙酰化低密度脂蛋白Dil-ac-LDL以及流式细胞鉴定其纯度。
1.3 晚期糖基化终产物制备
取人血清白蛋白,将其按照1 mg/ml浓度与葡萄糖溶液混匀后共置于37℃细胞孵箱中,按照文献报告共孵育60 d,孵育结束后通过过夜透析方法去除葡萄糖,并经超滤浓缩分装于-80℃冰箱备用。
1.4 干预分组
分为对照组、AGEs干预组(200 μg/ml)、TXL干预组(250、500、750 μg/ml,溶于DMSO中,并经鲎实验内毒素检测阴性)、TXL预先干预30 min后再给予AGEs刺激组、RAGE过表达+TXL+AGEs干预组以及MAPK信号通路激动剂(预先激动30 min)+TXL+AGEs干预组。
1.5 hEPCs过表达RAGE
使用Accutase酶(美国ebioscience公司)消化贴壁细胞,将其与携带GFP荧光标记的过表达RAGE受体的质粒以及配套核电转试剂混匀,按照仪器使用说明经Nucleofector核电转仪(德国amaxa公司)转染,转染3 d后经流式细胞仪鉴定转染效率,同时蛋白电泳分析RAGE过表达水平。
1.6 hEPCs的体外内皮分化评估
使用Accutase酶消化收集贴壁细胞,种植于预先准备好的matrigel胶(美国BD公司)并给予不同干预,置于37℃度细胞孵箱中培养,培养2 h后倒置显微镜下观察并拍照,使用Image J软件分析体外管型形成水平,从而反映hEPCs体外内皮化程度。此外,干预结束后使用trizol抽取细胞mRNA,采用Taqman探针法经荧光定量PCR分析细胞表达vWF水平,每组实验重复4次。
1.7 统计学方法
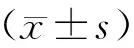
2 结果
2.1 hEPCs鉴定
体外培养21 d后的hEPCs镜下呈鹅软石样排布,经Accutase酶消化后能够稳定传代,同时FITC-UEA-1和Dil-acLDL双染色阳性,流式细胞分析证实细胞高表达CD34、CD73、CD105、CD146,但KDR、CD14、CD45和HLA-DR阴性,提示成功获得人外周血来源EPCs可用于后续实验。
2.2 TXL促进hEPCs体外内皮分化
给予不同浓度的TXL干预hEPCs,发现TXL可显着提高hEPCs内皮分化程度,表现为体外管型形成能力增强,同时vWF表达水平显着升高(图1A-C),以500 μg/ml作用最为显着,进一步提高浓度并不能增强其促内皮分化的作用(P<0.05),故此后续实验使用该浓度作为TXL的干预剂量。

图1 TXL对hEPCs体外内皮分化的影响注:与对照组比较:*P<0.05;与250μg/ml TXL干预组比较:†P<0.05
2.3 TXL通过RAGE-MAPK信号通路介导拮抗AGEs介导的hEPCs内皮分化异常
200 μg/ml的AGEs可显着抑制hEPCs的体外内皮分化,该病理作用可被预先TXL干预30 min所部分阻断之前的研究表明,RAGE-MAPK信号通路的激动参与了AGEs的病理作用,因此通过预先过表达RAGE或给予MAPK信号通路激动剂(ERK激动剂叔丁基氢醌或p38 MAPK激动剂U-46619)处理hEPCs,观察上述信号通路对于TXL保护作用的影响发现,预先激动上述信号通路明显减弱TXL的保护作用(图2),提示TXL是通过下调RAGE-MAPK信号通路进而拮抗AGEs诱导hEPCs内皮分化异常。
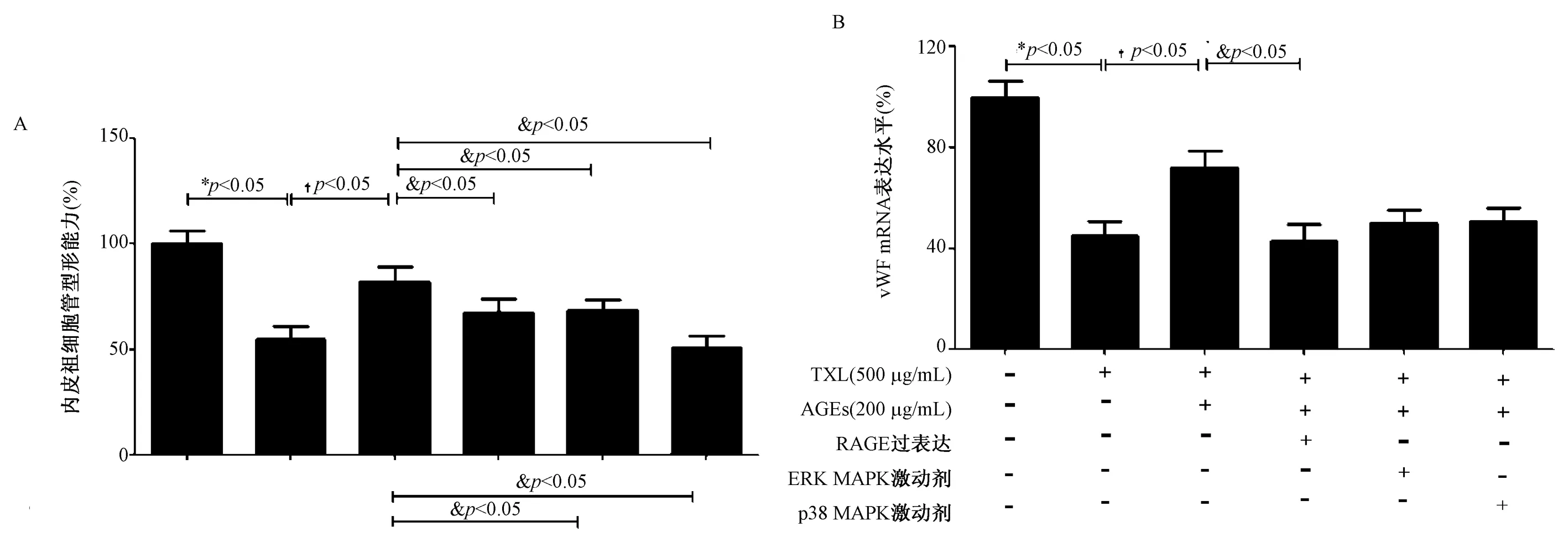
图2 TXL经RAGE-MAPK信号通路拮抗AGEs诱导hEPCs体外内皮分化异常注:与对照组比较:*P<0.05;与200μg/ml AGEs干预组比较:†P<0.05;与500 μg/ml TXL+200 μg/ml AGEs干预组比较:&P<0.05
3 讨论
通心络作为一种可显着抑制动脉粥样硬化斑块进展的复方中药,已在临床广泛应用。通心络由人参、水蛭、土鳖虫、全蝎、蜈蚣、蝉蜕、降香、冰片等药物组成,具有益气活血、通络止痛的功效。现代药理研究表明,人参具有抗氧化和改善血管内皮功能作用,水蛭具有抗凝和降血脂作用,全蝎、蜈蚣、蝉蜕则具有改善血管内皮功能、解除血管痉挛的作用。大量研究证实,通心络可通过多种途径延缓动脉粥样硬化斑块进展,其中包括促进泡沫细胞胆固醇逆转运、加快损伤内皮修复和抑制氧化应激反应等[5~7]。我们前期的研究证实,通心络可显着提高体外内皮祖细胞的增殖、迁移和分泌功能,其作用呈剂量依赖性[8]。同时临床研究也发现,通心络可提高冠心病患者外周血内皮祖细胞含量[9]。除上述功能外,内皮分化是内皮祖细胞介导内源性血管损伤后修复的重要机制之一,因此本研究着重评估通心络对于内皮祖细胞的体外内皮分化作用及其机制。
糖尿病作为冠心病的等危症,中医学将其称为“消渴症”,主要症状是口渴、多饮、多食、多尿等,其发病率呈逐年升高趋势。尤以我国发病人群为重,呈现发病年龄提早和临床控制率差等诸多问题,其血管病变较单纯冠心病患者更为弥散且稳定性差等临床特点,是现阶段严重危害人民群众身心健康的重大社会问题。糖尿病导致血管损伤的致病因素除外血糖,晚期糖基化终产物也是不可忽视的病因,特别是随着检测技术的不断进步,大量研究证实,AGEs的病理作用较高血糖持续时间更长,可从多种机制引发细胞和组织功能异常。我们的前期研究证实,AGEs可导致内皮祖细胞凋亡、增殖降低,该病理作用主要是通过异常激活RAGE-MAPK信号通路实现的[10],TXL可部分拮抗AGEs的病理作用[11]。
本研究证实,TXL自身既可显着提高内皮祖细胞的体外内皮分化,同时还可通过下调RAGE-MAPK信号通路对抗AGEs诱导的内皮分化异常,这可能是TXL发挥抗糖尿病血管动脉粥样硬化的新机制之一。现今冠心病的治疗策略已有单纯溶栓和药物干扰全面进入支架时代,而在支架时代如何降低支架内血栓形成成为当务之急,由此人们开发了药物涂层支架,但随之而来又出现了支架内内皮延迟愈合等问题。基于内皮祖细胞可在体动员并在损伤血管局部分化的生物学特性,内皮祖细胞捕获支架在临床应用中取得较好的疗效[12~14],但该支架存在费用较高等问题。由本研究的结果是否可以猜测TXL可加速裸金属支架或者药物涂层支架内皮覆盖,从而从根本上降低支架内管腔丢失,这方面仍需进一步的临床深入研究。
[1] Castejon R, Jimenez-Ortiz C, Valero-Gonzalez S,et al. Decreased circulating endothelial progenitor cells as an early risk factor of subclinical atherosclerosis in systemic lupus erythematosus[J]. Rheumatology,2014, 53:631-638.
[2] Ruan C, Shen Y, Chen R, et al. Endothelial progenitor cells and atherosclerosis[J]. Frontiers in Bioscience,2013, 18:1194-1201.
[3] Ho HH, Chow WH, Ko LY, et al. Successful use of endothelial progenitor cell capture stent for treatment of left main coronary artery disease before non-cardiac surgery for abdominal aortic aneurysm[J]. International Journal of Cardiology,2010, 143:e27-29.
[4] Zhang L, Xu Q. Stem/Progenitor cells in vascular regeneration[J]. Arteriosclerosis, thrombosis, and vascular biology,2014, 34:1114-1119.
[5] Chen ZQ, Hong L, Wang H.Effect of tongxinluo capsule on platelet activities and vascular endothelial functions as well as prognosis in patients with acute coronary syndrome undergoing percutaneous coronary intervention[J].Chinese journal of integrated traditional and Western medicine,2011, 31:487-491.
[6] Guan QG, Zeng DY, Sun XZ.Inhibitory effect and acting mechanism of Tongxinluo on IL-1beta-mediated coronary intimal hyperplasia and 5-hydroxytryptamine-induced coronary vasospasm in small swine[J]. Chinese journal of integrated traditional and Western medicine,2008, 28:627-631.
[7] 梁小卫, 孙承波, 王华, 等. 通心络体外促进人外周血内皮祖细胞的增殖[J]. 第二军医大学学报,2007, 6:598-601.
[8] 苗旺, 刘恒方, 杨期东, 等. 通心络对颈动脉粥样硬化斑块患者内皮祖细胞增殖能力的影响[J]. 中国实用神经疾病杂志,2010, 15:44-45.
[9] Sun C, Liang C, Ren Y, Zhen Y, et al. Advanced glycation end products depress function of endothelial progenitor cells via p38 and ERK 1/2 mitogen-activated protein kinase pathways[J]. Basic research in cardiology,2009, 104:42-49.
[10] 孙承波, 梁春, 吴宗贵, 等. 通心络对晚期糖基化终产物诱导的内皮祖细胞存活的影响及其机制[J]. 上海医学,2008, 10:711-714.
[11] Tan A, Farhatnia Y, Goh D, et al. Surface modification of a polyhedral oligomeric silsesquioxane poly(carbonate-urea) urethane (POSS-PCU) nanocomposite polymer as a stent coating for enhanced capture of endothelial progenitor cells[J]. Biointerphases,2013, 8:22.
[12] Yu Z, Zhu H, Lu S, et al. Accelerated endothelialization with a polymer-free sirolimus-eluting antibody-coated stent. Journal of materials science[J]. Materials in medicine,2013, 24:2601-2609.
[13] Haude M, Lee SW, Worthley SG, et al. The REMEDEE trial: a randomized comparison of a combination sirolimus-eluting endothelial progenitor cell capture stent with a paclitaxel-eluting stent. JACC[J]. Cardiovascular interventions,2013, 6:334-343.
[14] Scacciatella P, D’Amico M, Pennone M, et al. Effects of EPC capture stent and CD34+ mobilization in acute myocardial infarction[J]. Minerva cardioangiologica,2013, 61:211-219.



