杨 梦胡志希△李 琳钟森杰姚 涛程 彬邱 宏
(1. 湖南中医药大学中医学院,长沙 410208; 2. 湖南中医药大学国家重点学科中医诊断学 湖南省重点实验室,长沙 410208)
慢性心力衰竭(简称心衰)是多种疾病(冠心病、高血压等)的终末期阶段,其发病率高、预后差,病死率高达40%,是心血管疾病死亡的重要原因[1]。代谢组学作为系统生物学的重要分支,具有整体、动态、综合分析的特点,其系统研究思路与中医证候的整体论和系统观相契合,因此可作为研究高血压心衰中医证候本质的切入点[2]。本研究基于UPLC-MS代谢组学技术对高血压心衰心气阴虚证大鼠的尿液代谢物进行研究,探讨该模型大鼠尿液整体代谢物水平的变化规律,从小分子代谢产物角度阐释该模型的证候本质及为临床诊治提供客观化参考。
1 实验材料
1.1 实验动物
选取盐敏感(Dahl/SS)雄性大鼠13只,6周龄,体质量(220±10)g,由北京维通利华实验动物有限公司提供,许可证号SCXK(京)2016-0006,动物合格证号43004700037714。每笼饲养大鼠3只,饲养于湖南中医药大学实验室中心SPF级实验室,室温维持在23~25 ℃,光照12 h的房间/黑暗周期,自由饮水。该实验方案已通过湖南中医药大学实验动物伦理委员会审查(20170906)。
1.2 主要试剂与仪器
大鼠N端前脑钠肽(NT-proBNP)ELISA试剂盒,CUSABIO公司产品(货号CSB-E08752 r);L-2-氯苯丙氨酸标准品,上海恒创生物科技有限公司;乙腈、甲醇、甲酸、水,均为上海安谱实验科技股份有限公司,所有化学药品及溶剂均为分析纯或色谱级。彩色多普勒超声诊断仪(SonoScape-S2N型),深圳开立科技有限公司;小动物无创血压测量仪(CODA型);美国Kent Scientific 公司;高分辨质谱仪(Xevo G2-XS QTof)、高效液相色谱仪(ACQUITY UPLC)、色谱柱(ACQUITY UPLC BEH C18 (100×2.1 mm,1.7 μm),均为Waters有限公司。
2 方法
2.1 模型制备
本课题组前期通过高盐饲料(8%氯化钠浓度)喂养Dahl/SS盐敏感大鼠20周的方法建立高血压心衰模型,并以“以方测证”法验证所属中医证型为心气阴虚证,另通过低盐饲料(0.3%氯化钠浓度)喂养建立正常大鼠模型[3]。本研究选取前期制备的心气阴虚证大鼠(7只)和正常大鼠(6只)进行代谢组学研究。
2.2 观察指标及方法
2.2.1 血压检测 采用小动物无创血压测量仪,每月检测1次大鼠鼠尾血压的变化,并观察大鼠的行为和体征。
2.2.2 超声心动图和血清NT-proBNP检测 运用彩超仪测量左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD),取得3个心动周期的平均值,并按照Teichholtz公式计算左心室射血分数(LVEF)及左室短轴缩短率(LVFS)。随后以酶联免疫吸附测定法(ELISA)测定血清 NT-proBNP 的含量。
2.3 尿液代谢组学分析
2.3.1 尿液样本采集与制备 模型验证后,所有大鼠放置于代谢笼,采集24 h尿液,4℃2000 r/min离心10 min,沉淀杂质提取上清,-80 ℃保存。检测时室温解冻尿液,预处理方法依据前期文献[4]。
2.3.2 LC-MS分析条件 采用沃特世ACQUITYUPLC超高效液相串联XevoG2-XSQTof高分辨质谱仪组成的液质联用系统。色谱柱条件:ACQUITYUPLCBEHC18(100 mm×2.1 mm,1.7 μm)用于色谱分析,柱温保持在45 ℃,流速为0.4 mL/min,进样量5 μL。流动相A为水(含0.1%甲酸),B为乙腈(含0.1%甲酸)(梯度洗脱程序见表1)。样品质谱信号采集分别采用ESI正负离子扫描模式。相关参数设置:正离子模式毛细管电压为3kv,负离子为-2 kV,取样锥为40 V,震源偏移为80 V,源温度为120 ℃,脱溶温度为450 ℃,脱溶气流量为800 L/h;锥形气流为50 L/h,质量范围为50~1000 amu,扫描时间为0.1 s,碰撞能量(低能量)为6,坡道碰撞能量(高能)为20~35,扫描类型MSEcentroid。

表1 洗脱梯度程序比较
2.4 数据处理
从UPLC-TOF/MS分析仪采集的信号和质谱数据导出后,利用ProgenesisQIv2.3软件对数据进行基线过滤、峰识别、峰对齐和归一化等预处理,得到一个由代谢物的保留时间、离子模式和质核比等组成的二维数据矩阵。将数据矩阵导入SIMCA14.0软件(瑞典UmetricsAB公司的主成分分析法(principal component analysis,PCA),偏最小二乘法分析(partial least squares-discriiminate analysis,PLS-DA)及正交偏最小二乘法分析法(orthogonal partial least squares method,OPLS-DA)进行模式识别分析,筛选差异性代谢物。选取OPLS-DA模型第一主成分变量权重值(variable important in projection,VIP)>1的代谢物有重要贡献的变量,结合单因素方差分析结果寻找差异代谢物。
2.5 统计学方法

3 结果
3.1 各组大鼠血压比较
每月使用小动物无创血压测量仪检测大鼠鼠尾血压的变化,发现模型组喂食高盐饲料1个月后,其鼠尾血压值(收缩压、舒张压)高于正常组,收缩压高于160 mmHg,舒张压则高于100 mmHg,连续喂养4个月后模型组大鼠收缩压已达到190 mmHg以上,已成高血压模型;而正常组连续喂养5个月收缩压基本维持在120 mmHg左右,尚未成高血压模型(各组血压每月变化见图1图2)。

注:与正常组造模后比较:P<0.01;与模型组造模比较:P<0.01图1 各组大鼠血压收缩压监测图

注:与正常组造模后比较:P<0.01;与模型组造模比较:P<0.01图2 各组大鼠血压舒张压监测图
3.2 各组大鼠LVEF、FS和NT-proBNP比较
喂养20周后,模型组大鼠均出现心率增快、呼吸急促、体质量减轻等症状,随后对2组大鼠进行超声心动图检查和血清NT-proBNP含量检测。结果显示,与正常组比较,模型组LVEF、LVFS值显着下降,NT-proBNP值上升,差异有统计学意义,评定模型组大鼠成为心衰模型。
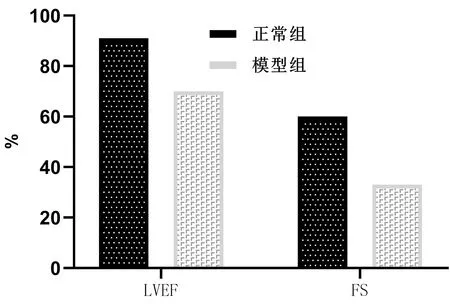
注:与正常组比较:P<0.01图3 各组大鼠LVEF、FS值比较

注:与正常组比较:P<0.01图4 各组大鼠NT-proBNP值
3.3 中医证型评价
根据课题组的国家自然科学基金课题研究结果发现,参麦注射液干预15 d后,对高血压心衰大鼠的治疗效果显着优于参附注射液,基于“以方测证”理论验证高血压心衰大鼠所属证型为心气阴虚证[3,5]。
本次研究在“以方测证”的基础上,观察模型大鼠的行为及体征情况,发现模型组自喂高盐饲料后,出现精神亢奋,抓时反抗剧烈,时有尾部、腿部出血等亢奋表现;后期模型组大鼠精神不振,蜷卧少动,体质量减轻,饮水量、尿量增多。参照1986年修订的[6]《中医虚证辨证参考标准》,通过以下表现情况对该模型大鼠的体征及行为进行评价:心率增快反映心悸症状,呼吸急促反映气短症状,精神萎靡、蜷缩懒动反映神疲乏力、少气懒言等症状,抓起反抗剧烈反映烦躁易怒症状,发现该模型大鼠较好地反映心气阴亏虚证的相关证候特点,与“以方测证”结果相符合,系列实验室指标均显示该模型能作为心气阴虚证动物模型进行研究。
3.4 LC-MS分析结果
采用代谢组学(UPLC-Q/TOF-MS)技术对正常组与模型组大鼠尿液进行分离与鉴别,得到基峰离子色谱图(base peak chromatogram,BPC)。从图5可知,正常组大鼠的BPC图在峰高度与保留时间与模型组大鼠不同,说明2组大鼠的内源性代谢物存在显着差异。
3.5 多元统计分析
通过采用无监督的主成分分析(PCA),以探寻组间聚类效果。PCA得分图显示,2组样本点基本处于椭圆形散点图(95%置信区间)内,在空间分布上明显分开且无交叉和重叠,表明模型大鼠和正常大鼠的代谢模式存在明显差异。随后采用偏最小二乘-判别分析(PLS-DA)及正交偏最小二乘法分析(OPLS-DA),PLS-DA得分图(见图6b)展示了2组之间有明显的分离情况,R2Y∶0.997,Q2∶0.933,两值均较为贴近1,反映拟合与预测能力较好。由图6c所示,OPLS-DA模型的可解释变量R2X、R2Y及可预测度(Q2)分别为0.769、0.999、0.949,说明该模型能很好地解释和预测2组样本之间的差异。同时为检测模型是否“过拟合”,故采取7次循环交互验证和200次响应排序检验法。图6示,截距R2和Q2值分别为0.964、-0.452,体现了模型的可靠性,说明基于LC-TOF/MS建立的OPLS-DA模型,能好地解释各组之间的差异。

注:正离子模式下:A.心气阴虚证心衰大鼠;B.正常组大鼠;负离子模式下;C.心气阴虚证大鼠;D.正常组大鼠图5 心气阴虚证心衰大鼠与正常大鼠LC-MS基峰图

注:蓝色正常组(正方形);紫色为模型组(三角形)。a为PCA图;b为PLS-DA图;c为OPLS-DA图;d 200次响应排序检验图图6 心气阴虚证心衰大鼠与正常组大鼠PCA、PLS-DA、OPLS-DA及200次响应排序检验图得分图
3.6 差异代谢物筛选结果
表2、3示,根据差异代谢物的质核比,通过仪器自带的快速鉴定系统(OSI/SMMS)结合HMDB(http:∥www.hmdb.ca/)和METLIN(http:∥metlin.scripps.edu)2个数据库来鉴定尿液差异代谢物,以VIP大于1且P值小于0.05为筛选条件,最终得到25种组间差异性代谢物。为更好地表明正常组与模型组之间的代谢物差异,将25种代谢物进行层次聚类分析。图7可以看出,2组之间差异代谢物可聚为两类,表明所筛选的代谢物合理。与正常组比较,模型组中的肌酸、肌醇、烟酸、尿苷、L-精氨酸、黄嘌呤等物质含量下降,泛酸、5-L-谷酰基-牛磺酸、脯氨酰基-苏氨酸等物质含量上升。

表2 心气阴虚证大鼠与正常大鼠间9种差异代谢物(ESI+)

表3 心气阴虚证大鼠与正常组大鼠间16种差异性代谢物(ESI-)
代谢组学立足于整体性关联指标, 从整体角度观察生物体中的内源性代谢物改变规律, 以把握与之关联的代谢网络变化特征。心气阴虚证是心衰的常见证候,常出现于心衰病程的早期或中期。慢性心力衰竭多因心肌能量生成不足或能量代谢障碍,导致基因表达异常而形成的一种超负荷心肌病[7]。机体心衰时,心肌缺血缺氧,心肌结构受损,伴随能量和底物代谢改变。本研究采用高通量的LC-MS非靶向技术,探讨高血压心衰心气阴虚证模型的尿液代谢组学特征,共挖掘出25种差异代谢物,主要涉及能量代谢、氨基酸代谢等多个层面。

图7 25种差异代谢物热图
4 讨论
4.1 能量代谢
首先,参与能量代谢的代谢物有泛酸、顺式-乌头酸、肌酸等。泛酸为乙酰辅酶A(COA)前体,涉及糖、蛋白质、能量代谢等多个层面,泛酸的高水平表达可增强CoA产生,进而参与三羧酸循环以供给能量[8]。模型组大鼠中泛酸的含量上升,可能是在心气阴虚证大鼠中,因心肌缺血导致能量代谢障碍, 大鼠会激活泛酸和CoA合成途径, 提高心肌的缺血适应能力,缓解心衰症状。三羧酸循环是糖、脂、氨基酸代谢的终端代谢路径, 亦为三者的联系纽带。以上研究结果提示,心气阴虚证心衰大鼠已经发生三大营养素的代谢异常。顺式-乌头酸为三羧酸循环的中间产物, 与机体的能量生成密切关联。肌酸可将线粒体中能量以磷酸肌酸形式转输至肌原纤维,供给所需的ATP[9]。模型组大鼠中肌酸、顺式-乌头酸明含量下降,说明心衰时心肌处于缺血状态,能量代谢途径受到损伤,导致产能减少,无法生成足够的ATP以供机体需要,从而加重心衰的进程。这可能与心气阴虚证心衰大鼠后期出现精神不振、蜷卧少动等有关。
4.2 氨基酸代谢
在已鉴定的25种差异代谢物中,氨基酸类的有1-甲基组氨酸、色氨酸、5-L-谷酰基-牛磺酸、犬尿酸等,说明心气阴虚证大鼠体内氨基酸代谢路径发生紊乱。1-甲基组氨为组氨酸代谢的产物,组氨酸在机体中经由酶催化后可产生组胺。组胺是一种强烈的血管扩张剂,可通过激活腺甘酸环化酶使体内cAMP的含量升高,提高心肌收缩力以增加血液供应,缓解心衰症状[10]。模型组中的1-甲基组氨含量降低,说明生成的组氨含量减少,不能发挥其扩血管作用,进一步损害心功能。这可能与心衰时心气阴亏虚,不能推动血液运行及化生血液、脉道不充、阴液不足有一定关联。
犬尿酸、3-脱氢奎尼酸、5-羟基吲哚酸是色氨酸代谢支路的最终产物。色氨酸属于必需氨基酸,其代谢的重要脏器为肾,体内约95%色氨酸在肾中经犬尿氨酸途径代谢,从而生成犬尿氨酸等产物[11]。临床研究证据显示,色氨酸通过cAMP导致膜电位超极化,从而与心衰危重状态密切关联[12]。本研究结果发现,模型组中犬尿酸、5-羟基吲哚乙酸的含量下降,推测心衰早期因气阴亏虚、气不能行血及生血,致肾脏气血灌注不足、肾失所养,最终导致肾络瘀滞,从而使色氨酸代谢发生紊乱。本次实验中还发现,4-吡多酸的变化,由于犬尿氨酸酶需要以维生素B6作为辅酶,故推测4-吡多酸参与心衰大鼠色氨酸代谢途径。
5- L-谷酰基-牛磺酸(5-L-Glutamyl-taurine)由牛磺酸通过γ-谷氨酰转肽酶产生。牛横酸是一种存在于多种组织(心肌等)中的游离氨基酸,经肝脏合成可抑制缺血性损伤引起的活性氧(ROS)异常增加,增强抗氧化酶的活性,调控炎症因子表达,并可维持细胞中Ca2+平衡,稳定细胞膜等[14]。本研究中模型对照组大鼠牛磺酸含量上升,说明牛磺酸代谢旺盛,能够抑制氧化应激反应,减轻炎症反应,以缓解心肌损伤程度[15]。
4.3 糖脂类代谢
糖脂类物质代谢方面,半乳糖经由代谢旁路还原为半乳糖醇或可氧化为半乳糖酸[16]。烟酸于生物体中转化为烟酰胺,后者与其他物质组成辅酶Ⅰ、辅酶Ⅱ,从而参加脂代谢、生物氧化、糖代谢等路径,该物质水平降低反映“烟酸-烟酰胺”代谢路径受抑制。LySoPE(0∶0/20∶0)、LysoPE(0∶0/14∶0)和LysoPE(0∶0/20∶4(5Z、8Z、11Z、14Z)均属于溶血磷脂酰乙醇胺,是磷脂代谢产物。研究表明,磷脂代谢紊乱与心肌组织的生理病理变化息息相关[17],其含量异常可推测心衰磷脂代谢发生紊乱。肌醇作为组织渗透剂,常与细胞内Ca2+浓度的调节及脂肪酸的氧化相关。模型组肌醇含量下降,提示体内能量代谢和脂质代谢紊乱[18]。
此外本研究发现,心衰的发生与嘧啶代谢、嘌呤代谢及儿茶酚胺生物合成相关。去甲肾上腺素为儿茶酚胺类产物,可促进血管收缩、兴奋心脏[19]。心气阴虚证组中的去甲肾上腺素含量减少,说明酪氨酸代谢发生紊乱,从而导致儿茶酚胺含量异常。其含量降低会影响其对心脏的调节作用,从而产生一系列病变,这与心气阴虚证患者出现心悸、神疲乏力、盗汗等症状及心功能异常有一定关联。腺嘌呤、黄嘌呤酸同属嘌呤类产物,其中黄嘌呤可在酶作用下生成尿酸,导致尿酸的高含量表达,这一系列改变为心血管疾病的危险因素。尿苷是嘧啶代谢的产物,可调控心肌能量代谢与抗氧化系统,发挥对心肌的保护作用[20-21]。心气阴虚证组中的尿苷含量下降,可能与心衰时导致心肌细胞受损,使细胞内RNA的合成受损,导致体内尿苷的含量下降。
本次研究利用LC-MS技术探讨高血压心衰心气阴虚证的生物学基础,筛选出25种差异性代谢物可能为该病证模型的生物标志物,通过分析与之相关的代谢途径,阐明与该病证相对应的代谢网络发生异常后物质和功能的改变,进一步为揭示该病证的生物学物质基础奠定基础。本研究为前瞻性实验,样本量较少,后续将在此基础上增加样本数,结合多种代谢组学检测手段进行相互验证,并可结合蛋白质组学、基因组学等现代研究技术进一步探讨该病证的生物学基础,以期为心衰的临床诊治提供实验指导。



