郭 琴, 张立石, 王 颖, 王欢欢, 柏 冬△
(1.中国中医科学院中医基础理论研究所, 北京 100700;2.陕西中医药大学,陕西 咸阳 712046)
溃疡性结肠炎(ulcerative colitis, UC)是一种常见的病因不明、反复发作的消化系统疾病,临床主要表现为腹痛、腹泻、体质量减轻、黏液脓血便等症状。随着全球经济的发展,UC逐渐从欧美发达国家地区蔓延至亚洲、南美和中东等新兴工业化国家地区[1],成为全球性疾病,被世界卫生组织列为现代难治病之一。
UC病变部位主要在结肠黏膜和黏膜下层,以局部溃疡病变为主,且呈连续弥漫性分布[2],表现为水肿、黏膜破坏、大量炎性细胞浸润和大面积出血等[3],炎性反应和免疫是UC最大的病理特征,而白介素(interleukin,IL)-1β[4]和环氧化酶(cyclooxygenase, COX)-2[5]均是与UC关系密切的重要细胞因子。因此本文测定了UC大鼠给药后的结肠质量长度比、IL-1β及COX-2的水平,从形态和生理两方面观察乌梅丸及其各拆方组对UC大鼠的作用。
据报道,乌梅丸对UC具有确切疗效[6-8],该方出自张仲景的《伤寒杂病论》,主要用于治疗蛔厥和久利[9]。药物组成:乌梅30 g,细辛3 g,干姜9 g,黄连6 g,当归6 g,附子6 g,花椒5 g,桂枝6 g,人参6 g和黄柏6 g,根据中医药味理论可将其分为酸、苦、甘、辛4种[10]。因此,本文以2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的UC大鼠为药效模型,以乌梅丸的4个药味为实验因素,采用L8(27)正交表设计实验,观察乌梅丸及其各拆方组对UC大鼠的影响,分析探讨4种药味在治疗UC过程中的作用和相互关系。本研究已通过中国中医科学院中医基础理论研究所实验动物伦理委员会审批,批号JCS2018012。
1 材料
1.1 动物
健康雄性SPF级SD大鼠,鼠龄2个月,体质量220~240 g,由北京维通利华实验动物技术有限公司提供,合格证号SCXK(京)2012-0001。动物饲养环境温度和湿度分别为24 ℃和28%,大鼠5只/笼,用混合配方饲料(由北京科澳协力饲料有限公司)喂养,自由进食饮水,每日更换饮水,保持大鼠生活环境通风及清洁卫生,在无菌条件下和12 h/12 h光照/黑暗周期下饲养。
1.2 药品与试剂
乌梅(Prunusmume,171215)、细辛(AsarumsieboldiiMiq.,180506)、干姜(Zingiberoj-jicinaleRosc.,180119)、黄连(CoptischinensisFranch.,171123)、当归(Angelicasinensis,180603)、附子(AconitumcarmichaeliDebx.,180512)、花椒(ZanthoxylumbungeanumMaxim.,180117)、桂枝(CinnamomumcassiaPresl,171229)、人参(Ginsengradixetrhizoma,180228)和黄柏(PhellodendronchinenseSchneid.,180507)药材均购自北京同仁堂药店,由北京中医药大学中药学院刘春生教授鉴定为正品。TNBS(P2297,美国Sigma公司);COX-2 Elisa试剂盒(SEA699Ra)购自美国USCN life science公司;IL-1β Elisa 试剂盒(RTA00)购自美国R&D systems公司。
1.3 仪器
AR2130型分析天平(美国OHAUS公司);3K15型高速低温离心机(美国Sigma公司);Pro200型电动匀浆器(美国PRO Scientific Inc公司);Elx800型酶标仪(美国BioTek公司);Elx50/8型洗板机(美国BioTek公司);WELVAC210型96孔板真空抽滤装置(美国PALL公司);MABVN0B型96孔真空过滤板(美国Millipore公司)。
2 方法
2.1 药物的制备
将乌梅丸拆成4组,分别是A组酸味药(乌梅30 g);B组苦味药(黄连6 g、黄柏6 g);C组甘味药(人参6 g、当归6 g);D组辛味药(桂枝6 g、细辛3 g、花椒5 g、附子6 g、干姜9 g),以含有该组药味和不含该组药味为1、2水平,采用L8(27)正交实验安排实验药物分组,如下表1所示。

表1 乌梅丸拆方的正交实验设计
按正交表设计的7个样品处方剂量称取药材,加8倍水煎煮1 h,第2次6倍量水煎煮1 h合并滤液,水浴浓缩至稠膏,70 ℃减压真空干燥6 h,得干浸膏粉,称质量、粉碎过筛。各样品膏质量如下:1号方(23.87 g/剂),2号方(12.59 g/剂),3号方(17.34 g/剂),4号方(14.64 g/剂),5号方(8.18 g/剂),6号方(6.90 g/剂),7号方(11.09 g/剂)。
2.2 大鼠溃疡性结肠炎模型的制备
所有大鼠实验前禁食不禁水24 h,实验开始大鼠用戊巴比妥钠(40 mg/kg)进行麻醉,按5% TNBS 0.6 mL加0.25 mL的无水乙醇比例配制TNBS乙醇灌肠液,取仰卧位,将1根聚乙烯管(直径约2 mm)经肛门插入肠道,深度8 cm, 将0.3 mL的TNBS乙醇灌肠液注入肠道,保持肛门高30 s,30 min后,有大量粪便排出,再按上述方法经肛门注入TNBS乙醇灌肠液0.85 mL,保持肛门高位5 min以防止液体流出,正常组大鼠以等量生理盐水取代TNBS灌肠液灌肠, 其余过程均相同[11]。
2.3 分组与给药
在TNBS乙醇液灌肠后的第2天,选择有明显腹泻指征(肛门有稀溏大便或有脓血)的大鼠进入实验,未腹泻的大鼠弃去不用。按随机数字表法对腹泻大鼠分为模型组、1号方组、2号方组、3号方组、4号方组、5号方组、6号方组、7号方组,同时设经9%氢化钠溶液灌肠大鼠作为正常组,每组各15只。
在分组的当天进行药物干预,模型组和正常组灌服生理盐水,各乌梅丸拆方组灌服2倍临床剂量药液,1~6号方组分别灌服1~6号方浸膏,剂量依次是4.30 g/kg、2.27 g/kg、3.12 g/kg、2.63 g/kg、1.47 g/kg、1.24 g/kg、2.00 g/kg,灌胃治疗14 d。
2.4 取材
动物于药物干预的第14天开始禁食不禁水24 h,用1%戊巴比妥钠60 mg/kg对大鼠进行深度麻醉,称重后剖开腹腔,截取自结肠脾曲向下约2 cm结肠,剥离肠管外血管和脂肪组织,量取长度并称重,结束后迅速用铝箔包裹,液氮速冻-80 ℃保存。
2.5 细胞因子IL-1β和COX-2水平检测
用液氮研钵将冻存的肠组织标本研碎,将肠组织粉末移至1.5 mL离心管中称重,加入10倍体积的PBS溶液进行匀浆并取上清液,参照ELISA试剂盒说明书所用方法测定肠组织中IL-1β和COX-2的水平。
2.6 统计学方法

3 结果
3.1 乌梅丸不同拆方对UC大鼠的影响
各组大鼠取材后,对结肠测得的质量长度比、IL-1β和COX-2的含量按均值±标准差的形式进行统计,表2为乌梅丸及其拆方组对UC大鼠的影响。对表2进行Dunnet-t检验发现,模型组与正常组之间除体质量外的3个指标均有明显差异(P<0.05),因此对质量长度比、IL-1β和COX-2水平进行方差分析。

表2 乌梅丸各拆方组对UC大鼠的影响
3.2 乌梅丸不同拆方对结肠质量长度比的正交结果与方差分析
表3示,模型组与正常组之间的结肠质量长度比有明显差异(P<0.05)。从方差结果可见,酸、辛、甘因素对结肠质量长度比有显着影响(P<0.05),影响因素主次顺序为A(酸)>D(辛)>C(甘)>B(苦),最佳组合为A1、B2、C1、D1(酸+甘+辛)。表4示,利用Dunnett-t检验将各拆方组与模型组比较,由统计结果可得,拆方1(全方)、3(酸+甘)、7(甘+辛)组与模型组有显着差异(P<0.05),继续使用LSD比较,3个拆方组之间无显着差异。
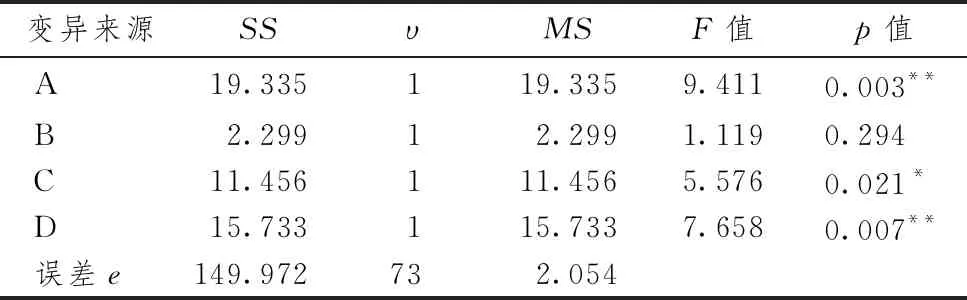
表3 乌梅丸各拆方组对结肠质量长度比的方差分析

表4 乌梅丸各拆方组与模型组关于结肠质量长度比差异性比较
3.3 乌梅丸不同拆方对IL-1β水平的正交结果和方差分析
表5示,乌梅丸拆方的各因素对IL-1β水平的正交结果和方差分析结果可见,各因素对IL-1β水平的影响主次是B(苦)>A(酸)>D(辛)>C(甘),但苦因素对该指标有显着性负影响(P<0.05),为负相关,最佳组合为A1、B2、C1、D1(酸+甘+辛)。表6示,乌梅丸不同拆方组与模型组关于IL-1β水平的差异性比较结果可得,各拆方组对模型均无显着性改善,较其他组而言,拆方3(酸+甘)和7(甘+辛)改善相对较好。

表5 乌梅丸各拆方组对IL-1β水平的方差分析

表6 乌梅丸各拆方组与模型组关于IL-1β水平的差异性比较
3.4 乌梅丸不同拆方对COX-2水平的正交结果和方差分析
表7示,乌梅丸拆方的各因素对COX-2水平的正交结果和方差分析可见,酸和甘因素对COX-2水平有显着影响(P<0.05),各因素对COX-2水平的影响主次是A(酸)>C(甘)>B(苦)>D(辛),最佳组合为A1、B2、C1、D1(酸+甘+辛)。表8示,乌梅丸不同拆方组与模型组关于COX-2水平的差异性比较结果可得,拆方3组(酸+甘)与模型组有显着差别(P<0.01)。

表7 乌梅丸各拆方组对COX-2水平方差分析

表8 乌梅丸各拆方组与模型组关于COX-2水平差异性比较
4 讨论
UC属于中医学“肠癖”“泻下”“久痢”“下痢”等范畴[12],本虚标实,外感湿热、饮食不节、情志不畅或禀赋不足是其基本病因[13]。UC病程中,邪气炽盛,病邪中以湿、热、毒为主,湿热尤其伤脾[14]。UC患者大多生活压力大,暴躁易怒而致肝气不畅,且在邪正交争的过程中体内湿热与气血相搏,情志又与气血运行相互影响。因此,湿热内蕴、肝脾不和、气血失调、情志不畅是UC的常见病机。
关于乌梅丸治疗UC的拆方研究,谷松课题组认为,乌梅丸主要以辛开苦降、寒温并施的配伍方式治疗UC,因此将乌梅丸拆分成辛开苦降组、辛开组、苦降组和补益组,以TNBS/乙醇法制备大鼠UC模型。采用ELISA法测量脂质过氧化反应的分解产物丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)发现,乌梅丸组及辛开苦降组对大鼠结肠黏膜组织SOD和MDA水平的改善效果均比辛开组、苦降组和补益组好,说明乌梅丸可通过减轻结肠黏膜脂质过氧化反应治疗溃疡性结肠炎[15];采用ELISA法检测结肠黏膜组织抑炎因子IL-10与促炎因子肿瘤坏死因子-α(tumor necrosis factor, TNF)-α水平发现,乌梅丸组及辛开苦降组可显着升高IL-10水平,降低TNF-α水平,其他拆方组虽对IL-10和TNF-α水平有所调节,但效果不如乌梅丸组和辛开苦降组[16];采用RT-PCR法检测结肠黏膜组织IL-6、非受体酪氨酸激酶(janus kinase, JAK)、信号转导子和转录激活子(signal transducer and activator of transcription, STAT3)mRNA表达水平发现,乌梅丸组和辛开苦降组均能显着降低IL-6 /JAK/STAT3信号通路中3个指标的基因表达,且效果优于辛开组、苦降组和补益组[17];采用ELISA法检测结肠黏膜IL-4、诱导吲哚胺(Interferon, INF)-γ水平,免疫组化法观察Toll样受体9(Toll-like receptors9,TLR9)、髓样分化因子88(myeloid d ifferentiation factor88,My D88)、细胞核因子κBp65(nuclear factor kappa-Bp65,NF-κBp65)的表达,结果显示乌梅丸组、辛开苦降组均能显着升高IL-4水平,降低INF-γ水平,减少结肠黏膜TLR9、My D88、NF-κBp65的蛋白表达,且效果优于其他拆方组[18]。因此,该课题组通过检测与脂质过氧化反应、炎性反应及通路有关的细胞因子和蛋白发现,乌梅丸组和辛开苦降组对于UC的治疗效果优于其他拆方组。周永学课题组认为,UC临床常表现为寒热错杂、虚实夹杂,因此根据寒热药性及治法将乌梅丸拆为温热组、苦寒组、补益组、收敛组和寒热并用组,以TNBS/乙醇灌肠建立大鼠UC模型,检测大鼠结肠组织IL-1、IL-10、TNF-α、前列腺素E2(Prostaglandin E2,PGE2)、髓过氧化物酶(myeloperoxidase,MPO)的含量变化,发现乌梅丸温热组在升高IL-10和降低PGE2水平方面作用突出,寒凉组药物在降低IL-1、TNF-α、MPO含量、对抗体温升高方面作用突出[19];RT-PCR法检测各组大鼠结肠组织TLR4、MYD88和NF-κBmRNA的表达,结果显示寒凉组和温热组药物均可以通过MYD88依赖途径抑制TLR4/NF-κB信号通路的传导, 但乌梅丸组和寒热并用组的效果更好[20],说明乌梅丸通过寒热配伍具有协同和增效作用。
本研究结果显示,UC模型组与正常组大鼠之间的结肠质量长度比、IL-1β和COX-2水平具有显着差异。酸、辛和甘味药物对大鼠结肠质量长度比有显着影响(酸>辛>甘),全方组、酸+甘组和甘+辛组可显着降低UC大鼠结肠质量长度比。研究发现,UC患者IL-1β水平明显高于正常人[21],IL-1β作为一种促炎因子,该因子的异常分泌会引起一系列的炎性反应介质释放,并诱导和加重结肠黏膜局部的炎性反应[22]。本次研究发现,苦味药物对IL-1β含量具有显着负影响,酸+甘组、甘+辛组对UC大鼠结肠组织的IL-1β有调节作用。COX-2是催化花生四烯酸转化为前列腺素的关键酶,其表达常伴随着炎性反应发生后结肠固有层各种炎性细胞因子的增多而增加[23]。本研究结果显示,酸和甘味药物对COX-2含量具有显着影响(酸>甘),7个拆方组中酸+甘药物组合对COX-2含量有显着调节作用。
综合以上分析,酸味药物(乌梅)对大鼠UC模型具有重要的调节作用,体现了其作为方中君药的作用,其次为甘、辛,而苦味药材对大鼠UC模型具有负调节作用。酸、甘和辛味药物的组成对结肠质量长度比、IL-1β、COX-2水平有显着调节作用,说明酸、甘和辛味药物在方剂中起主导作用,苦味药物也对药物的配伍有重要意义。苦味药物对大鼠UC模型具有负调节作用,本文分析其原因在于TNBS诱导的溃疡性结肠炎大鼠模型的证候属性可能为阳虚证,是否如此有待进一步的研究。



