王佳君
上海科华生物工程股份有限公司,上海 200233
1 目前主要的检测方法
1.1 免疫比浊法
免疫比浊法适用于自动化分析,免疫散射要有专门仪器,免疫透射比浊法可用自动生化分析仪。大多数生化自动分析仪要求反应在10分钟内完成,所以必须有高活性抗体和合适的反应体系,且检测血清用量大,在常用PEG反应体系中存在明显的非特异性反应,需依赖表面活性剂作用来加速反应速度和减少非特异性反应。Levine等设计免疫比浊自动反应体系中含22.5g/L PEG,2g/L明胶等表面活性剂,10分钟反应线形范围>2.6g/L,不受蛋白纤溶酶原(pg)、ApoB、TG等干扰,能识别11种LP(a)的多态型,与ELISA有良好相关性。
1.2 粒子增强免疫比浊测定法
原理与免疫比浊法一样,主要区别在于从抗血清IgG后,吸附或交联于胶乳表面,因其有一定粒径,可增强光散射强度等原因,可使度法灵敏度达到ng/ml水平。同时因抗体的固相化,增加了稳定性。
本次评价采用市场上常用的普通免疫比浊法的试剂盒,与粒子增强免疫比浊测定法的试剂盒进行比较,以了解现在市场上采用不同方法试剂的现状。
2 采取的主要实验方法
2.1 实验所用试剂
免疫比浊法:罗氏:646866;
粒子增强法:第一化学:815RA1(试剂)813 RA1(校准品)迈克:0611031。
2.2 实验仪器
日立全自动生化分析仪7100。
2.3 实验结果:
1)准确性测定
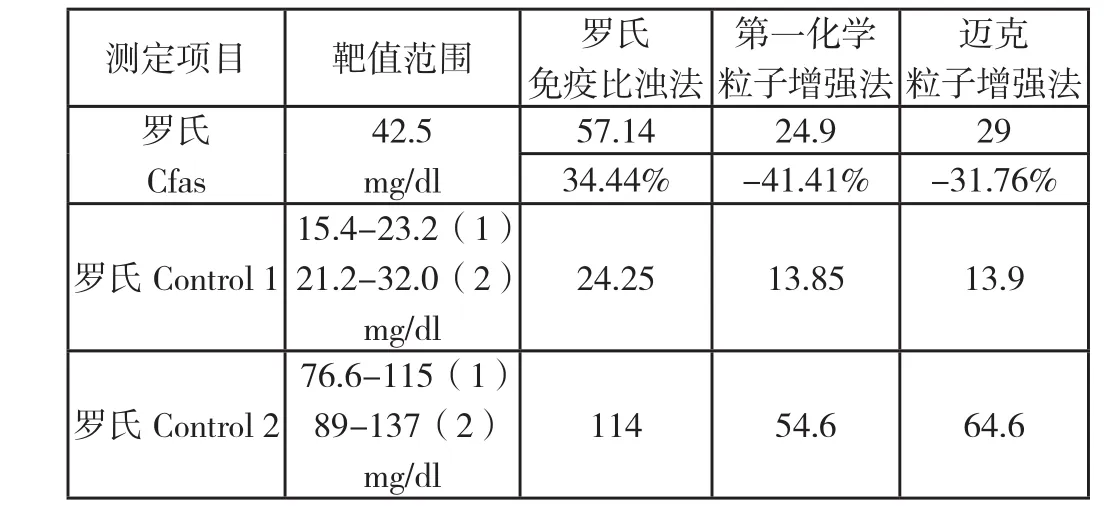
测定项目 靶值范围 罗氏免疫比浊法迈克粒子增强法罗氏Cfas第一化学粒子增强法57.14 24.9 2934.44% -41.41% -31.76%42.5 mg/dl罗氏Control 115.4-23.2(1)21.2-32.0(2)mg/dl 24.25 13.85 13.9罗氏Control 276.6-115(1)89-137(2)mg/dl 114 54.6 64.6
2)Bio-Rad Control范围1为Beckman Coulter IMMAGE标示值,范围2为Roche cobas
INTEGRA标示值。
由罗氏Cfas结果可知,罗氏结果偏高34.44%,而第一化学与迈克结果接近,偏低很多;由罗氏Control 1结果可知,罗氏试剂结果在标示范围内,而第一化学与迈克结果接近,低于下限值;由罗氏Control 2结果可知,罗氏结果在范围内,而第一化学与迈克结果仍然低于范围下限;由于Bio Control说明书上没有提供日立机型的参考范围,故将其他全自动生化分析仪上的结果均进行比较,除迈克 Bio Control2的结果在Beckman Coulter IMMAGE的标示范围内,其他结果均不在标示范围内。
2)相关性测定
将罗氏,第一化学,迈克3款试剂同时测定55份人血清样本(注: Lp(a)含量超出线性范围,用生理盐水稀释后测定,结果乘以稀释倍数),结果统计如下:
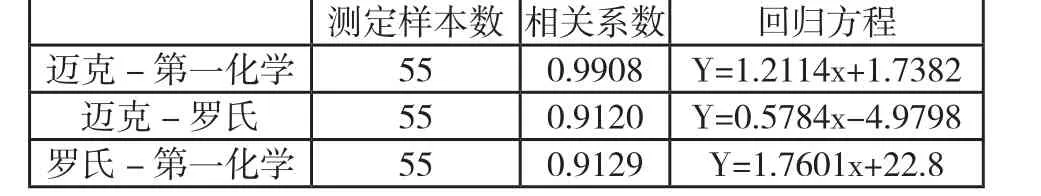
测定样本数 相关系数 回归方程迈克-第一化学 55 0.9908 Y=1.2114x+1.7382迈克-罗氏 55 0.9120 Y=0.5784x-4.9798罗氏-第一化学 55 0.9129 Y=1.7601x+22.8
有以上结果可知,第一化学与迈克结果相近,相关系数R=0.9908,相关性很好;而罗氏与第一化学的相关系数R=0.9129;罗氏与迈克的相关系数R=0.9120;相关性不够好。
3 结论
从以上数据结果表明,第一化学与迈克公司的LP(a)的定量测定试剂盒所测得的结果较为相近,普遍结果都要比罗氏公司的LP(a)的定量测定试剂盒的结果低上不少,究其原因可能第一化学与迈克公司的试剂盒均为粒子增强法试剂,体系相近,所以结果也相近;而此次试验中罗氏公司的试剂盒为常规的免疫比浊法试剂盒,且所用抗体为多抗,所测结果则较高。罗氏公司的试剂盒在测定罗氏control的结果都在给定的范围内,而第一化学与迈克的试剂盒的结果则偏出范围外,低于给定范围的下限,而且测定的Bio-Rad Control的结果几乎都偏出所给参考范围;在相关性实验中也体现出第一化学与迈克由于都是粒子增强法试剂盒,故相关系数达到0.9908,而罗氏试剂盒所用方法不同,与第一化学,迈克公司的试剂盒的相关性并不好。说明市场上不同体系的LP(a)的定量测定试剂盒所测得的结果差异很大。
早在2004年,IFCC的生物标准化专家委员会就接受了“IFCC SRM 2B”为国际上第一个LP(a)免疫测定的WHO/IFCC国际参考物质,该参考物质的每个安瓿内的LP(a)为0.1071nmol。但目前市场上常用的计算单位为mg/dl,又由于LP(a)结构内含的apo(a)具有多态性,特别是环饼区域K4的第2段中的相似环饼从3~40个不等,使得apo(a)的大小从187kDa到662kDa不等,也就导致LP(a)的分子量的不确定,故无法在2个单位间通过分子量进行换算,因此从SRM 2B溯源的值无法在市场上得到普及,造成现在市场上各体系间的差异,希望在不久的将来,以SRM 2B为基准溯源的结果能直接应用于临床,解决类似差异的问题。
[1]Albers.J.J, et al.The Unique Lipoprotein(a):Properties and Immunochemical Measurement.Clin Chem.1990,36(12):2019-2026.
[2]张丽霞,只野寿太郎,山本匡介.脂蛋白是最敏感的急性时相蛋白.中华医学检验杂志,1997,20(3):167.
[3]杨昌国,许叶,李清华.脂蛋白(a)的结构和免疫化学测定中的难题.临床检验杂志,1993,11:42-44.
[4]王红,庄一义.血清脂蛋白(a)的免疫比浊测定法.临床检验杂志,1991,9(4):184.
[5]Molinari E.A, et al.Immunoturbidimetric determination of lipoprotein(a): improvement in the measurement of turbid and triglyceride-rich samples.Clin Chim Acta 235 (1995):59-69.
[6]董军,李健斋.血清脂蛋白(a)测定方法研究进展.中华医学检验杂志,1997,20(1):52-55.
[7]李建军,庄一义,汪俊军.人血清载脂蛋白(a)的多态性检测.中华医学检验杂志,1994,17(1):22-25.



