吴春雪,崔 莹,李 勇,杨 龙,贾春梅,李春学
丙氨酰谷氨酰胺对急性肺损伤/急性呼吸窘迫综合征患者的影响研究
吴春雪,崔 莹,李 勇,杨 龙,贾春梅,李春学
目的 探讨丙氨酰谷氨酰胺 (Ala-Gln)对急性肺损伤/急性呼吸窘迫综合征 (ALI/ARDS)患者热休克蛋白70(HSP70)、Murray肺损伤评分 (MLIS)及机械通气时间的影响。方法 ALI/ARDS患者110例随机分为对照组 (50例)和治疗组 (60例),对照组给予常规治疗,包括治疗原发病、机械通气、液体管理及营养支持等,治疗组给予常规治疗加Ala-Gln 0.4 g·kg-1·d-1共7 d。比较两组治疗前后患者血浆HSP70水平、MLIS、机械通气时间的变化和28 d死亡率。结果 治疗后治疗组血清HSP70水平较对照组明显升高,差异有统计学意义 (P<0.01)。治疗后治疗组MLIS较对照组显著下降,差异有统计学意义 (P<0.01)。治疗组机械通气时间 (162.20±96.33)h,较对照组的 (235.00±107.90)h明显缩短,差异有统计学意义 (P<0.05)。治疗组28 d死亡率较对照组有所降低,但差异无统计学意义 (P>0.05)。结论 ALI/ARDS患者给予Ala-Gln,可明显提高其体内HSP70的水平,降低MLIS,缩短机械通气时间。
谷氨酰胺;呼吸窘迫综合征,成人;HSP70热休克蛋白质类
热休克蛋白70(HSP70)是生物进化过程中的一组高度保守的蛋白质,在对抗各种应激损伤中起到保护机体、减轻损害的作用,并具有广泛的细胞保护作用[1]。动物实验表明:谷氨酰胺 (Gln)可诱导HSP70表达,对急性肺损伤/急性呼吸窘迫综合征 (ALI/ARDS)的肺脏起到保护作用。但在临床上,应用Gln对HSP70的诱导治疗ALI/ARDS作用的观察鲜见报道。丙氨酰谷氨酰胺 (Ala-Gln)进入体内后迅速分解为Gln和丙氨酸。本研究通过观察应用Ala-Gln治疗后ALI/ARDS患者血清HSP70水平的变化及对Murray肺损伤评分(MLIS)和机械通气时间的影响,探讨Ala-Gln对ALI/ARDS的作用,以期为临床治疗ALI/ARDS提供新的思路。
1 资料与方法
1.1 临床资料 选取2007年10月—2010年10月我院急诊重症监护病房患者中符合1994年欧美ARDS联席提出的ALI诊断标准者110例为研究对象,其中男65例,女45例;平均年龄 (48.1±19.3)岁。排除标准:有严重的基础疾病史,免疫抑制剂治疗者,妊娠期和哺乳期妇女,入住ICU时间﹤7 d者。
1.2 分组 随机分为对照组50例,治疗组60例。两组患者性别、年龄、体温、急性生理学及慢性健康状况评分系统Ⅱ(APACHEⅡ)比较差异均无统计学意义 (P>0.05,见表1)。
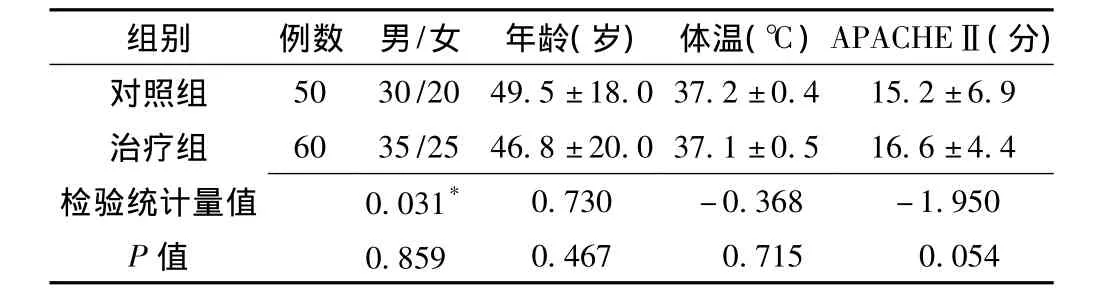
表1 两组一般资料比较Table 1 Comparison of clinical datum between two groups
1.3 方法 对照组给予ICU常规综合治疗,包括治疗原发病、机械通气、液体管理及营养支持等。治疗组在上述治疗的同时,经静脉给予Ala-Gln(华瑞制药有限公司,国药准字H20053409,20 g/100 ml)0.4 g·kg-1·d-1,共 7 d。
1.4 观察指标 于治疗前1 d和治疗后第7天分别对两组进行MLIS评分,同时采集静脉血2 ml,1 000 r/min离心15 min,提取上清液,转入无热原Eppendorf管,-80℃冰箱内保存批量测定HSP70血清水平。HSP70血清水平测定采用酶联免疫吸附法,检测完全按照试剂盒 (EKS700,Stressgen VictoriaBC,Canada,深圳晶美生物试剂公司)说明书执行。统计两组患者最终的机械通气时间及28 d死亡率。
1.5 统计学方法 采用SPSS 11.5统计软件进行统计学分析,计量资料采用(±s)表示,两组均数比较行两个独立样本t检验 (independent samples t Test);计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后血清HSP70水平比较 治疗前两组血清HSP70水平差异无统计学意义 (P>0.05);治疗后治疗组血清HSP70水平较对照组明显升高,差异有统计学意义 (P<0.01,见表2)。
表2 两组治疗前后血清HSP70水平比较(±s,μg/L)Table 2 Comparison of HSP70 concentrations before and after treatment between the two groups
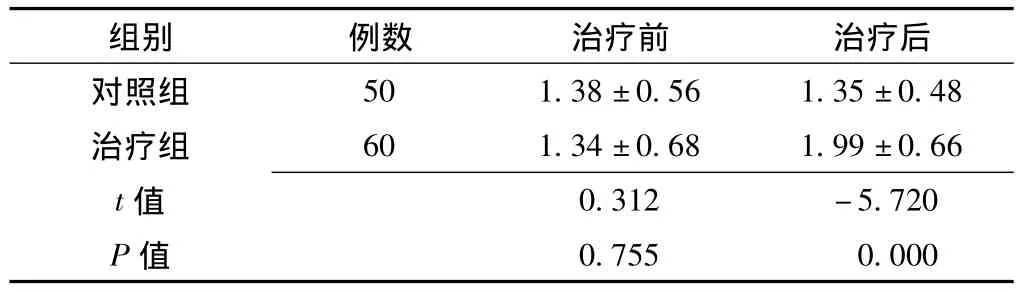
表2 两组治疗前后血清HSP70水平比较(±s,μg/L)Table 2 Comparison of HSP70 concentrations before and after treatment between the two groups
组别 例数 治疗前 治疗后对照组50 1.38±0.56 1.35±0.48治疗组 60 1.34±0.68 1.99±0.66 t 0.312 -5.720 P值值0.755 0.000
2.2 两组治疗前后MLIS比较 治疗前两组MLIS差异无统计学意义 (P>0.05);治疗后治疗组MLIS较对照组显著下降,差异有统计学意义 (P<0.01,见表3)。
2.3 两组治疗前后机械通气时间比较 治疗组机械通气时间(162.20±96.33)h,较对照组的 (235.00±107.90)h明显缩短,差异有统计学意义 (t=-2.211,P=0.033)。
2.4 两组28 d死亡率比较 治疗组28 d死亡率21.7%(12/60),较对照组的24.0%(12/50)有所降低,但差异无统计学意义 (χ2=0.085,P=0.771)。
表3 两组治疗前后MLIS比较(±s,分)Table 3 Comparison of MLIS before and after treatment between the two groups

表3 两组治疗前后MLIS比较(±s,分)Table 3 Comparison of MLIS before and after treatment between the two groups
组别 例数 治疗前 治疗后对照组50 2.06±0.51 1.56±0.85治疗组 60 1.93±0.85 0.96±0.49 t 0.953 3.456 P值值0.343 0.001
3 讨论
ALI/ARDS是一种常见危重症,病死率极高,严重威胁重症患者的生命并影响其生存质量。ALI/ARDS的发病机制目前尚不明确,目前认为各种病因诱发的肺内或全身过度活化的炎症反应是引起ALI/ARDS的主要发病机制[2]。呼吸爆发产生的大量活性氧引起氧化应激状态也是ALI发生发展的机制之一[3]。由炎症反应及过氧化介导的肺血管内皮细胞及肺泡上皮细胞受损及凋亡会引起肺毛细血管通透性增加,肺间质/肺泡水肿,肺表面活性物质分泌减少,肺泡萎陷,气体交换障碍,导致顽固性低氧血症。
HSP是普遍存在于生物体内的一组高度保守的蛋白质分子家族,机体在生理、病理或应激时会大量生成,因此又称应激蛋白。其中HSP70是最保守的一族,与肺脏的生物学关系最为密切[3-4]。HSP70具有多种生物学功能:(1)分子伴侣作用:作为分子伴侣加速肽链的正确折叠和重折叠,维持某些肽链的伸展状态以利其跨膜转位在线粒体内质网等不同区域内发挥作用,同时还促进某些变性蛋白质的降解和清除,重新激活某些酶的作用,维持细胞的正常生理功能[5-6]。 (2)通过抑制促炎因子表达[7],促进抗炎因子表达发挥抗炎作用[8]。(3)抗氧化作用[9]。(4)通过多种机制抗细胞凋亡作用[10-13]。HSP70对ALI/ARDS的作用是目前研究的热点。
Ala-Gln注射液其活性成分为:N(2) -L-丙氨酰-L-谷胺酰胺,进入体内可迅速分解为Gln和丙氨酸。生理状态下Gln是一种非必须氨基酸,可由谷氨酸、缬氨酸、异亮氨酸合成。应激状态下机对Gln需求量增加,自身合成不足,此时为必需氨基酸。研究表明重症患者血浆Gln水平较正常人低[1,14]。Gln除了是人体必需的一种营养素外,还具有调节机体免疫功能等多种生物学功能,并被越来越多的实验证实可以诱导HSP的表达。Sanders等[15]最早揭示了Gln可诱导HSP的表达。Wischmeyer等[16]和 Singleton 等[17]证明 Gln 可明显促进脓毒性休克大鼠心脏、肺和结肠等组织细胞表达HSP70,减轻内毒素对心、肺、结肠等器官的损害作用,显著降低动物的死亡率。Gln诱导HSP70表达的机制尚未完全明确,Singleton等[18]实验发现Gln通过激活体内热休克转录因子增强 HSP70表达。Wischmeyer[19]发现 Gln能通过提高热休克因子结合DNA启动子的能力,促进HSP基因的转录,上调HSP的表达,改善患者的预后。
本研究结果显示,静脉应用Ala-Gln治疗后,ALI/ARDS患者血清HSP70水平显著增高,这与相关动物实验[17]中器官组织中HSP70表达的变化一致;与国外的一项临床随机双盲研究中血清HSP70水平变化一致[20]。证明了Gln可以上调ALI/ARDS患者血清 HSP70水平,这是临床应用 Gln作为HSP70诱导剂治疗ALI/ARDS的前提。
本研究中治疗组MLIS及机械通气时间较对照组有更为显著的下降,证明了静脉Ala-Gln治疗可使各种致病因素引起的肺损伤好转,并可显著缩短机械通气的时间,治疗组MLIS及机械通气时间的变化与治疗组ALI/ARDS患者血清HSP70显著增高相关,由此可推测Gln对ALI/ARDS的治疗作用与Gln诱导HSP70表达有关。(1)Gln上调HSP70水平,通过其分子伴侣作用对肺血管内皮细胞及肺泡细胞起到保护作用,阻止或延缓ALI/ARDS的发生发展。(2)Gln上调HSP70水平,遏制各种致ALI/ARDS因素引起的失控的炎症反应,从而减轻细胞及脏器功能损伤,从而遏制ALI/ARDS的进展。(3)Gln上调HSP70水平,HSP70可抑制肺泡上皮细胞及内皮细胞凋亡发挥肺保护作用。(4)Gln上调HSP70水平,发挥抗氧化作用,减轻氧化应激反应,减轻肺损伤。Kato等[21],Saleh等[12],Villar等[22],Weiss 等[23]的动物实验表明了通过诱导HSP70可通过上述机制对不同原因引起的肺损伤有治疗作用。
动物实验中采用热应激、二甲砷基等诱导HSP70表达因其较强的毒副作用而不能应用于临床。本研究采用Gln作为HSP70诱导剂避免了以往HSP70诱导剂的毒副作用,在临床用于治疗ALI/ARDS,可使肺损伤明显好转,显著缩短机械通气时间。为近期实验成果用于临床,提供了一定的临床依据。本研究两组28 d死亡率无统计学差异,可能与样本量较小或干预时间过短有关。
1 宋晓聪,杨芳芳,胡丹,等.腺病毒介导的热休克蛋白70表达对神经元氧化应激损伤的保护作用 [J].中国全科医学,2010,13(2):494.
2 中华医学会重症医学分会.急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南 (2006)[J].中国危重病急救医学,2006,18(12):706-710.
3 徐鹏,张骅,苏仁意,等.雾化吸入血必净对急性肺损伤的实验研究[J].疑难病杂志,2009,8(4):207.
4 秦雪冰,俞森洋.热休克蛋白与呼吸机所致肺损伤的研究进展[J].临床内科杂志,2005,22(10):718-720.
5 Daugarrd M,Rohde M,Jaattela M.The heat shock protein 70 family:highly homologous proteins with overlapping and distinct functions [J].FEBS Letters,2007,581(19):3702-3710.
6 Diamant S,Peres Ben-Zvi A,Bukau B,et al.Size-dependent disaggregation of stable protein aggregates by the DnaK chaperone machinery[J].J Biol Chem,2000,275(28):21107-21113.
7 Yoo CG,Lee S,Lee CT,et al.Anti- inflammatory effect of heat shock protein induction is related to stabilization of I kappa B alpha through preventing I kappa B kinase activation in respiratory epithelial cells[J].J Immunol,2000,164(10):5416 -5423.
8 Koh Y,Lee YM,Lim CM,et al.Effects of heat pretreatment on histopathology,cytokine production,and surfactant in endotoxin-induced acute lung injury[J].Inflammation,2001,25(3):187-196.
9 Hiratsuka M,Mora BN,Yano M,et al.Gene transfer of heat shock protein 70 protects lung grafts from ischemia-reperfusion injury[J].Ann Thorac Surg,1999,67(5):1421-1427.
10 Bienemann AS,Lee YB,Howarth J,et al.HSP70 suppresses apoptosis in sympathetic neurones by preventing the activation of c-Jun[J].J Neurochem,2008,104(1):271-278.
11 Kim HP,Wang X,Zhang J,et al.Heat shock protein -70 mediates the cytoprotective effect of carbon monoxide involvement of p38 beta MAPK and heat shock factor-1 [J].J Immunol,2005,175(4):2622-2629.
12 Saleh A,Srinivasula SM,Balkir L,et al.Negative regulation of the Apaf-1 apoptosome by Hsp70 [J].Nat Cell Biol,2000,2(8):476-483.
13 Ricard JD,Dreyfuss D,Saumon G.Production of inflammatory cytokines in ventilator-induced lung injury:a reappraisal[J].Am J Respir Crit Care Med,2001,163(5):1176-1180.
14 王志华,蔡金芳,汪伟,等.丙氨酰-谷氨酰胺在重度颅脑损伤治疗中的应用价值研究 [J].中国全科医学,2011,14(1):277.
15 Sanders MM,Kon C.Glutamine is a powerful effector of heat shock protein expression in Drosophila Kc cells [J].J Cell Physiol,1991,146(1):180-190.
16 Wischmeyer PE,Kahana M,Wolfson R,et al.Glutamine induces heat shock protein and protects against endotoxin shock in the rat[J].J Appl Physiol,2001,90(6):2403 -2410.
17 Singleton KD,Serkova N,Beckey VE,et al.Glutamine attenuates lung injury and improves survival after sepsis:role of enhanced heat shock protein expression [J].Crit Care Med,2005,33(6):1206-1213.
18 Singleton KD,Wischmeyer PE.Oral glutamine enhances heat shock protein expression and improves survival following hyperthermia [J].Shock,2006,25(3):295-299.
19 Wischmeyer PE.Glutamine:the first clinically relevant pharmacological regulator of heat shock protein expression?[J].Curr Opin Clin Nutr Metab Care,2006,9(3):201 -206.
20 Ziegler TR,Ogden LG,Singleton KD,et al.Parenteral glutamine increases serum heat shock protein 70 in critically ill patients[J].Intensive Care Med,2005,31(8):1079-1086.
21 Kato K,Yamanaka K,Hasegawa A,et al.Dimethylarsinic acid exposure causes accumulation of Hsp72 in cell nuclei and suppresses apoptosis in human alveolar cultured(L-132)cells[J].Biol Pharm Bull,1999,22(11):1185 -1188.
22 Villar J,Edelson JD,Post M,et al.Induction of heat stress proteins is associated with decreased mortality in an animal model of acute lung injury[J].Am Rev Respir Dis,1993,147(1):177-181.
23 Weiss YG,Maloyan A,Tazelaar J,et al.Adenoviral transfer of HSP-70 into pulmonary epithelium ameliorates experimental acute respiratory distress syndrome [J].J Clin Invest,2002,110(6):801 -806.
The Effect of Alanyl-Glutamine on HSP70 and MLIS and the Duration of Mechanical Ventilation in ALI/ARDS Pa-tients
WU Chun - xue,CUI Ying,LI Yong,et al.Department of Emergency,Cangzhou Central Hospital,Cangzhou 061001,China
ObjectiveTo evaluate the effect of Alanyl- glutamine on serum HSP70 concentration and Murray lung injury score(MLIS)and the duration of mechanical ventilation in ALI/ARDS patients.MethodsOne hundred and ten patients admitted to emergency intensive care unit were randomly divided into control group and Alanyl-glutamine group.50 patients in the control group were given routine treatment including primary disease treatment,mechanical ventilation,fluid management and nutrition support,and 60 patients in the Alanyl- glutamine group were given Alanyl- glutamine at a dose of 0.4 g·kg-1·d-1for 7 days besides the routine treatment.Serum HSP70 concentrations were measured before and after the 7th treating day.MLIS and the hours of mechanical ventilation were observed at the same time.ResultsAfter treatment,HSP70 concentrations in Alanyl-glutamine group were significantly higher than those in control group(P<0.01),and MLIS were significantly decreased in Alanyl-glutamine group(P<0.01).The hours of mechanical ventilation in Alanyl-glutamine group(162.20±96.33)h were significantly shortened than those of the control group(235.00±107.90)h(P<0.05).But there was no singnificant difference of mortality at day 28 between the two groups.ConclusionAlanyl-glutamine can significantly increase serum HSP70 concentrations and decrease MLIS as well as shorten the duration of mechanical ventilation in ALI/ARDS patients.
Glutamine;Respiratory distress syndrome,adult;HSP70 heat- shock protein
R 563.8
A
1007-9572(2011)12-4157-03
061001河北省沧州市中心医院急诊科
2011-06-20;
2011-11-16)
(本文编辑:陈素芳)



