龙 彦,赵晓涛,孙媛媛,刘 畅,王 辉
TORCH是一组具有新生儿致畸作用的病原体的缩写,最先由Nahmias等[1]于1971年提出,包括弓形虫(toxoplasma,TOX)、风疹病毒(rubellavirus,RV)、巨细胞病毒(cytomegalovirus,CMV)及单纯疱疹病毒Ⅰ/Ⅱ(herpes simple virusⅠ/Ⅱ,HSVⅠ/Ⅱ)。育龄期妇女由于自身免疫功能的改变,易发生TORCH感染。孕妇发生TORCH感染,病原体可以通过胎盘或产道感染胎儿或新生儿,引起早产、死胎、先天性畸形、新生儿中枢神经损害等诸多不良后果,因此进行TORCH感染的早期检测具有重要意义。anti-TORCH IgM和IgG检测是目前临床诊断TORCH感染的重要依据[2],目前国内主要采用ELISA法进行定性或半定量检测,但该方法需手工操作、耗时,且结果判读受主观影响较大,灵敏度较低。本研究采用化学发光免疫分析法(CLIA)检测anti-TORCH,从而对北京地区育龄妇女的TORCH感染情况进行调查,为指导育龄期妇女优生优育、预防新生儿TORCH感染提供有力数据资料,以提高人口素质。
1 对象与方法
1.1 调查对象 收集北京大学人民医院2012年11月—2013年11月进行孕前筛查和孕期普查的妇女分别为377例、6 601例共计6 978例。年龄20~48岁,中位年龄为31岁。将孕妇按年龄分为低龄孕妇组(<35岁)3 730例和高龄孕妇组(≥35岁)2 871例,两年龄组间例数差异未见有统计学意义(χ2=22.73,P<0.05)。对受试者使用分离胶真空采血管抽取静脉血3 ml,离心半径10 cm,3 000 r/min离心3 min,分离血清样本,4 ℃保存于48 h内完成检测,48 h内未完成检测者置-20 ℃保存待检。
1.2 主要仪器及试剂 Liaison全自动化学发光免疫分析仪为意大利Diasorin公司仪器,配套试剂包括包被有相应病毒抗原的磁性微粒、结合了异鲁米诺衍生物的鼠抗人IgM单抗或鼠抗人IgG单抗、高值和低值定标液、激发液和缓冲液。
1.3 检测方法 测定原理是病原体抗原包被磁性微粒作为固相载体,鼠抗人单克隆抗体链接异鲁米诺衍生物作为抗体结合物。第一次孵育期间,定标物、标本或质控品中的病原体抗体结合固相载体(磁微粒),第二次孵育过程中,抗体结合物与固相载体上的病原体抗体反应。每次孵育后,通过洗涤除去未结合的物质,随后加入激发试剂并激发化学发光反应,通过光电倍增管测量相关光单位(RLU),并显示定标物、标本或质控品中抗体的量。测量IgM抗体时缓冲液中含有羊抗人IgG的抗体,可除去标本中可能存在的病毒IgG抗体以及类风湿因子等的干扰。该方法检测anti-TORCH IgM和IgG的灵敏度和特异度均在95%以上,且不受轻中溶血(血红蛋白<1 000 mg/dl)、严重乳糜(三酰甘油<3 000 mg/dl)、胆红素血(胆红素<20 mg/dl)、含有颗粒物质或明显被微生物污染等因素的影响。每批标本测定前均进行光路校正和质控。
1.4 结果判读 CLIA测定弓形虫抗体(anti-TOX) IgM浓度>6 AU/ml、anti-TOX IgG >7.2 U/ml者为阳性;风疹病毒抗体(anti-RV)IgM浓度>25 AU/ml、anti-RV IgG>10 U/ml者为阳性;巨细胞病毒抗体(anti-CMV)IgM浓度>15 AU/ml、anti-CMV IgG>0.4 U/ml者为阳性;单纯疱疹病毒Ⅰ/Ⅱ抗体(anti-HSVⅠ/Ⅱ)IgM浓度>1.1 Index、anti-HSVⅠ/ⅡIgG测定值>1.1 Index者为阳性。
1.5 统计学方法 采用Excel 2003和 SPSS 13.0软件进行统计分析,计数资料以率表示,组间阳性检出率比较采用χ2检验,组间多重比较采用χ2分割法,以P<0.05为差异有统计学意义。
2 结果
2.1 anti-TORCH IgM检测结果分析 在调查人群中,共检测anti-TOX IgM 6 601例、anti-RV IgM 6 691例、anti-CMV IgM 6 564例、anti-HSVⅠ/Ⅱ IgM 6 962例。与其他3种病原体比较,anti-HSVⅠ/Ⅱ IgM阳性检出率最高,为11.19%(P<0.007),其次为anti-RV IgM和anti-CMV IgM,阳性检出率分别为2.63%、2.54%,二者阳性检出率之间差异无统计学意义(P=0.755),anti-TOX IgM的阳性检出率较其他3组低,差异有统计学意义(P<0.007,见表1)。
2.2 不同季节anti-TORCH IgM的阳性检出率分析 按季节分析,anti-CMV IgM以秋季为高发期(阳性检出率为3.66%),与其他三季比较,差异均有统计学意义(P<0.007);anti-HSVⅠ/Ⅱ IgM 以春、秋两季为高发期(阳性检出率分别为12.47%和12.41%),二者与冬、夏两季比较,差异均有统计学意义(P<0.007),但春、秋两季比较差异无统计学意义(P<0.05);anti-TOX IgM、anti-RV IgM在不同季节的阳性检出率比较,差异均无统计学意义(P>0.007,见表2)。图1为各个TORCH特异性IgM抗体在不同月份的阳性检出率。从图中可以看出anti-TOX IgM在2月份的阳性检出率最高,anti-RV IgM在6月份的阳性检出率最高。
表1 anti-TORCH-IgM阳性检出率比较
Table1 Comparison of seropositive rate of anti-TOX IgM, anti-RV IgM, anti-CMV IgM and anti-HSV IgM

检测项目检测例数阳性例数阳性检出率(%)anti-TOXIgM6601490.74anti-RVIgM66911762.63anti-CMVIgM65641672.54anti-HSVⅠ/ⅡIgM696277911.19χ2值958.31P值0.00
注:anti-TOX=弓形虫抗体;anti-RV=风疹病毒抗体;anti-CMV=巨细胞病毒抗体;anti-HSVⅠ/Ⅱ=单纯疱疹病毒Ⅰ/Ⅱ抗体
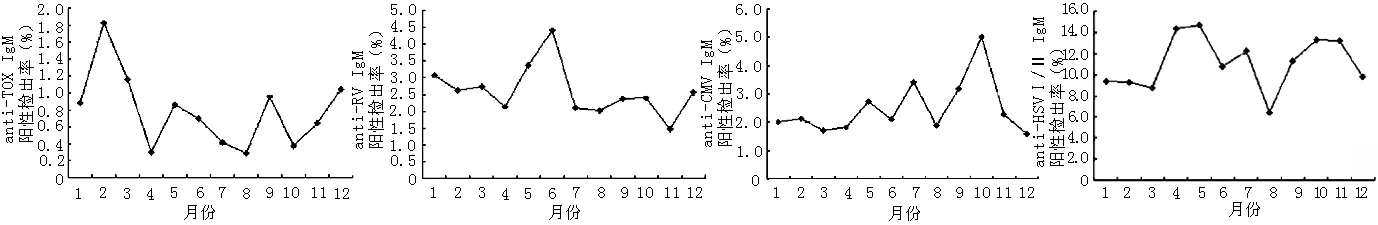
注:anti-TOX=弓形虫抗体;anti-RV =风疹病毒抗体;anti-CMV=巨细胞病毒抗体;anti-HSVⅠ/Ⅱ=单纯疱疹病毒Ⅰ/Ⅱ抗体
图1 不同月份anti-TORCH IgM阳性检出率比较
Figure1 The seropositive rate of anti-TORCH IgM of different month
2.3 不同年龄组孕妇anti-TORCH IgM抗体检测结果分析 低龄孕妇组anti-HSVⅠ/ⅡIgM的阳性检出率高于高龄孕妇组,差异有统计学意义(P<0.05);高龄孕妇组anti-TOX IgM、anti-CMV IgM的阳性检出率高于低龄孕妇组,差异有统计学意义(P<0.05);anti-RV IgM的检出率在两年龄组间差异无统计学意义(P>0.05,见表3)。
表2 不同季节TORCH IgM抗体阳性检出率比较〔%(n/N)〕
Table2 Comparsion of seropostitive rate of anti-TORCH IgM of different seasons
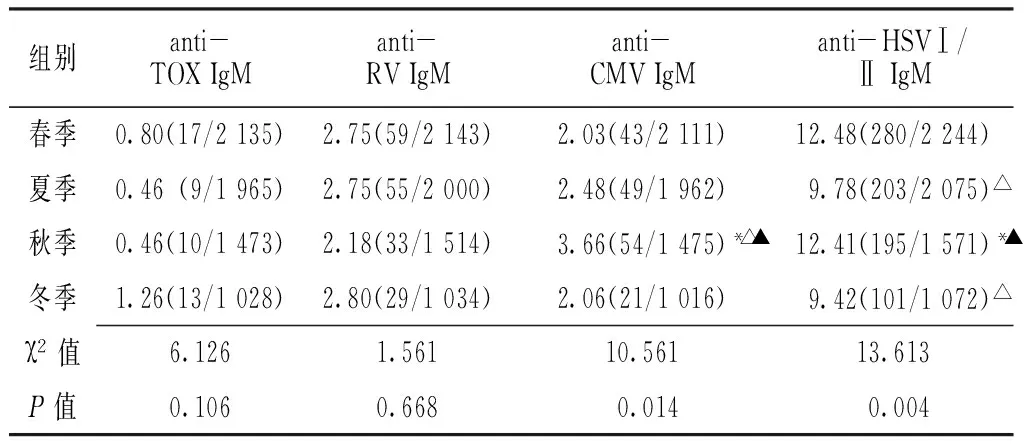
组别anti-TOXIgManti-RVIgManti-CMVIgManti-HSVⅠ/ⅡIgM春季0.80(17/2135)2.75(59/2143)2.03(43/2111)12.48(280/2244)夏季0.46(9/1965)2.75(55/2000)2.48(49/1962)9.78(203/2075)△秋季0.46(10/1473)2.18(33/1514)3.66(54/1475)*△▲12.41(195/1571)*▲冬季1.26(13/1028)2.80(29/1034)2.06(21/1016)9.42(101/1072)△χ2值6.1261.56110.56113.613P值0.1060.6680.0140.004
注:与夏季比较,*P<0.05;与春季比较,△P<0.05;与冬季比较,▲P<0.05;春季3月~5月;夏季6月~8月;秋季9月~11月;冬季12月~2月
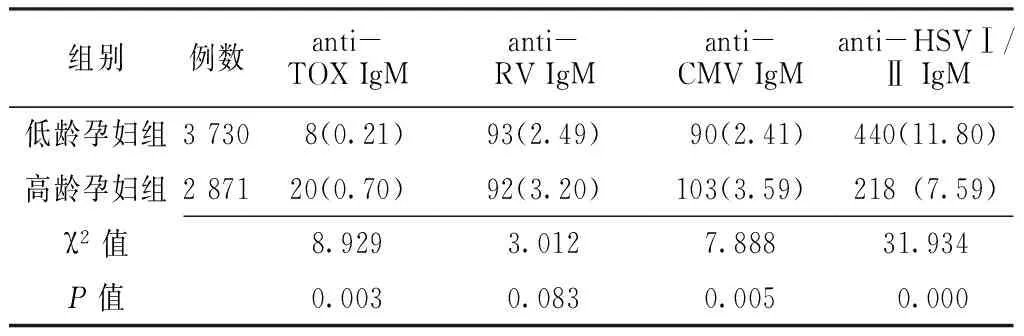
表3 不同年龄组anti-TORCH IgM阳性检出率比较〔n(%)〕
2.4 anti-TORCH IgG抗体检测结果分析 在调查人群中,共检测anti-TOX IgG 2 216例、anti-RV IgG 2 991例、anti-CMV IgG 2 910例、anti-HSVⅠ/ⅡIgG 2 473例,anti-TORCH IgG的总阳性检出率为55.2%,其中IgG类抗体中anti-CMV IgG的阳性检出率最高,达84.36%(P<0.007);anti-TOX IgG阳性检出率最低,仅为1.22%(P<0.05,见表4)。
表4 anti-TORCH IgG抗体检测结果(%)
Table4 Prevalence of anti-TOX IgG, anti-RV IgG, anti-CMV IgG and anti-HSV IgG
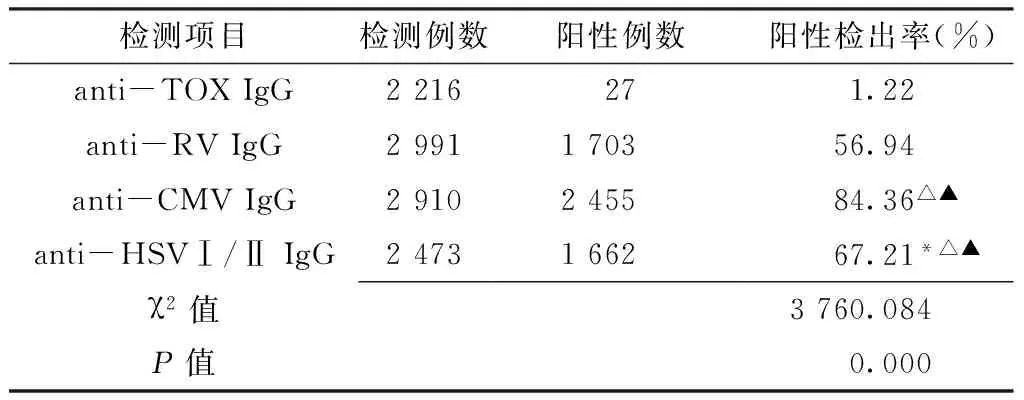
检测项目检测例数阳性例数阳性检出率(%)anti-TOXIgG2216271.22anti-RVIgG2991170356.94anti-CMVIgG2910245584.36△▲anti-HSVⅠ/ⅡIgG2473166267.21*△▲χ2值3760.084P值0.000
注:与anti-CMV IgG比较,*P<0.007;与anti-TOX IgG比较,△P<0.007;与anti-RV IgG比较,▲P<0.007
3 讨论
孕妇由于内分泌的改变和免疫力下降,尤其是T淋巴细胞免疫功能减弱而易发TORCH原发感染或使潜在的病毒活化引起复发感染,其感染呈世界性分布[3-6]。TORCH感染对孕妇身体影响较小,常为隐性感染,但各种病原体均可在孕期通过胎盘垂直传播胎儿,或通过孕妇生殖道逆行扩散,引起胎儿感染以及胎儿分娩时围生期感染,感染TORCH可导致胎儿畸形、早产或胎儿死亡、黄疸、肝脾肿大、永久性智力低下等疾病,甚至部分可导致血小板减少性紫癜[7]。因此,TORCH感染的潜伏性、危害性,加上诊断及治疗手段尚欠缺的现状,应重视对育龄期妇女进行TORCH的筛查。传统的病毒分离培养由于耗时、条件要求高,不适用于临床筛查;对孕妇进行血清学IgM、IgG检测,简便、快速,可辅助判断是否存在相应病原体感染及机体的免疫状态,国内以ELISA法应用最为广泛[2-3],目前国内关于TORCH感染阳性检出率的报道多数采用ELISA法进行检测,但ELISA法需手工操作,受试剂反应温度、温育时间、实验条件等诸多因素影响,且只能进行定性或半定量检测。为适应临床快速、准确诊断的要求,本研究采用CLIA对TORCH进行检测,该法测定的灵敏度高、特异度好,且具有抗干扰能力,适用于常规临床工作。对于血清学抗体筛查阳性的高危人群,可以进一步进行羊水、脐带血病毒核酸的检测等手段明确是否存在宫内感染。
国内外关于TORCH感染的阳性检出率报道不一[4-6,8],本研究显示anti-TOX、anti-RV、anti-CMV、anti-HSVⅠ/Ⅱ IgM的阳性检出率分别为0.62%、2.63%、2.54%、11.19%,其中anti-CMV IgM与国外文献报道结果一致,而anti-TOX IgM、anti-RV IgM阳性检出率均低于Tamer等[9]针对Turkey地区的报道(2.0%、4.3%),此可能与TORCH感染分布存在地域经济发展状况、气候、人群体质及种族差异等有关。此外,北京地区卫生条件较好亦可能是阳性检出率低于Turkey地区的原因之一;西方国家接触宠物、不全熟肉类加工的饮食习惯可能是anti-TOX IgM阳性检出率较高的重要原因。本研究中anti-TORCH IgG的总阳性检出率为55.2%,低于Tamer等[9]报道孕妇TORCH-IgG阳性检出率90%,各病原体的阳性检出率分别为1.22%、56.94%、84.36%、67.21%,均低于国外文献报道[5,9]。但高于国内杨树法等[10]报道北京地区孕妇TORCH感染率的ELISA结果,可能与CLIA方法的灵敏度提高有关。
本文结果还显示:与其他三季比较,anti-CMV IgM以秋季为高发期(阳性检出率为3.66%);anti-HSVⅠ/Ⅱ IgM 以春、秋两季为高发期(阳性检出率分别为12.48%和12.41%);anti-TOX IgM、anti-RV IgM在不同季节的阳性检出率无差异。anti-TOX IgM在2月份的阳性检出率最高,anti-RV IgM在6月份的阳性检出率最高。提示在各病原体感染相对高发季节及月份,应引起相应的重视,加强对该种病原体的检查,增加筛查数量及频率。此外,本研究还发现低龄孕妇组anti-HSVⅠ/ⅡIgM的阳性检出率高于高龄孕妇组,高龄孕妇组anti-TOX IgM、anti-CMV IgM的阳性检出率高于低龄孕妇组,anti-RV IgM两组间无统计学差异,此与国内匡红等[4]及国外Hao[11]的报道一致,可能与人群感染CMV后潜伏感染率高,而高孕龄人群体内免疫系统孕后改变较低龄孕妇组更为明显,CMV潜在感染更易激活有关,而TOX和RV感染人体的方式明显不同;此外,低龄孕妇组anti-HSVⅠ/Ⅱ IgM阳性检出率高于高龄孕妇组可能与HSVⅠ/Ⅱ主要以性接触为主要传播途径有关。
对TORCH感染提倡以预防为主,在人群中尤其是育龄期妇女普及对TORCH宫内感染的宣传力度,提高其对TORCH感染危害性的认识,自觉进行TORCH筛查,尤其是在TORCH相对高发季节,必要时对IgM阳性者进行治疗,以达到优生目的,对IgG阴性者及时接种疫苗以获得免疫力。本次调查结果显示anti-TORCH IgM阳性检出率较高,且孕妇TORCH感染后传染胎儿或新生儿的概率高达30%~45%[12],从优生优育的角度考虑,对孕前妇女进行TORCH特异性抗体检查及对IgM抗体阳性妇女进行定期监测,尤其是国内人口基数大,应用简便、快速的TORCH筛查方法,确定TORCH感染高危人群,必要时完善其他检测,进行跟踪随诊,是十分有必要的。同时也需要对anti-TORCH IgM阳性者谨慎分析,必要时进行核酸分析及羊水检查和B超等相关的产前诊断,以避免误诊和不必要的终止妊娠。
1 Nahmias AJ,Walls KW,Stewart JA,et al.The TORCH complex-perinatal infections associated with toxoplasma and rubella,cytomegol-and herpes simplex viruses[J].Pediatric Research,1971,5(8):405-406.
2 林贵高,李金明.临床实验室建立 TORCH 检验程序的重要性[J].中华检验医学杂志,2008,31(7):737-741.
3 易旺云,袁明生,曾彩霞.中山小榄地区孕早期孕妇TORCH-IgM 阳性率调查研究[J].中国全科医学,2013,16(10):3467-3469.
4 匡红,府伟灵,曹利.重庆地区 2067 例育龄妇女 TORCH 感染的调查研究[J].中华医院感染学杂志,2006,16(11):1254-1256.
5 Cowan FM,French RS,Mayaud P,et al.Seroepidemiological study of herpes simplex virus types 1 and 2 in Brazil,Estonia,India,Morocco,and Sri Lanka[J].Sex Transm Infect,2003,79(4):286-290.
6 Neirukh T,Qaisi A,Saleh N,et al.Seroprevalence of Cytomegalovirus among pregnant women and hospitalized children in Palestine[J].BMC Infect Dis,2013,13:528.
7 Sheng Yu Z,Tang LF,Zou CC,et al.Cytomegalovirus-associated idiopathic thrombocytopenic purpura in Chinese children[J].Scand J Infect Dis,2008,40(11/12):922-927.
8 付爱华.孕前及孕早期TORCH感染检测临床分析[J].中华实验和临床病毒学杂志,2009,23(4):307-308.
9 Tamer GS,Dundar D,Caliskan E.Seroprevalence of Toxoplasma gondii,rubella and cytomegalovirus among pregnant women in western region of Turkey[J].Clin Invest Med,2009,32(1):E43-47.
10 杨树法,李洋远,曾甲子,等.孕前以及妊娠妇女TORCH感染状况分析[J].检验医学与临床,2011,8(4):385-386.
11 Hao YF.Difference of Toxoplasma gondii infection status between urban and rural childbearing age women visiting to hospitals in southwest region of Shandong Province[J]. Zhongguo Xue Xi Chong Bing Fang Zhi Za Zhi,2013,25(1):113-114.
12 Eveline PJ,Ann CT MV,Frans JW,et al.How to use.neonatal TORCH testing.[J].Arch Dis Child Educ Pract Ed,2013,98(3):93-98.



