蒋忠胜,胡家光,温小凤,张 鹏,蒙达礼,刘志娟,柯 柳,覃 川
·论著·
合并人类免疫缺陷病毒感染的乙型肝炎患者YMDD自然变异研究
蒋忠胜*,胡家光,温小凤,张 鹏,蒙达礼,刘志娟,柯 柳,覃 川
目的 观察合并人类免疫缺陷病毒(HIV)感染的乙型肝炎患者在高效抗反转录病毒治疗(HAART)前是否存在YMDD自然变异。方法 选取2013年6月—2016年6月在广西柳州市人民医院感染病科治疗的合并HIV感染的乙型肝炎患者80例为研究对象,在接受HAART前采集血清,采用基因直接测序法进行YMDD检测。结果 对80例合并HIV感染的乙型肝炎患者检测,未发现YMDD自然变异。结论 经基因直接测序,未发现未经HAART的合并HIV感染的乙型肝炎患者存在YMDD自然变异。限于检测方法的灵敏度,有待于采用高灵敏度的检测方法进一步研究。
乙型肝炎;HIV;YMDD变异;药物耐受性
蒋忠胜,胡家光,温小凤,等.合并人类免疫缺陷病毒感染的乙型肝炎患者YMDD自然变异研究[J].中国全科医学,2017,20(14):1680-1683.[www.chinagp.net]
JIANG Z S,HU J G,WEN X F,et al.Natural YMDD mutations in HBV/HIV co-infected patients[J].Chinese General Practice,2017,20(14):1680-1683.
由于乙型肝炎病毒(HBV)和人类免疫缺陷病毒(HIV)具有相同的传播途径,在HIV的流行区有5%~10%的HIV感染者合并HBV感染[1],我国的广东地区HIV感染者中乙型肝炎表面抗原(HBsAg)阳性率高达9.5%(266/2 793)[2]。高效抗反转录病毒治疗(HAART)方案中拉米夫定(3TC)是合并HIV感染的乙型肝炎患者的骨干治疗药物[3],但3TC为低耐药基因屏障药物,在长期使用过程中HBV会出现酪氨酸-甲硫氨酸-天冬氨酸-天冬氨酶(YMDD)变异,治疗后1年耐药率为14%~32%,4年累积耐药率达70%[4]。不仅如此,近年研究显示,未经3TC治疗的HBV感染者体内也可检出YMDD基因变异毒株(YMDD自然变异毒株),且检出率达10%~30%[5-7]。而对合并HIV感染的乙型肝炎患者是否存在YMDD自然变异,目前国内外相关研究较少。本研究通过检测合并HIV感染的乙型肝炎患者YMDD自然变异,为乙型肝炎患者的治疗提供依据。
1 对象与方法
1.1 病例纳入与排除标准 纳入标准:符合中华医学会颁布的《艾滋病诊疗指南(2011版)》[8]及《慢性乙型肝炎防治指南(2010年版)》[9]的诊断标准。排除标准:(1)合并丙型、甲型、戊型肝炎;(2)单纯HIV感染或获得性免疫缺陷综合征(AIDS);(3)在接受HAART前采用口服核(苷)酸类抗HBV药物。
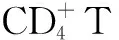
1.3 方法
1.3.1 主要试剂与仪器 HBV核酸定量检测试剂盒及配套试剂购自广东华银医药科技有限公司;PCR DSMIX购自广州东盛生物科技有限公司;PCR上机八排管购自美国Axygen公司;台式高速冷冻离心机(TGL-16)购自湖南湘仪实验室仪器开发有限公司;超低温冰箱(MDF-U333)购自日本SANYO公司;单面工作超净台(SW-CJ-2FD)购自苏州净化设备有限公司;DYY-6C电泳仪购自北京六一生物科技有限公司。
1.3.2 标本处理 取患者晨起空腹外周静脉血共10 ml,其中5 ml于当日检测肝功能、HBV DNA和乙型肝炎血清标志物(HBVM);另5 ml经8 000×g离心5 min,取上清液于-80 ℃冰箱中保存。
1.3.3 HBV DNA提取 用移液器取50 μl血清加到灭菌EP管中,加入200 μl核酸抽提液A,用移液器上下吹打约30次,室温静置3 min。加入200 μl核酸抽提液B,颠倒混匀后以13 000×g离心10 min。弃上清液,加入200 μl核酸抽提液C,颠倒混匀后以13 000×g离心5 min。弃上清液,晾干后加入20 μl双蒸水溶解,置于-20 ℃保存。
1.3.4 基因变异位点检测 采用巢式PCR进行目的条带扩增。外轮引物PrimerF1序列:5′-CATCCTGCTGCTATGCCTCATC -3′,PrimerR1序列:5′-TTGCCGRGCAACGGGGTAAAGG-3′;内轮引物PrimerF2序列:5′-GTATGTTGCCCGTTTGTCCTCTA-3′,PrimerR2序列:5′-TGACATACTTTCCAATCAATAGGYC-3′,引物由生工生物工程(上海)有限公司合成。巢式PCR外轮反应体系25 μl,包括ddH2O 8.5 μl,PCR MIX 12.5 μl,15 pmol/μl PrimerF1和PrimerR1各1 μl,DNA模板2 μl,反应参数:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸A尾1 min,共35个循环,最后72 ℃延伸10 min。巢式PCR内轮反应体系25 μl,包括ddH2O 8.5 μl,PCR MIX 12.5 μl,15 pmol/μl PrimerF2和PrimerR2各1 μl,DNA模板2 μl,反应参数:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸A尾1 min,共35个循环,最后72 ℃延伸10 min。先进行外轮PCR扩增,然后进行1.0%琼脂糖凝胶电泳分析,有目的条带则进行下一步测序处理,无目的条带则进行内轮扩增,扩增出的目的片段送华大基因经纯化后进行测序,并进行测序结果分析。
2 结果
58例患者检测到编码rtL180的碱基突变,碱基突变均为C→T,但所编码的氨基酸不变;各患者均未检测到编码rtM204的碱基突变,即80例患者均未发现YMDD自然变异。
3 讨论
全球有4 000万慢性HBV感染者,每年因乙型肝炎相关性肝硬化和肝癌导致的死亡达(50~75)万例[10],以干扰素和核苷(酸)类似物为代表的抗病毒治疗是治疗CHB最有效的方法,其中3TC是全世界首个在临床应用的核苷(酸)类抗病毒药物。大量的研究证实,3TC能有效抑制HBV的复制,增加HBeAg转阴率和乙型肝炎e抗体(HBeAb)血清转换率,恢复肝功能,改善肝组织学[11],由于其疗效确切、价格低廉,目前仍在我国广泛使用[6]。但是,长时间的3TC治疗可诱发YMDD变异,使HBV对3TC耐药[4]。不仅如此,越来越多的证据认为,CHB患者存在YMDD自然变异的现象,发生率为0~31.58%[6]。张为民等[12]对144例未经抗病毒治疗的CHB患者研究发现,30例出现YMDD自然变异,变异检出率为20.8%,其中YIDD阳性19例(63.3%),YVDD阳性8例(26.7%),YIDD与YVDD均阳性3例(10.0%)。彭瑛等[13]对90例未使用过3TC的CHB患者研究发现,发生YIDD变异6例(6.7%),YVDD变异24例(26.7%),YIDD与YVDD均变异6例(6.7%)。殷先尧等[14]采用引物特异性实时荧光PCR对51例未进行抗HBV治疗的CHB患者进行检测,发现YMDD自然变异毒株检出率为25.5%(13/51)。目前关于HBV发生YMDD自然变异的原因,多数学者较认同选择学说。HBV复制过程中前基因组RNA反转录为负链DNA期间,反转录酶缺乏自然校正的功能,难以纠正核苷酸变异,即CHB患者机体内外部的一些因素导致HBV基因突变,生物的选择作用使得患者感染的HBV本身已经发生变异,当机体免疫系统对已感染的野生株HBV产生强力的特异性免疫应答后,野生株HBV的复制被抑制,变异株逃逸形成抗病毒免疫力,从劣势株逐渐成为优势株[15]。
但是,也有部分研究发现,在未经任何抗病毒药物治疗的无症状HBV携带者中未发现YMDD变异,如TAUSEEF等[16]对巴基斯坦未使用3TC治疗的CHB患者应用限制性片段长度多态性聚合酶链反应(PCR-RFLP)检测,未发现有YMDD自然变异;RAMEZANI等[17]对伊朗77例未使用3TC治疗的CHB患者应用PCR-RFLP检测,同样未发现有YMDD自然变异。
梁欣[18]对使用含3TC的HAART的39例HIV与HBV合并感染者采用PCR反向点杂交法检测,发现YMDD变异检出率达41%,随着治疗时间的延长,YMDD变异的检出率逐渐增加,治疗6~12、12~24、24~36个月时YMDD检出率分别为10.0%、42.1%、70.0%。兰青等[19]对20例合并HIV感染的乙型肝炎患者在HAART过程检出YMDD变异8例,检出率为40%,其中YIDD变异2例,YVDD变异6例,且均伴rtL180M位点变异。表明在合并HIV感染的乙型肝炎患者中,YMDD变异率较高。但是,国内尚未见合并HIV感染的乙型肝炎患者基线YMDD变异的研究。
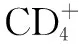
本研究经基因直接测序,未发现未经HAART的合并HIV感染的乙型肝炎患者存在YMDD自然变异。该结论有待扩大样本量,采取更敏感的基因检测方法进一步验证。
作者贡献:蒋忠胜、胡家光进行文章的构思与设计;胡家光进行研究的实施与可行性分析,并进行结果的分析与解释;张鹏、蒙达礼、刘志娟、柯柳、覃川进行数据收集、整理;蒋忠胜撰写论文,对文章整体负责,监督管理;胡家光、温小凤进行论文的修订。
本文无利益冲突。
[1]SARKAR J,SAHA D,BANDYOPADHYAY B,et al.Baseline characteristics of HIV & hepatitis B virus (HIV/HBV) co-infected patients from Kolkata,India[J].Indian J Med Res,2016,143(5):636-642.DOI:10.4103/0971-5916.187113.
[2]HUANG S M,CAI W P,HU F Y,et al.Epidemiological and clinical characteristics of hepatitis B virus in HIV-infected patients in Guangdong,China[J].Int J STD AIDS,2016,27(10):890-897.DOI:10.1177/0956462415600570.
[3]MAGORO T,GACHARA G,MAVHANDU L,et al.Serologic and genotypic characterization of hepatitis B virus in HIV-1 infected patients from South West and Littoral Regions of Cameroon[J].Virol J,2016,13(1):178.DOI:10.1186/s12985-016-0636-x.
[4]POORTAHMASEBI V,MALEKZADEH R,MONTAZERI G,et al.Lamivudine resistance and precore variants in iranian patients with chronic hepatitis B:correlation with virological and clinical features[J].Jundishapur J Microbiol,2015,8(9):e20262.DOI:10.5812/jjm.20262.
[5]LEE S H,KIM H S,BYUN I S,et al.Pre-existing YMDD mutants in treatment-naïve patients with chronic hepatitis B are not selected during lamivudine therapy[J].J Med Virol,2012,84(2):217-222.DOI:10.1002/jmv.23191.
[6]TAN Y W,YE Y,GE G H,et al.Natural YMDD-motif mutants affect clinical course of lamivudine in chronic hepatitis B[J].World J Gastroenterol,2015,21(7):2089-2095.DOI:10.3748/wjg.v21.i7.2089.
[7]王莉莉,于新娟,董全江,等.青岛地区乙型肝炎病毒基因分型及YMDD自然变异的研究[J].中华实验和临床病毒学杂志,2012,26(4):250-252.DOI:10.3760/cma.j.issn.1003-9279.2012.04.003. WANG L L,YU X J,DONG Q J,et al.HBV genotype distribution and YMDD spontaneous mutation in Qingdao population[J].Chinese Journal of Experimental and Clinical Virology,2012,26(4):250-252.DOI:10.3760/ cma.j.issn.1003-9279.2012.04.003.
[8]中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南(2011版)[J].中华传染病杂志,2011,29(10):133-144.DOI:10.3760/cma.j.issn.1000-6680.2011.10.018. AIDS Group,Society of Infectious Diseases,Chinese Medical Association.The guideline of diagnosis and treatment for acquired immunodeficiency syndrome(2011 version) [J].Chinese Journal of Infectious Diseases,2011,29(10):133-144.DOI:10.3760/cma.j.issn.1000-6680.2011.10.018.
[9]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华传染病杂志,2011,29(2):65-80.DOI:10.3760/cma.j.issn.1000-6680.2011.02.001. Chinese Society of Hepatology,Chinese Society of Infectious Diseases,Chinese Medical Association.The guideline of prevention and treatment for chronic hepatitis B (2010 version)[J].Chinese Journal of Infectious Diseases,2011,29(2):65-80.DOI:10.3760/cma.j.issn.1000-6680.2011.02.001.
[10]TAN Y,DING K,SU J,et al.The naturally occurring YMDD mutation among patients chronically infected HBV and untreated with lamivudine:a systematic review and meta-analysis[J].PLoS One,2012,7(3):e32789.DOI:10.1371/journal.pone.0032789.
[11]MA Y,YUAN Y,MA X,et al.Association between clinical features and YMDD mutations in patients with chronic hepatitis B following lamivudine therapy[J].Exp Ther Med,2016,12(2):847-853.DOI:10.3892/etm.2016.3365.
[12]张为民,唐曙明,谢亚琴,等.慢性乙型肝炎患者YMDD自然变异的临床观察[J].国际医药卫生导报,2013,19(11):1569-1571.DOI:10.3760/cma.j.issn.1007-1245.2013.11.006. ZHANG W M,TANG S M,XIE Y Q,et al.Spontaneous YMDD mutation in patients with chronic hepatitis B[J].International Medicine and Health Guidance News,2013,19(11):1569-1571.DOI:10.3760/cma.j.issn.1007-1245.2013.11.006.
[13]彭瑛,邓正华,温先勇.慢性乙型肝炎患者治疗前后乙型肝炎病毒YMDD 突变情况分析[J].现代医药卫生,2015,31(7):991-993.DOI:10.3969/j.issn.1009-5519.2015.07.012. PENG Y,DENG Z H,WEN X Y.Analysis of HBV YMDD mutations in patients with chronic hepatitis B before and after lamivudine therapy[J].Journal of Modern Medicine & Health,2015,31(7):991-993.DOI:10.3969/j.issn.1009-5519.2015.07.012.
[14]殷先尧,孟佳,方芳,等.慢性乙肝患者 HBV DNA载量与YMDD自然变异之的相关性[J].安徽医药,2014,18(7):1296-1298.DOI:10.3969/j.issn.1009-6469.2014.07.031. YIN X Y,MENG J,FANG F,et al.Correlation between HBV DNA load and YMDD mutations in patients with chronic hepatitis B[J].Anhui Medical and Pharmaceutical Journal,2014,18(7):1296-1298.DOI:10.3969 /j.issn.1009-6469.2014.07.031.
[15]PONDÉ R A,CARDOSO D D,FERRO M O.The underlying mechanisms for the ′anti-HBc alone ′ serological profile[J].Arch Virol,2010,155(2):149-158.DOI:10.1007/s00705-009-0559-6.
[16]TAUSEEF I,IQBAL F,REHMAN W,et al.A PCR-RFLP based protocol for the detection of hepatitis B virus variants in some lamivudine-untreated chronic hepatitis B virus carriers in Pakistan[J].Pak J Pharm Sci,2012,25(2):349-352.
[17]RAMEZANI A,VELAYATI A A,ROSHAN M R,et al.Rate of YMDD motif mutants in lamivudine- untreated Iranian patients with chronic hepatitis B virus infection[J].Int J Infect Dis,2008,12(3):252-255.DOI:10.1016/j.ijid.2007.08.003.
[18]梁欣.含拉米夫定的高效抗反转录病毒治疗对HIV/HBV合并感染者YMDD变异的影响[J].中国实用医药,2013,8(10):4-6.DOI:10.3969/j.issn.1673-7555.2013.10.002. LIANG X.YMDD mutation induced by lamivudine as a component of HAART in HIV/HBV co-infected patients[J].China Practical Medical,2013,8(10):4-6.DOI:10.3969/j.issn.1673-7555.2013.10.002.
[19]兰青,韦嘉,范晶华,等.合并HIV感染的乙肝患者经含拉米夫定的HAART治疗后YMDD变异[J].昆明医科大学学报,2015,36(6):163-167. LAN Q,WEI J,FAN J H,et al.YMDD mutation induced by lamivudine as component of HAART in HIV/HBV co-infected patients[J].Journal of Kunming Medical University,2015,36(6):163-167.
[20]杨进.病毒类疫苗的相互干扰现象[J].中国生物制品学杂志,2009,22(9):941-944.DOI:10.5297/ser.1201.002. YANG J.Interference between viral vaccines[J].Chinese Journal of Biological Science,2009,22(9):941-944.DOI:10.5297/ser.1201.002.
[21]屈军校,曾庆磊,徐光华.慢性HBV感染YMDD自然变异的研究进展[J].世界华人消化杂志,2010,18(9):902-905.DOI:10.3969/j.issn.1009-3079.2010.09.008. QU J X,ZENG Q L,XU G H.Advances in research on natural YMDD mutations in the hepatitis B virus DNA polymerase in patients with chronic hepatitis B[J].World Chinese Journal of Digestology,2010,18(9):902-905.DOI:10.3969/j.issn.1009-3079.2010.09.008.
(本文编辑:吴立波)
Natural YMDD Mutations in HBV/HIV Co-infected Patients
JIANGZhong-sheng*,HUJia-guang,WENXiao-feng,ZHANGPeng,MENGDa-li,LIUZhi-juan,KELiu,QINChuan
DepartmentofInfectiousDiseases,LiuzhouGeneralHospital,Liuzhou545006,China*Correspondingauthor:JIANGZhong-sheng,Chiefphysician;E-mail:jiangzs1111@126.com
Objective To investigate whether there are natural tyrosine-methionine-aspartate-aspartate (YMDD) mutations in patients with hepatitis B virus(HBV) and HIV co-infection before receiving the highly active antiretroviral therapy(HAART).Methods The participants enrolled in this study were 80 patients with HIV and HBV co-infection treated in Department of Infectious Diseases,Guangxi Liuzhou General Hospital from June 2013 to June 2016.Direct sequencing was used to detect the status of YMDD in the HBV DNA polymerase gene in the serum of the patients before receiving the HAART.Results No natural YMDD mutations were found in these patients.Conclusion The natural YMDD mutations are not found in HBV and HIV co-infection patients before receiving the HAART by direct sequencing.But this result needs to be further confirmed by the method with higher sensitivity.
Hepatitis B;HIV;YMDD mutation;Drug tolerance
广西自然科学基金资助项目(2013GXNSFAA019213)
R 373.21
A
10.3969/j.issn.1007-9572.2017.14.006
2016-12-26;
2017-03-13)
545006广西柳州市人民医院感染病科
*通信作者:蒋忠胜,主任医师;E-mail:jiangzs1111@126.com



