陈柯豫,黄艳齐,张玲利
·论 著·
缺血性肠炎的临床表现及内镜特点分析
陈柯豫,黄艳齐,张玲利
郑州大学第一附属医院消化内科,河南郑州 450052
分析缺血性肠炎的临床表现及内镜特点。收集2015年1月至2022年12月于郑州大学第一附属医院确诊的109例缺血性肠炎患者的临床资料,分析其临床表现、危险因素、实验室检查、内镜及影像学检查特征。共纳入109例患者,男43例,女66例,平均年龄(62.2±12.3)岁;临床表现以腹痛、腹泻、便血为主。结肠镜下病变常呈节段性分布,主要表现为黏膜充血、水肿、糜烂、溃疡,部分可见溃疡处覆有脓苔、黏膜下血管网消失;病理表现为黏膜慢性炎症或黏膜慢性活动性炎症伴糜烂。左半结肠为最常见的受累部位,共88例;其次为全结肠(14例)、右半结肠(9例)、直肠(9例),合并肠息肉27例。实验室检查见白细胞(43例)、C反应蛋白(61例)、D-二聚体(64例)升高。缺血性肠炎好发于有基础疾病的中老年人群,常以腹痛、腹泻、便血为主要临床表现,最易累及左半结肠,内镜下可见黏膜充血、水肿、糜烂、溃疡,且实验室指标常有改变。
缺血性肠炎;临床特点;内镜特点
缺血性肠炎是由结肠急慢性缺血引起的结肠炎症性疾病。缺血性肠炎老年人多见,临床可表现为腹痛、腹泻、便血,内镜下可见黏膜充血、水肿、瘀斑及黏膜脱落、溃疡形成等。近年来缺血性肠炎的发病率明显增加[1]。现回顾性分析2015年1月至2022年12月于郑州大学第一附属医院确诊的109例缺血性肠炎患者的临床资料,以增加对缺血性肠炎的认知,提高临床诊断率,减少误诊。
1 资料与方法
1.1 一般资料
收集2015年1月至2022年12月于郑州大学第一附属医院确诊的109例缺血性肠炎患者的临床资料。纳入标准:①有腹痛、腹泻、便血等消化道症状;②经结肠镜检查及病理检查确诊。排除标准:①有炎症性肠病、感染性肠病、结肠癌、伪膜性肠炎等相关肠道疾病;②肝硬化门静脉血栓形成;③临床资料不完整。本研究经郑州大学第一附属医院医学伦理委员会批准(伦理审批号:2022-KY-1392-001)。
1.2 研究方法
收集患者的一般临床资料、危险因素、临床表现、实验室检查指标、内镜特征、影像学检查、治疗及预后等相关信息。一般临床资料包括年龄、性别,危险因素包括吸烟情况、饮酒情况、高血压、糖尿病、冠心病、脑梗死、心房颤动、高脂血症、肺部疾病、血液系统疾病、慢性肾脏病、腹部手术史及家族消化道肿瘤疾病史。实验室检查指标包括白细胞、血红蛋白、C反应蛋白、D-二聚体。
1.3 统计学方法
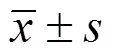
2 结果
2.1 临床特征
共纳入109例患者,其中男43例,女66例,平均年龄(62.2±12.3)岁。临床表现:腹痛96例,腹泻58例,便血89例,腹胀9例,恶心14例,呕吐11例,便秘1例,发热5例,心慌2例,反酸1例,肠梗阻8例。
2.2 危险因素
109例患者中,有吸烟史16例,饮酒史2例,高血压39例,糖尿病20例,冠心病18例,脑梗死13例,高脂血症29例,心房颤动6例,慢性肺部疾病8例,血液系统疾病4例,慢性肾脏病4例,有消化道肿瘤家族史20例,腹部手术史25例。
2.3 内镜特征
内镜下主要表现为黏膜充血、水肿、糜烂、溃疡,部分可见溃疡处覆有脓苔、黏膜下血管网消失,病变呈节段性分布,见图1。病变累及全结肠14例,左半结肠88例,右半结肠9例,直肠9例,合并肠息肉27例。
2.4 病理表现
以黏膜慢性炎症或黏膜慢性活动性炎症为主,伴糜烂及黏膜水肿,可见炎性渗出及色素沉积,少数淋巴细胞、浆细胞、嗜酸性粒细胞浸润,部分有腺体萎缩甚至合并低级别上皮内瘤变。
2.5 辅助检查
109例患者中,外周白细胞升高43例,C反应蛋白升高61例,D-二聚体升高64例,血红蛋白下降35例。51例(46.8%)患者行腹部计算机体层血管成像(computed tomography angiography,CTA)检查,其中34例有阳性发现,包括肠系膜动脉钙斑形成2例,肠系膜血管狭窄21例,腹主动脉粥样硬化、斑块形成10例,肠系膜上动脉压迫1例。
2.6 治疗及预后
109例患者均卧床休息、暂禁食,给予抑酸、保护胃肠黏膜、改善循环等药物治疗,并辅以营养支持;根据临床症状不同,给予止血、纠正电解质紊乱、解痉等药物治疗,患者均病情好转后出院。其中1例合并肠梗阻的患者半年后因肠梗阻在外院行小肠切除术。
3 讨论
缺血性肠炎好发于老年人,且随年龄增长,发病率增加,女性的患病率高于男性[2-3]。本研究共纳入109例患者,其中女66例,占比61%,平均年龄(62.2±12.3)岁,与上述研究相符。缺血性肠炎好发于女性,可能与女性的便秘、肠易激综合征发病率较高有关[4]。缺血性肠炎的临床表现缺乏特异性,且差异较大,误诊率较高。缺血性肠炎的主要临床表现为腹痛、腹泻、便血,一般起病较急[5]。本研究中患者以腹痛、腹泻、便血为主要临床表现,同时可伴有恶心、呕吐。陈振伟等[4]研究发现缺血性肠炎患者合并肠梗阻的比例为5.3%。本研究中肠梗阻占比7.3%,肠梗阻可导致肠腔压力升高、血液循环不畅,从而引起部分肠管缺血,但与此相关的研究不多,二者之间的关系仍需进一步研究。
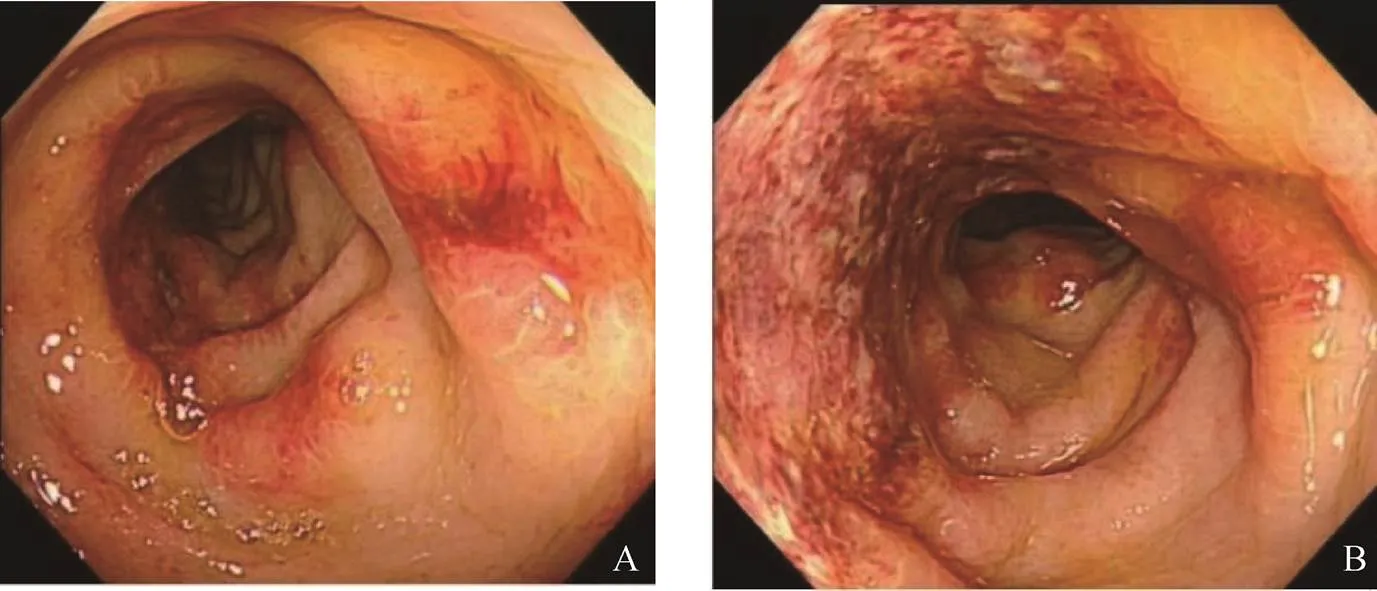
图1 缺血性肠炎结肠镜下所见
A.降结肠;B.乙状结肠
各种可能引起肠黏膜供血不足的原因均可导致缺血性肠病的发生。Park等[6]研究发现,合并高血压、糖尿病、心肌梗死等基础疾病者患缺血性肠炎的风险显著高于无基础疾病者。林琳等[7]研究表明,高血压、外周动脉硬化、腹部手术史、冠状动脉粥样硬化性心脏病和高脂血症均为缺血性肠炎患者高发的基础疾病。腹部手术可导致患者腹腔发生不同程度的粘连,从而影响肠道正常蠕动,导致结肠血液供应减少,或因此使得肠腔压力增高,在多种因素的共同作用下诱发缺血性肠炎[8]。
高脂血症、白细胞升高等导致的血液高凝状态可引起缺血性肠炎。本研究中26.6%的患者合并高脂血症,既往研究也发现血脂升高是缺血性肠炎的危险因素,尤其以三酰甘油、总胆固醇、低密度脂蛋白胆固醇升高为主[3]。D-二聚体是纤维蛋白单体溶解形成的特异性产物,是纤维蛋白被Ⅷ因子活化后再经纤溶酶水解的产物,多项研究显示D-二聚体与缺血性肠炎相关[9-10]。本研究中,缺血性肠炎患者合并高血压、高脂血症的比例较高,与既往研究基本一致。
缺血性肠炎的结肠镜下表现无明显特异性,病变常呈节段性,早期内镜下可见黏膜苍白、水肿,散在斑片状出血,严重时黏膜糜烂,出现浅溃疡、黏膜下血管网消失、青紫色或褐色黏膜结节,部分肠段可因黏膜水肿出现明显的狭窄,慢性缺血可导致溃疡、黏膜萎缩等[11]。本研究中病理表现以黏膜慢性炎症或黏膜慢性活动性炎症为主,少数有淋巴细胞、浆细胞、嗜酸性粒细胞浸润。研究显示部分患者也可见纤维结缔组织增生、渗出、小血管内纤维素样血栓及巨噬细胞内含铁血黄素沉积[3,12]。多项研究显示缺血性肠炎常累及左半结肠,这与肠道血供分布有关[13-15]。盲肠、升结肠和横结肠由肠系膜上动脉供应,降结肠、乙状结肠和大部分直肠由肠系膜下动脉供应。肠系膜上、下动脉的较大分支形成动脉弓,称为边缘动脉,从其发出直动脉供应结肠,边缘动脉在结肠脾曲细小,因此,结肠脾曲易发生缺血。而小肠侧支循环丰富,直肠具有双重血供,均不易发生缺血。研究显示,右半结肠缺血是缺血性肠炎患者手术或死亡的独立危险因素,常提示肠道损伤严重,预后差[5]。结肠镜检查被认为是缺血性肠炎诊断的金标准[16-17];但有报道称结肠镜检查可加重缺血性肠炎,故操作时宜轻柔、谨慎[18]。
王晓凤等[19]研究纳入21例行CT检查的缺血性肠炎患者,均行肠系膜血管三维重建,肠系膜血管病变13例,其中8例为肠系膜上动脉主干狭窄或分支狭窄,5例肠系膜下动脉起始见粥样硬化斑块但未致管腔明显狭窄。本研究结果与之相似。目前认为缺血性肠炎多为低灌注和血流恢复时再灌注损伤所致,所以CTA对本病诊断的作用有限,但仍能提供一定信息。
部分患者病程呈一过性及自限性,故建议在发病72h内行结肠镜检查[20]。本病以内科治疗为主,通常认为疾病早期及时改善肠道血供可使症状快速消失,疾病恢复较快,故常给予禁食、补液、抗感染、改善循环等治疗,注意监测各项指标,积极治疗原发病。研究显示经导管局部给药亦可发挥不错的作用[21]。本研究109例患者均在禁食、抗感染、改善循环等保守治疗后病情好转出院,但若患者腹部压痛加重,出现肌紧张、反跳痛、体温升高及肠麻痹,表明有肠梗死,需立即行手术治疗。
综上所述,当临床上收治以腹痛、腹泻、便血为主要临床表现且有相关危险因素的中老年人,应警惕缺血性肠炎的可能,尽早行结肠镜、CTA及相关实验室检查,可提高诊断的准确率。
[1] GLAUSER P M, WERMUTH P, CATHOMAS G, et al. Ischemic colitis: Clinical presentation, localization in relation to risk factors, and long-term results[J]. World J Surg, 2011, 35(11): 2549–2554.
[2] HIGGINS P D, DAVIS K J, LAINE L. Systematic review: The epidemiology of ischaemic colitis[J]. Aliment Pharmacol Ther, 2004, 19(7): 729–738.
[3] 王薇, 许乐. 缺血性结肠炎89例临床特征及其相关危险因素分析[J]. 中华内科杂志, 2012, 51(10): 769–773.
[4] 陈振伟, 姚飞, 胡毕文, 等. 缺血性结肠炎发病危险因素分析[J]. 浙江医学, 2019, 41(13): 1426–1427.
[5] GILSHTEIN H, HALLON K, KLUGER Y. Ischemic colitis caused increased early and delayed mortality[J]. World J Emerg Surg, 2018, 13: 31.
[6] PARK C J, JANG M K, SHIN W G, et al. Can we predict the development of ischemic colitis among patients with lower abdominal pain?[J]. Dis Colon Rectum, 2007, 50(2): 232–238.
[7] 林琳, 吴静, 刘揆亮. 老年缺血性结肠炎51例临床特征分析[J]. 中华消化杂志, 2019, 39(7): 478–480.
[8] UCHIDA T, MATSUSHIMA M, ORIHASHI Y, et al. A case-control study on the risk factors for ischemic colitis[J]. Tokai J Exp Clin Med, 2018, 43(3): 111–116.
[9] 冯巨滨. 血浆D-二聚体检测在缺血性肠病患者诊断及预后中的价值[J]. 中国医药科学, 2012, 2(12): 111, 113.
[10] 卢向东, 张志广. 血浆D-二聚体检测对缺血性肠病鉴别诊断价值的探讨[J]. 中华消化内镜杂志, 2010, 27(8): 433–434.
[11] 师水生. 缺血性肠病的诊断[J]. 世界华人消化杂志, 2001, 9(12): 1425–1426.
[12] 姚玉玲, 曹俊, 刘文佳, 等. 85例缺血性结肠炎患者内镜表现及病理特点分析[J]. 中华消化杂志, 2010, 30(3): 158–161.
[13] 邓勇彬, 赖亚栋. 76例缺血性肠病并出血临床特点分析[J]. 右江医学, 2020, 48(9): 695–700.
[14] 秦颖, 张旭艳, 童瑞, 等. 41例缺血性肠病的相关危险因素分析[J]. 解放军医学院学报, 2016, 37(10): 1050–1052, 1063.
[15] LONGSTRETH G F, YAO J F. Epidemiology, clinical features, high-risk factors, and outcome of acute large bowel ischemia[J]. Clin Gastroenterol Hepatol, 2009, 7(10): 1075–1080.
[16] FITZGERALD J F, HERNANDEZ Ⅲ L O. Ischemic colitis[J]. Clin Colon Rectal Surg, 2015, 28(2): 93–98.
[17] FEUERSTADT P, BRANDT L J. Colon ischemia: Recent insights and advances[J]. Curr Gastroenterol Rep, 2010, 12(5): 383–390.
[18] FENSTER M, FEUERSTADT P, BRANDT L J, et la. Real-world multicentre experience of the pathological features of colonic ischaemia and their relationship to symptom duration, disease distribution and clinical outcome[J]. Colorectal Dis, 2018, 20(12): 1132–1141.
[19] 王晓凤, 文娣娣, 赵宏亮, 等. 缺血性结肠炎的CT表现[J]. 中华消化病与影像杂志(电子版), 2018, 8(3): 107–111.
[20] AOKI T, NAGATA N, SAKAMOTO K, et al. Abdominal fat accumulation, as measured by computed tomography, increases the risk of ischemic colitis: A retrospective case-control study[J]. Dig Dis Sci, 2015, 60(7): 2104–2111.
[21] 王进富, 吴刚, 奚聃. 观察内科保守联合介入治疗缺血性结肠炎的临床疗效[J]. 当代医学, 2017, 23(16): 89–90.
Analysis of clinical manifestations and endoscopic characteristics of ischemic enteritis
Department of Gastroenterology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, Henan, China
To analyze clinical manifestations and endoscopic characteristics of ischemic enteritis.The clinical data of 109 patients with ischemic enteritis diagnosed in the First Affiliated Hospital of Zhengzhou University from January 2015 to December 2022 were collected, and their clinical manifestations, risk factors, laboratory examination, endoscopic characteristics and imaging examination characteristics were analyzed.A total of 109 patients were included, including 43 males and 66 females, with a mean age of (62.2±12.3) years. The clinical manifestations were mainly abdominal pain, diarrhea, and hematochezia. Under colonoscopy, the lesions often presented segmental distribution, and the main manifestations were mucosal congestion, edema, erosion, and ulcers. Some ulcers were covered with pus coating and the submucosal vascular network disappeared. The major manifestations in pathological were chronic or chronic active inflammation of the mucous membranes with erosions. The left colon was the most common site of involvement, with a total of 88 cases, followed by the whole colon (14 cases), the right colon (9 cases), rectum (9 cases), and intestinal polyps in 27 cases. Laboratory tests showed elevated white blood cells (43 cases), C-reactive protein (61 cases), and D-dimer (64 cases).Ischemic enteritis tends to occur in middle-aged and elderly people with underlying diseases, often with abdominal pain, diarrhea, hematochezia as the main clinical manifestations, the most likely to involve the left colon. Mucosal edema, erosion and ulcer can be seen under endoscope, and laboratory indexes often change.
Ischemic enteritis; Clinical characteristics; Endoscopic characteristics
R516.1
A
10.3969/j.issn.1673-9701.2023.19.001
(2022–09–20)
(2023–06–12)
国家自然科学基金项目(81802859)
张玲利,电子邮箱:zhangllzzu@163.com



