师伟 刘瑞芬 杨晓娜 徐丽
炎症细胞因子网络中,活化内皮细胞、单核细胞分泌的细胞因子和炎性介质能激活细胞核转录因子,促使更多细胞因子释放,扩大炎症反应。前炎症细胞因子是炎症反应的生理信使分子,当炎症反应失控时损伤组织,被证实与急慢性炎症疼痛的产生密切相关[1]。肿瘤坏死因子-α(TNF-α)是具有广泛生物活性的前炎症细胞因子,感染、创伤时,TNF-α可升高[1];作为急性炎症反应的关键介质白介素-1β(IL-1β),是启动抗菌炎性反应的关键细胞因子之一[2];白介素-8(IL-8)能帮助募集中性粒细胞和单核细胞进入炎症部位、调节白细胞黏附分子的表达[3]。因此,三者血清水平的变化,会影响机体炎症反应程度和性质,从而影响慢性盆腔炎的发展和结局。本研究旨在从前炎症细胞因子方面,探讨活血化瘀法防治慢性盆腔炎的作用机理。
1 材料与方法
1.1 动物选择及分组 选择SPF级Wistar雌性成年大鼠60只,体重(200±20)g(山东大学实验动物中心提供,SCXK【鲁】20030004),常规饲养一周,适应环境后,按体重随机分为慢性盆腔炎造模组(模型组),桂枝茯苓胶囊治疗高、中、低剂量组(高、中、低剂量实验组),少腹逐瘀胶囊治疗组(对照组),各组均为12只,另选假手术慢性盆腔炎造模大鼠(假手术组)、正常饲养未干预大鼠(正常组)各12只。
1.2 实验试剂
1.2.1 大鼠血清TNF-α、IL-1β、IL-8的ELISA检测试剂盒(美国ADL公司生产)。
1.2.2 菌液配制 将大肠杆菌(山东中医药大学附属医院菌种室提供)、乙型溶血性链球菌(山东省卫生防疫站提供)和金黄色葡萄球菌(山东中医药大学附属医院菌种室提供)按2:1:1分别接种于血平板35 ℃,24 h后,稀释菌液,无菌生理盐水2 ml,分别取经24 h培养的菌株数个,用标准麦氏管(相当30亿个菌)比浊,制成浓度30亿/ml的混合细菌悬液。
1.2.3 实验药物 桂枝茯苓胶囊(江苏康缘药业股份有限公司生产,国药准字Z10950005),用蒸馏水制成31 mg/ml悬浊液;少腹逐瘀胶囊(东阿澳东药业有限公司生产,国药准字Z20000085),用蒸馏水制成45 mg/ml悬浊液。
1.3 实验方法及指标检测 采用混合细菌加机械损伤造模法[4],大鼠腹腔麻醉取仰卧位,取下腹正中切口1 cm,暴露并固定子宫,每侧宫腔内注入0.1 ml菌液,注入前注射器机械损伤子宫内膜组织;假手术组动物开腹后,双侧宫腔内分别注入0.1 ml无菌蒸馏水关腹,术后均不使用抗生素。高、中、低剂量实验组分别按临床2倍、1倍、1/2倍剂量,每天给予桂枝茯苓胶囊配制液502、251、125 mg/kg灌胃;对照组按临床等效剂量,每天给予少腹逐瘀胶囊配制液364 mg/kg灌胃。模型组、假手术组、正常组予蒸馏水灌胃,每100克灌胃1 ml/d。各组均为造模后第22天开始灌胃,连续14 d。
给药后第15天清晨禁食,1%戊巴比妥钠(30 mg/kg)腹腔麻醉后,心脏取血8 ml,抗凝离心每分钟3000 r取上清液,-30 ℃以下保存,酶联免疫吸附法(ELISA法)检测血清指标(按ELISAkit操作说明进行)。
1.4 统计学处理 应用SPSS 12.0软件统计,计量资料以(±s)表示,采用F检验和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠用药结束后血清TNF-α检测比较 模型组血清TNF-α水平较正常组、假手术组明显升高(P<0.01);中剂量实验组较模型组明显降低(P<0.01),且接近正常组水平(P>0.05),对照组较正常组明显升高,差异有统计学意义(P<0.01);中剂量实验组较对照组降低,差异有统计学意义(P<0.05),高剂量实验组较对照组升高,差异无统计学意义(P>0.05),低剂量实验组较对照组明显升高,差异有统计学意义(P<0.01);中剂量实验组血清TNF-α水平,较高、低剂量实验组明显降低(P<0.01),高剂量实验组较低剂量实验组亦明显降低(P<0.01)。见表1。
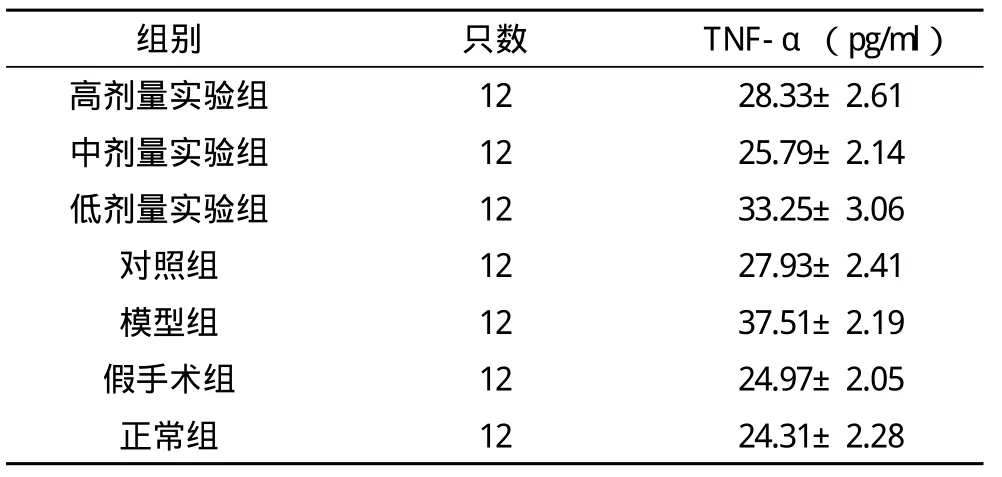
表1 各组大鼠用药结束后血清TNF-α检测比较
2.2 各组大鼠用药结束后血清IL-1β检测比较 血清IL-1β水平,模型组较正常组、假手术组明显升高(P<0.01);高、中剂量实验组、对照组较模型组明显降低(P<0.01),且接近正常组水平(P>0.05);高、中剂量实验组较对照组降低,但差异无统计学意义(P>0.05),低剂量实验组较对照组升高,差异有统计学意义(P<0.01);高、中剂量实验组血清IL-1β水平,较低剂量实验组明显降低(P<0.01),中剂量实验组较高剂量实验组降低,但差异无统计学意义(P>0.05)。见表2。

表2 各组大鼠用药结束后血清IL-1β检测比较
2.3 各组大鼠用药结束后血清IL-8检测比较 模型组血清IL-8水平较正常组、假手术组明显升高(P<0.01);中剂量实验组较模型组明显降低(P<0.01),且接近正常组水平(P>0.05);对照组较正常组明显升高,差异有统计学意义(P<0.01);中剂量实验组较对照组降低,差异有统计学意义(P<0.05),高剂量实验组较对照组升高,差异无统计学意义(P>0.05),低剂量实验组较对照组明显升高,差异有统计学意义(P<0.01);中剂量实验组血清IL-8水平,较高、低剂量实验组明显降低(P<0.01),高剂量实验组较低剂量实验组亦降低(P<0.05)。见表3。

表3 各组大鼠用药结束后血清IL-8检测比较
3 讨论
3.1 前炎症细胞因子对炎症发展和结局的影响 前炎症细胞因子广泛参与机体免疫、炎症、感染等反应,影响疾病的预后,其中TNF-α、IL-1β、IL-2、IL-6、IL-8等是重要的前炎症细胞因子,可触发炎症细胞因子网络级联反应,进一步与血小板激活因子、白三烯、氧自由基、一氧化氮等炎症介质共同作用,推动疾病发生发展[5-6]。
TNF-α作为活化单核-巨噬细胞产生的一种重要细胞因子,在感染性疾病和炎症方面,能刺激血管内皮细胞表达黏附分子、刺激单核-巨噬细胞和其他细胞分泌趋化性细胞因子,引起白细胞在炎症部位聚集,促进炎症反应,适量TNF-α增进机体免疫功能,调节多种免疫细胞共同杀灭和消除入侵的致病原,过度反应的过量TNF-α,则产生剧烈免疫反应,呈现毒性作用,对机体造成损害[7]。IL-1β是旁分泌型细胞因子,能调节炎症反应中纤维蛋白沉积和溶解,增加成纤维细胞胶原酶的产生,刺激成纤维细胞增殖,促进胶原沉积。Wiczyk等[8]发现腹部大手术后患者的早期血清IL-1、TNF-α水平与术后肠粘连、腹腔内粘连有显着联系,认为IL-1和TNF-α术后早期升高,可作为人类术后腹膜粘连形成的可靠生物学标志。Hershlag等[9]实验证明,IL-1是术后腹膜粘连形成的重要短期介质。IL-8在炎症刺激后由巨噬细胞、内皮细胞和其他细胞产生,主要特点是帮助募集中性粒细胞、单核细胞进入炎症部位,调节白细胞黏附分子的表达[10],导致粒细胞浸润、聚集、黏附、脱颗粒,释放溶酶体,呼吸爆发等,参与水肿、渗出等各种炎症过程,与免疫性炎症、感染性疾病、休克等密切相关[11]。
本研究结果显示,血清TNF-α、IL-1β、IL-8水平增高,与大鼠慢性盆腔炎造模密切相关,造模后37 d的模型组,三项指标仍处于异常增高水平,可能反映了局部过度的炎症反应。药物干预后,血清TNF-α、IL-1β、IL-8水平均能降低,且降低幅度大,接近正常组指标的组别,其子宫大体形态学、组织病理学改变越接近正常组和假手术组,这与笔者实验观察结果较一致[12]。因此,推断TNF-α、IL-1β、IL-8可能在慢性盆腔炎发展和结局中发挥重要作用,早期纠正其异常增高的水平,可能是防治慢性盆腔炎的重要环节之一。
3.2 活血化瘀法对前炎症细胞因子的作用 具有活血化瘀功效的中药方剂,能通过多环节调整炎症发展过程,对前炎症细胞因子的作用是其调节炎症网络因子的主要方面之一。刘淑清等[13]证实,益气补肾活血方可通过抑制与骨破坏密切相关的细胞因子TNF-α和IL-1水平,可能是治疗类风湿关节炎的作用机制之一。胡波等[14]研究提示,活血补肾方通过对IL-8、SIgA分泌量的调节起到调节免疫作用,从而对ⅢA型前列腺炎大鼠起治疗作用。慢性盆腔炎(CPID)是指女性盆腔生殖器官及其周围结缔组织、盆腔腹膜发生的慢性炎症性病变,西医妇产科学七年制教材统称为盆腔炎症性疾病后遗症,现代中医妇科学认为,血瘀是本病病机的关键所在。本研究干预药物选用临床确有疗效的妇科经典活血化瘀方剂桂枝茯苓胶囊、少腹逐瘀胶囊,实验结果表明,其作用机理与降低血清TNF-α、IL-1β、IL-8水平,使其接近正常,纠正过度炎症反应密切相关,并与药物剂量存在一定相关性。桂枝茯苓胶囊中剂量组(相当于临床用量)效果明显,可见活血化瘀法通过下调前炎症细胞因子,减轻和消除炎症损伤,抑制炎症发展可能是其防治慢性盆腔炎的主要机理之一。
下一步研究思路:一是桂枝茯苓胶囊的剂量大小与其对慢性盆腔炎大鼠血清前炎症细胞因子降调节的程度,呈现非正比关系,这可能与炎症调控平衡点及实验偏倚有关,需开展更为精确的不同剂量对比实验及可靠性高的重复性试验。二是活血化瘀法防治本病血清前炎症细胞因子之间的变化关系,也有待进一步探讨。
[1]王开强.慢性疼痛与细胞因子[J].国外医学:麻醉学与复苏分册,2001,22(5):313.
[2]Powell S M,Christiaens V,Voulgaraki D,et al.Mechanism of androgen receptor signalling via steroil receptor coactivator-1 in prostate[J].Endocr Relat Cancer,2004,11(1):117-130.
[3]Saba A A,OdziachviliV,MavaniA K,et al. Serum levels of interleukin 1 and tumor necrosis factor alpha correlate with peritoneal adhesion grades in humans after major abdom inal surgery[J]. Am Surg,1988,64(8):734-736.
[4]刘瑞芬,杨晓娜,李伯勤.盆腔炎颗粒治疗慢性盆腔炎的临床与实验研究[J].山东中医药大学学报,2003,27(6):422-425.
[5]中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[6]Such J,Frances R,Perez-Mateo M.Nitric oxide in pa-tients with cirrhosis and bacterial infections[J].MetabBrain Dis,2002,17(4):303-309.
[7]唐海兰.与肿瘤坏死因子-α有关的抑制物[J].暨南大学学报,1998,19(2):89.
[8]Wiczyk H P,Grow D R,Adams L A,et al.Pelvic adhensions contain sex steroid receptors and produce angiogenesis growth factors[J].Fertil Steril,1998,69 (3):511.
[9]Hershlag A,Ottemess I G,Bliven M L,et al.The effect of interleukin-1 on adhesion formation in the rat[J].Am J Obstet Gynecol,1991,165(3):771-774.
[10]Brinkmann A O.TraPman J.Prostate cancer schemes for androgen escape[J].NatMed,2000,6(6):628-629.
[11]Yoshiko S,Tadashi K,Yuji Y,et al.Stimulation of okadaic acid and vanadate in a human promyelocyte cell line an HL-60 Subline[J].J Biolchem,1997,272(28):366.
[12]杨晓娜.活血化瘀法对慢性盆腔炎大鼠炎症细胞因子及粘连相关免疫分子影响的研究[D].山东中医药大学博士学位论文,2009.
[13]刘淑清,陈湘君.益气补肾活血方对佐剂关节炎大鼠IL-1、TNF-α的影响[J].中国中医风湿病学杂志,2008,11(4):92.
[14]胡波,万细丛,傅克辛,等.活血补肾方离子导入对ⅢA型前列腺炎大鼠IL-8、SIgA含量的影响[J].实用中西医结合临床,2009,9(6):1.



